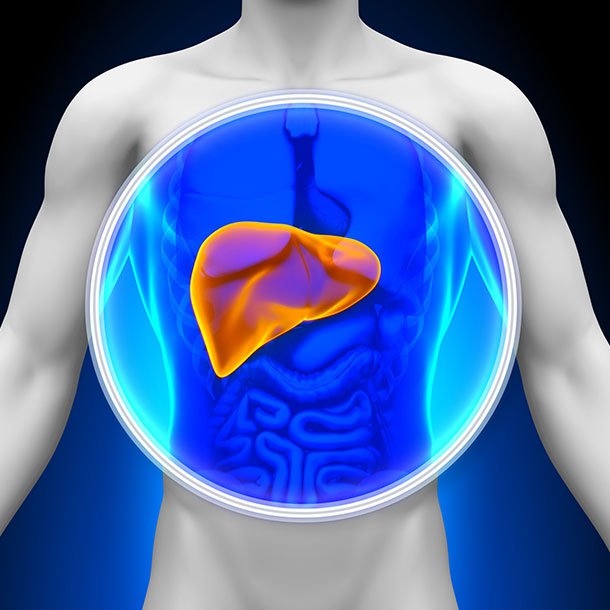
 Järnansamling i levern orsakar ärrbildning i levern (cirros) och en ökad risk för att utveckla levercancer.
Järnansamling i levern orsakar ärrbildning i levern (cirros) och en ökad risk för att utveckla levercancer.
Ärftlig hemokromatos är en ärftlig (genetisk) sjukdom där det finns överdriven ackumulering av järn i kroppen (järnöverskott). Det är en vanlig genetisk störning bland kaukasier i USA, som drabbar cirka 1 miljon människor i USA. Individer som drabbats av ärftlig hemokromatos kanske inte har några symtom eller tecken (och har normal livslängd), eller så kan de ha allvarliga symtom och tecken på järnöverskott som inkluderar sexuell dysfunktion, hjärtsvikt, ledsmärtor, levercirros, diabetes, trötthet och mörkare av huden.
Kroppens normala järnhalt är tre till fyra gram. Den totala mängden järn i kroppen kontrolleras noggrant. Kroppen förlorar ett mg järn dagligen från svett och celler som avges från huden och tarmens inre slemhinna. Kvinnor förlorar också ett mg järn dagligen i genomsnitt från menstruationen. Hos normala vuxna absorberar tarmarna ett mg järn dagligen från maten för att ersätta det förlorade järnet, och därför finns det ingen överskottsansamling av järn i kroppen. När järnförlusterna är större, absorberas mer järn från maten.
Hos individer med ärftlig hemokromatos är den dagliga absorptionen av järn från tarmarna större än den mängd som behövs för att ersätta förlusterna. Eftersom den normala kroppen inte kan öka järnutsöndringen ackumuleras det upptagna järnet i kroppen. Med denna hastighet av järnansamling kan en man med hemokromatos samla 20 gram totalt järn i kroppen vid 40 till 50 års ålder. Detta överskott av järn avlagringar i leder, lever, testiklar och hjärta, vilket orsakar skador på dessa organ och tecken och symtom på hemokromatos. Kvinnor med hemokromatos samlar på sig järn i långsammare takt än män eftersom de förlorar mer järn än män på grund av järnförlust från menstruation och amning. Därför utvecklar de vanligtvis tecken och symtom på organskador på grund av överskott av järn 10 år senare än män.

Höga nivåer av ferritin kan tyda på en järnlagringsstörning som hemokromatos.
Symtomen uppstår eftersom järn ansamlas i organen och leder till förstörelse och förlust av normal funktion.
Andra orsaker till en hög ferritinnivå är kroniska inflammatoriska tillstånd som leversjukdom eller reumatoid artrit eller vissa typer av cancer.
Lär dig mer om ferritin blodprov »
Ärftlig hemokromatos är en autosomal recessiv störning, vilket innebär att en individ har möjligheten att utveckla järnöverskott endast när ett par onormala gener ärvs från båda föräldrarna. (En autosomal recessiv störning skiljer sig från autosomal dominant störning där individer kan utveckla sjukdom genom att ärva en enda onormal gen från endast en förälder.)
Människokroppen består av biljoner celler. Inuti den inre kärnan (kärnan) i varje cell finns kromosomer. Varje mänsklig cell har två uppsättningar av 23 kromosomer (totalt 46 kromosomer). Varje set ärvs från en förälder. Kromosomer innehåller DNA som bär gener som styr alla kroppsfunktioner inklusive cellmetabolism, utseende, längd, intelligens, hår- och ögonfärg och andra fysiska egenskaper. Defekter i DNA (även kallade mutationer) överförs från en generation till nästa och kan ibland orsaka sjukdomar.
Det finns i första hand två mutationer associerade med ärftlig hemokromatos; C282Y och H63D. Siffrorna 282 och 63 anger platsen för defekterna på HFE-genen som finns på kromosom nummer 6. En individ som ärver två C282Y-mutationer (en från varje förälder) kallas en C282Y-homozygot och har en betydande chans att utveckla hemokromatos. Faktum är att C282Y-homozygoter står för majoriteten av fallen av ärftlig hemokromatos. Patienter som ärver en C282Y-mutation från en förälder och en annan H63D-mutation från en annan förälder kallas sammansatta heterozygoter, vilket står för ett litet antal fall av ärftlig hemokromatos.
Personer med tidig hemokromatos har inga symtom och är omedvetna om sitt tillstånd. Sjukdomen kan då misstänkas när förhöjda järnnivåer i blodet noteras genom rutinmässiga blodprover.
De flesta patienter med hemokromatos diagnostiseras mellan 30 och 50 år; och cirka 75 % har inga symtom. Hemokromatos upptäcks när förhöjda nivåer av järn i blodet hittas som en del av rutinmässiga blodprov; eller när blodets järnnivåer mäts som i screeningstudier på familjemedlemmar till patienter med ärftlig hemokromatos. Vissa patienter diagnostiseras med hemokromatos när deras läkare utför järnnivåer i blodet som en del av utvärderingen av onormala förhöjningar av leverenzymer i blodet, ASAT och ALAT. Symtom på hudbrynning eller hyperpigmentering (ca 70 % utvecklar så småningom detta symptom), diabetes, leversjukdom, artropati, hypogonadism, kardiomyopati och impotens eller inga menstruationer (amenorré) kan förekomma och kan tyda på att ytterligare screeningtest som t.ex. transferrinmättnad och andra blod- och levertester beställas.
Det finns flera blodprov som speglar mängden järn i kroppen; ferritinnivå, järnnivå, total järnbindningskapacitet (TIBC) och transferrinmättnad.
Ferritin är ett blodprotein vars nivåer korrelerar med mängden järn som lagras i kroppen. Ferritinnivåerna i blodet är vanligtvis låga hos patienter med järnbristanemi och är höga hos patienter med hemokromatos och andra tillstånd som orsakar en ökning av kroppens järnnivåer. Eftersom ferritin också kan vara förhöjt vid vissa infektioner som viral hepatit och andra inflammatoriska tillstånd i kroppen, är en förhöjd ferritinnivå ensam inte tillräcklig för att korrekt diagnostisera hemokromatos.
Serumjärn-, TIBC- och transferrinmättnad utförs ofta tillsammans. Serumjärn är måttet på mängden järn i serum (den flytande delen av blodet). TIBC är ett mått på den totala mängd järn som kan transporteras i serum av transferrin, ett protein som transporterar järn i serum från en del av kroppen till en annan. Transferrinmättnad är ett tal som beräknas genom att dividera serumjärn med TIBC - det är ett tal som återspeglar hur stor andel av transferrinet som används för att transportera järn. Hos friska individer är transferrinmättnaden mellan 20 % och 45 %. Hos patienter med järnbristanemi är serumjärn- och transferrinmättnaden onormalt låg; och hos patienter med ärftlig hemokromatos kan serumjärn- och transferrinmättnaden vara onormalt hög. Följaktligen, om transferrinmättnaden är cirka 45 % eller högre, bör närvaron av mutationerna C282Y eller H63D undersökas för att bekräfta diagnosen ärftlig hemokromatos.
Eftersom serumjärn kan höjas genom att äta och kan fluktuera under dagen, bör serumjärnmätningar göras fasta, vanligtvis på morgonen före frukost.
Det mest exakta testet för att diagnostisera hemokromatos brukade vara mätningen av järnhalten i levervävnad som erhållits genom en biopsi. En leverbiopsi innebär att ett prov av levervävnad tas bort för analys och utförs vanligtvis med en nål under lokalbedövning. Efter att ha bedövat huden och de underliggande vävnaderna, för läkaren in nålen i levern genom den högra nedre bröstkorgen, ibland under ultraljudsledning. Vävnaden som nålen erhåller studeras under ett mikroskop för tecken på aktiv leversjukdom, fibros och cirros (permanent ärrbildning) och järnhalt (vanligtvis signifikant förhöjd vid hemokromatos).
Leverbiopsien har också prognostiskt värde eftersom den avgör om patienten redan har irreversibel avancerad cirros. Patienter med hemokromatos som har en normal leverbiopsi har en livslängd som liknar andra friska vuxna om de behandlas adekvat, medan patienter med cirros som ett resultat av hemokromatos har signifikant minskad livslängd. Dessutom är riskerna för cirrospatienter att utveckla levercancer (hepatocellulärt karcinom) avsevärt högre än normala patienter, även med adekvat behandling av järnöverskottet med flebotomi. Men med de nyare genetiska testerna bör denna invasiva teknik endast användas under vissa förhållanden och används sällan.
Genen för ärftlig hemokromatos identifierades 1996. Genen kallas HFE-genen. Ärftlig hemokromatos är associerad hos de flesta patienter med två mutationer av HFE-genen; C282Y och H63D. För närvarande betraktar de flesta forskare upptäckt av dessa gener som diagnos av ärftlig hemokromatos.
En C282Y-homozygot är en person som har ärvt en muterad C282Y-gen från varje förälder. En C282Y-homozygot anses löpa stor risk att utveckla järnöverskottssjukdom. Men inte varje C282Y-homozygot utvecklar järnöverskott.
En C282Y/H63D-föreningsheterozygot är en person som har ärvt en muterad C282Y-gen från en förälder och en andra muterad H63D-gen från den andra föräldern. De flesta sammansatta heterozygoter har normala järnnivåer även om vissa kan utveckla mild till måttlig överbelastning av järn.
En C282Y-heterozygot är en person som har ärvt en muterad C282Y-gen från en förälder och en andra normal HFE-gen från den andra föräldern. Barn födda av två C282Y-heterozygoter har 25 % chans att vara en C282Y-homozygot och riskerar därför att utveckla hemokromatos. En C282Y-heterozygot utvecklar inte järnöverskott.
En algoritm för att diagnostisera ärftlig hemokromatos är följande:
Vem bör genomgå leverbiopsi?
Inte alla patienter med hemokromatos behöver genomgå leverbiopsi. Syftet med leverbiopsi är att identifiera de patienter med cirros och att utesluta andra möjliga leversjukdomar. (Patienter med hemokromatos och cirros löper ökad risk för komplikationer, särskilt levercancer.)
Unga patienter (<40 år) som är C282Y-homozygoter med normala leverblodprover och serumferritinnivåer <1000 ng/ml har en mycket låg risk att få cirros i levern. Därför kan dessa patienter behandlas med terapeutisk flebotomi utan leverbiopsi. Deras prognos är utmärkt med adekvat behandling.
Äldre patienter (>40 år) som har serumferritinnivåer>1000 ng/ml och som har onormalt förhöjda leverblodprover kan redan ha utvecklat cirros. Läkare kan rekommendera leverbiopsier till dessa patienter förutsatt att det är säkert för dem att genomgå leverbiopsi.
Den mest effektiva behandlingen för hemokromatos är att minska järn i kroppen genom flebotomi (uttag av blod från armvenerna). En enhet blod, som innehåller 250 mg järn, tas vanligtvis ut varannan till varannan vecka. Serumferritin och transferrinmättnad kontrolleras varannan till var tredje månad. När ferritinnivåerna är under 50 ng/ml och transferrinmättnaderna är under 50 %, reduceras frekvensen av flebotomier till varannan till var tredje månad. När hemokromatos diagnostiseras tidigt och behandlas effektivt kan skador på levern, hjärtat, testiklarna, bukspottkörteln och lederna förhindras helt och patienterna upprätthåller normal hälsa. Hos patienter med etablerad cirros kan effektiv behandling förbättra hjärtats funktion, hudfärg och diabetes. Men skrumplever är irreversibel och risken att utveckla levercancer kvarstår.
Fördelarna med terapeutisk flebotomi vid hemokromatos är följande:
Levercancer (hepatom eller hepatocellulär cancer) förekommer främst hos patienter med cirros. Därför bör patienter med hemokromatos och cirros ha ultraljudsundersökningar i buken och blodprover för alfa-fosterprotein (ett protein som produceras av levercancer) var sjätte månad.
 Vad gör du om din mage gör riktigt ont?
Vad gör du om din mage gör riktigt ont?
 Känna till symptomen på ulcerös kolit
Känna till symptomen på ulcerös kolit
 Akut mezenterialny lymfadenit - Diagnos av akut buk
Akut mezenterialny lymfadenit - Diagnos av akut buk
 Mer rått nötkött återkallas på grund av salmonella:USDA
Mer rått nötkött återkallas på grund av salmonella:USDA
 Tarminkontinens
Tarminkontinens
 Så tar du hand om din matsmältningshälsa:regelbunden konsumtion av fermenterad mjölk kan förbättra milda matsmältningssymtom
Så tar du hand om din matsmältningshälsa:regelbunden konsumtion av fermenterad mjölk kan förbättra milda matsmältningssymtom
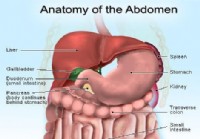 Bukadhesioner
Vad är buksammanväxningar? Bild på organen och körtlarna i buken Abdominala sammanväxningar är viktiga eftersom de är en vanlig orsak till buksymtom, särskilt buksmärtor och de kan orsaka tarmblocke
Bukadhesioner
Vad är buksammanväxningar? Bild på organen och körtlarna i buken Abdominala sammanväxningar är viktiga eftersom de är en vanlig orsak till buksymtom, särskilt buksmärtor och de kan orsaka tarmblocke
 Användning av CT-skanning hos barn har minskat under det senaste decenniet
De senaste nyheterna om hälsosamma barn Babys matningsproblem kopplade till utvecklingsförseningar Hennes arm fastnade i familjens löpband Är du orolig för din tonårings användning av sociala medier?
Användning av CT-skanning hos barn har minskat under det senaste decenniet
De senaste nyheterna om hälsosamma barn Babys matningsproblem kopplade till utvecklingsförseningar Hennes arm fastnade i familjens löpband Är du orolig för din tonårings användning av sociala medier?
 SIBO-vänlig Alla hjärtans dag-måltid
Allt du behöver är kärlek, sa The Beatles och på Alla hjärtans dag vill många av oss mer än någon annan dag på året laga en måltid för att visa nära och kära att vi bryr oss. Så i år ger vi dig en två
SIBO-vänlig Alla hjärtans dag-måltid
Allt du behöver är kärlek, sa The Beatles och på Alla hjärtans dag vill många av oss mer än någon annan dag på året laga en måltid för att visa nära och kära att vi bryr oss. Så i år ger vi dig en två