cytoreduserende kirurgi pluss hyper intraperitoneal kjemoterapi forbedrer overlevelsen av magekreft med peritoneal karsinomatose: bevis fra en eksperimentell studie
Abstract
Bakgrunn
cytoreduserende kirurgi (CRS) pluss hyper intraperitoneal kjemoterapi (HIPEC) har vært ansett som en lovende behandlingsform for magekreft med peritoneal karsinomatose (PC). Men det har også vært mange debatter om effekt og sikkerhet av denne nye tilnærmingen. Resultater fra eksperimentell dyremodell studien kan bidra til å gi pålitelig informasjon. Denne studien var å undersøke sikkerhet og effekt av CRS + HIPEC å behandle magekreft med PC i en kanin modell
. Metoder
VX2 tumorceller ble injisert i mage submucosa av 42 mannlige New Zealand kaniner ved hjelp av en laparotomic implantasjon teknikk, å konstruere kanin modell av magekreft med PC. Kaninene ble randomisert inn i kontrollgruppen (n = 14), CRS alene (n = 14) og CRS + HIPEC gruppe (n = 14). Kontrollgruppen ble observert for naturlige løpet av sykdomsprogresjon. Behandlingene ble startet på dag 9 etter tumorceller inokulering, inkludert maksimal fjerning av tumorknuter i CRS alene gruppe, og maksimal CRS pluss heperthermic intraperitoneal chemoperfusion med docetaxel (10 mg /kanin) og karboplatin (40 mg /kanin) på 42,0 ± 0,5 ° C i 30 minutter i CRS + HIPEC gruppe. Det primære endepunktet var total overlevelse (OS). De sekundære endepunktene var kroppsvekt, biokjemi, store organfunksjoner og alvorlige bivirkninger (SAE).
Resultater
Rabbit modell av magekreft med PC ble opprettet i alle dyr. De clinicopathological funksjonene i modellen var like menneskelige mage PC. Median OS var 24,0 d (95% konfidensintervall 21,8 til 26,2 d) i kontrollgruppen, 25,0 d (95% CI 21,3 til 28,7 d) i CRS gruppe, og 40,0 d (95% CI 34,6 til 45,4 d) i CRS + HIPEC gruppen (P
= 0,00, log rank test). Sammenlignet med CRS bare eller kontroll-gruppe, kan CRS + HIPEC forlenge OS med minst 15 d (60%). På grunnlinjen, på operasjonsdagen og på dag 8 etter operasjonen, de perifere blodceller teller, lever og nyre funksjoner og biokjemiske parametere var alle sammenlignbare. SAE skjedde i 0 dyr i kontrollgruppen, 2 dyr i CRS alene gruppen inkludert en dyr død på grunn av anestesi overdose og annen død på grunn av postoperativ blødning, og 3 dyr i CRS + HIPEC gruppen inkludert en dyr død på grunn av anestesi overdose, og to dyr dødsfall på grunn av diaré 23 og 27 d etter operasjonen.
Konklusjoner
i denne kanin modell av magekreft med PC, CRS alene ikke kunne bringe nytte mens CRS + HIPEC med docetaxel og karboplatin kunne gi en betydelig forlenge overlevelsen med akseptabel sikkerhet.
Bakgrunn
lokoregionalt progresjon av magekreft vanligvis resulterer i peritoneal karsinomatose (PC), preget av tilstedeværelsen av tumorknuter av ulike størrelse, antall og fordeling på peritoneal overflaten samt ondartet ascites , med svært dårlig prognose [1-5]. Pasienter med mage PC ansiktet en forferdelig kamp utfallet, med en median overlevelse på ca 6 måneder [6].
Dagens behandling for en slik PC er systemisk kjemoterapi, best støtte pleie og lindrende behandling. For å takle dette problemet, en ny behandlingsform som kalles cytoreduserende kirurgi (CRS) pluss hyper intraperitoneal kjemoterapi (HIPEC) har blitt utviklet i løpet av de siste 3 tiår, tar fordeler av kirurgi for å redusere synlige tumorbyrde, og regional hyper cellegift for å utrydde mikrometastaser [7-10]. Selv om mange kliniske studier er utført for å teste og bekrefte effekten av denne kombinerte behandlingstilnærming, er det en mangel på høy kvalitet bevis fra fase III randomiserte prospektive studier. For å få mer objektivt vurdere slik behandling, er det nødvendig å studere denne behandlingsform under eksperimentelle betingelser, hvor de fleste av de forstyrrende faktorer kan være godt kontrollert. I dette henseende er egnede dyremodeller av PC er uunnværlig plattformer. Det er etablert små dyremodeller av PC, inkludert musemodeller og rottemodeller [11-18]. I de fleste av disse dyremodeller, har kreftceller injiseres direkte inn i peritoneum, noe som vil resultere i utstrakt PC i rett tid. Slike modeller har blitt brukt til å teste forskjellige behandlingsformer inkludert CRS og HIPEC, enten alene eller i kombinasjon, for fremstilling av verdifull informasjon om gyldigheten av forskjellige terapier. Den lille kroppsstørrelse og delikat hemodynamiske forhold er begrensende faktorer for komplekse kirurgiske inngrep. Store dyremodeller av PC kan være mer egnet for utstrakt kirurgisk behandling. Derfor er det nødvendig å etablere store dyremodell av PC fra magekreft for eksperimentelle studier for å teste omfattende CRS og HIPEC.
I vår forrige undersøkelse [19], har vi etablert en stabil kanin modell av magekreft med PC ved å injisere VX2 kreftceller til submucosal lag av magen. Modellen er preget av typisk ulcerøs magekreft med progressiv PC, noe som gjør den mer egnet for kirurgiske intervensjonsstudier for å evaluere CRS og HIPEC mot mage PC.
Denne kaninen modell av magekreft med PC har gitt oss med egnet plattform for å vurdere ulike terapeutiske tilnærminger mot PC. Denne studien ble utformet for å evaluere effekt og sikkerhet av CRS + HIPEC for behandling av denne store dyremodell av mage PC, for å gi støtte til klinisk anvendelse
. Metoder
Dyr
Førti to mannlige Ny Zealand hvite kaniner, kroppsvekt mellom 1.8-2.9 kg (Median 2,0 kg), ble hentet fra Animal biosikkerhetsnivå 3 Laboratory på Animal Experimental Center of Wuhan University (Animal Study Certificate SCXK 00002826). Dyrene ble individuelt plassert og fri adgang til standard laboratorium mat og vann, samt 12 timer med lys og mørke syklus per dag. Dyret studieprotokoll ble godkjent av Animal Welfare Committee for Senter.
Bygging av kanin modell av VX2 magekreft med PC
Rabbit VX2 karsinom ble brukt til å etablere magekreft med PC i denne studien. Dyrene ble bedøvet ved ørevenen injeksjon av 1% natrium-pentobarbital (30 mg /kg). Abdominal hud ble rengjort og desinfisert. Tumorceller ble injisert inn i magen submucosa lag for å konstruere kaninmodeller av PC som tidligere beskrevet [19]. Kort fortalt, en midtlinjen snitt på 3 cm lang ble laget begynner 2 cm under xyphoid og øvre del av magen var åpen. Magen ble eksponert, 0,1 ml av tumorceller (5 x 10
10 ampulle celler /L) ble injisert i submucosal lag av magen, gjennom serøse laget og muskellaget, injeksjonsstedet ble presset i 1 minutt for å holde de injiserte tumorcellene på plass, og magen ble lukket med et dobbelt lag 3-0 Vicryl avbrutt sutur. Etter tumor-inokulering, Penicillin G i en dose på 100.000 IU /d ble intramuskulært injisert i hvert dyr i 3 d.
Randomisering og behandling
Når dyremodell konstruksjon er blitt bekreftet vellykket på dag 9 etter operasjon, ble disse kaniner randomisert inn i 3 grupper ifølge en datagenerert random nummer, 14 dyr i hver gruppe (figur 1). Figur 1 studieprotokoll. Etter bygging av PC-modellen av magekreft, ble 42 New Zealand hvite kaniner randomisert i 3 grupper med 14 kaniner per gruppe, og effektene av CRS og CRS + HIPEC ble undersøkt. D, dagen; PC, peritoneal karsinomatose; CRS, cytoreduserende kirurgi; HIPEC, hyper intraperitoneal kjemoterapi.
Kontrollgruppen ble observert for naturlige løpet av sykdomsprogresjon uten innblanding.
For CRS alene gruppen, ble CRS utført på d ni etter kreftceller vaksinasjon. Kaniner ble gitt 1% natrium-pentobarbital (30 mg /kg) intravenøst for anestesi. Abdominal hud ble rengjort og desinfisert. Abdominal leting ble utført gjennom en midtlinjen snitt på 8 cm lang begynner 1 cm under xyphoid. Når bukveggen var åpne, ble detaljert evaluering av PC utført i forskjellige regioner, inkludert parietal peritoneum, visceral peritoneum, omentum, mage, lever, milt, tynntarm, tykktarm, blære og andre bekken vev. Deretter ble maksimal CRS utført inkludert en rutine Omentektomi, og optimal fjerning av tumorknuter. Unresectable svulster ble cauterized. Gastrisk tumor i seg selv, derimot, ble ikke fjernet, men behandlet ved injeksjon av absolutt alkohol. Etter fullførelse av CRS bukveggen ble stengt i 2 lag ved hjelp av 3-0 Vicryl constinuous suturer.
For CRS + HIPEC gruppe, ble maksimal CRS utført på d 9 på samme måte som i den CRS alene gruppen, som umiddelbart etterfulgt av HIPEC like før nedleggelsen av bukhulen. Åpne HIPEC ble utført, som denne åpne teknikken ble antatt å gi optimal termisk homogenitet og romlig spredning [20, 21], med 250 ml oppvarmet saltvann som inneholder 10 mg docetaxel (Wanle Pharmaceutical Co., Ltd Shenzhen, Kina.) Og 40 mg karboplatin (Qilu Pharmaceutical Co., Ltd Shandong, Kina.) for hvert dyr. Bukhulen ble skyllet to ganger med 250 ml normal saltoppløsning forvarmet til 42,0 ° C og perfusjon rør ble plassert i bekkenhulen like før HIPEC. Perfusjon utstyr besto av en miniatyr-varmeveksleren og en valse pumpe, slik at perfusjon med en variabel dynamisk strømnings 6 - 12 ml /min. En tilsig kateter ble satt inn i øvre del av magen mellom nedsatt og diafragma overflate og en strøm kateter ble plassert på bekkenbunnen. Perfusjon Løsningen ble oppvarmet til 42,0 ± 0,5 ° C og sprøytes inn i bukhulen med en hastighet på 10 ml /min inn i innstrømningsrøret innført fra den automatiske perfusjon pumpen. Perfusjon i det peritoneale hulrom ble omrørt manuelt for å gjøre lik romlig fordeling. Temperaturen av perfusjon oppløsning i peritoneal plass ble holdt ved 42,0 ± 0,5 ° C og overvåket ved hjelp av et termometer i sanntid. Den totale HIPEC Tiden var 30 minutter, hvoretter løsningen perfusjon i bukhulen ble fjernet.
Tjue minutter før operasjonen, 100 ml 0,9% NaCl-oppløsning med 1 g av ceftriakson pulver, 2 ml 10% kaliumkloridoppløsning og 20 ml 50% glukoseoppløsning ble infusert intravenøst for rehydrering, energi støtte og infeksjonskontroll i både CRS alene gruppen og den CRS + HIPEC gruppe. Slik behandling ble fortsatt i 3 d.
Animal observasjon og sykdomsforløp overvåking
generell status av dyrene ble daglig tatt opp i et standard skjema. For patologiske studier, ble dødshjelp utført på kaniner ved overdose injeksjon av 1% pentobarbital natrium gjennom øret blodåre. Post mortem patologiske undersøkelser vist brutto patologi som tumorstørrelse og distribusjoner; lokale tumor funksjoner i magekreft som sårdannelse, obstruksjon og perforasjon; særtrekk ved peritoneal karsinomatose som blodig ascites, diskrete eller konfluente tumornoduler på bukhinnen, omentum kake og tarm hindringer; metastaser til viktige organer som lever, binyrer, bukspyttkjertel og lungene.
For laboratoriestudier, 5 ml blod ble høstet fra øre blodåre på dagen før kreftceller inokulasjon som grunnlinjen, på operasjonsdagen, og på d 8 etter operasjonen. Prøvene ble brukt for rutine perifert blod testen, lever- og nyrefunksjoner tester og biokjemiske tester
. Statistical Analysis
Det primære endepunktet var total overlevelse (OS) i hver gruppe, definert som tidsintervallet skjemaet dyremodell bygging til dyr død på grunn av enhver årsak, inkludert kreft fremgang. De sekundære endepunktene var kroppsvekt, biokjemi, store organfunksjoner og alvorlige bivirkninger (SAE), som ble definert som alvorlig lokal og /eller systemisk infeksjon eller død på grunn av inngrepet.
I vår forrige undersøkelse for å konstruere denne dyremodell lærte vi at median overlevelse av denne mage PC-modellen er ca 3 uker [19]. Derfor har vi beregnet størrelsen på utvalget i denne studien basert på denne informasjonen. Denne studien er designet for å påvise minst 30% absolutte forskjell i OS. Med en statistisk styrke på 90% for å påvise en slik forskjell ved 5% signifikansnivå ble minst 12 dyr som kreves i hver gruppe. Tatt i betraktning av uforutsette hendelser under utførelsen av studien, vi utvidet prøvestørrelsen til 14 dyr i hver gruppe. variabler kategorisert i de to gruppene ble sammenlignet med khikvadrattest eller Fishers eksakte test. De numeriske data var direkte registrert, og kategoridata ble registrert i forskjellige kategorier. Kaplan-Meier metoden ble brukt til å sammenligne overlevelse, med log rank test. Data ble analysert ved hjelp av statistikkprogrammet for samfunnsvitenskap (SPSS Inc., Chicago, Illinois, USA), versjon 13.0 med to-sidig P
< 0,05 som statistisk signifikante.
Resultater
histopatologiske kjennetegn PC
Rabbit magekreft PC-modellen ble etablert i alle dyr (100%, 42/42). Ni dager etter at tumorcellene inokulering, mange små, harde og gjennomsiktige tumorknuter utviklet på større omentum, og typisk ulcerøs kreft ca 0,5 cm i diameter dannet på antrum av magen. Ingen ascites ble observert. Ingen åpenbare PC ble funnet i andre regioner. Det var ingen forskjeller i PC alvorlighetsgrad blant tre grupper. Dette kan være tilsvarende klinisk stadium I peritoneal karsinomatose av Gilly kriterier [6].
Typisk ulcerøs kreft med PC ble observert i post mortem patologiske undersøkelser av kaniner i kontrollgruppen. Veggen i magesekken ble helt invadert av tumoren for å skape kreft sår omsluttet av konfluente knuter på større omentum, danner en stor svulst-blokk. Bukveggen og membranen ble helt invadert av tumoren. Mange tumorknuter dannet på tarmveggen, mesenteriet og retroperitoneum. Blodig ascites kan være mer enn 100 ml. Alle funksjonene er lik clinicopathologic karakteristikk av magekreft med PC hos pasienter.
Kroppsvekt endringer
kroppsvekten til hvert dyr ble registrert hver 3 d. Ingen signifikante forskjeller ble funnet i opprinnelige kroppsvekt på 3 grupper før behandlingen. Perioperative kroppsvekten gått ned i alle grupper på grunn av den faste over natten. I kontrollgruppen, kroppsvekten gjenopprettes når matinntak ble gjenopptatt, men igjen sank gradvis til studien endepunkt. I de 2 behandlingsgruppene, redusert postoperativ kroppsvekt betydelig i løpet av de første 3 d etter operasjonen og deretter nedgang ble forsiktig sammen med den økte matinntaket i følgende fem di 2 behandlingsgruppene. Deretter, redusert kroppsvekt gradvis igjen til studiet endepunkt i CRS alene gruppe, mens kroppsvekt kunne opprettholdes eller noe økt for den følgende 20 d CRS + HIPEC gruppe og sank langsomt til studiet endepunkt (figur 2). Figur 2 kroppsvekt endringer i 3 grupper av kaniner. Sammenlignet med kontroll og CRS grupper, opplevde CRS + HIPEC gruppen tregere vekttap, selv om forskjellene mellom de 3 gruppene ikke nådde statistisk signifikans.
Blood profilendringer
På grunnlinjen, på operasjonsdagen og på dag 8 etter operasjonen, de perifere blodceller teller, lever og nyre funksjonstester og biokjemi parametere var alle sammenlign (tabell 1) .table en blod~~POS=TRUNC tester og biokjemiske testresultater
|
Range (median)
|
Parametere
Control (n = 14) <.no> CRS (n = 14)
CRS + HIPEC (n = 14)
P
perifert blod tester
A
139 ~ 156 (149)
129 ~ 139 (131)
124 ~ 141 (131)
NS
HGB (G /L)
B
112 ~ 130 (128 )
102 ~ 137 (121)
104 ~ 30 (126)
NS
C
78 ~ 135 (117)
62 ~ 123 (100)
80 ~ 103 (92)
NS
A
6,55 ~ 7,30 (6,77)
6,19 ~ 6,80 (6,77)
5,98 ~ 6,48 (6,29)
NS
RBC (× 109 /L)
B
5,19 ~ 6,18 (5,76)
5,26 ~ 6,54 (5,60)
4,87 ~ 6,37 (6,14)
NS
C
4,27 ~ 6,14 (5,26 )
2,26 ~ 5,76 (5,30)
3,97 ~ 4,70 (4,34)
NS
A
4,0 ~ 10,1 (6,5)
7,4 ~ 9,9 (8,8)
4,2 ~ 8,7 (4,7)
NS
WBC (× 109 /l)
B
6,5 ~ 11,3 (8,0)
4,8 ~ 10,3 (9,1)
7,1 ~ 9,4 (9,2)
NS
C
7,7 ~ 18,2 (9,2)
3,2 ~ 8,3 (4,9)
10,0 ~ 8,3 (9,2)
NS
A
1,3 ~ 3,8 (2,7 )
2,2 ~ 5,9 (4,5)
2,9 ~ 3,8 (3,2)
NS
Neu (× 109 /l)
B
1,8 til 4,3 (3,8)
1.4 ~ 8,4 (3,6)
2,6 ~ 3,8 (3,1)
NS
C
1,1 ~ 4,8 (3,0)
0,7 ~ 4,1 (2,0)
4,2 ~ 4,8 (4,5)
NS
A
169 ~ 385 (320)
158 ~ 410 (267)
94 ~ 415 (319)
NS
PLT (× 109 /l)
B
68 ~ 434 (231)
103 ~ 398 (232)
232 ~ 682 (360)
NS
C
302 ~ 663 (324)
12 ~ 59 (27)
36 ~ 426 (231)
NS
leverfunksjonstester, En
15 ~ 24 (22)
34 ~ 44 (35)
15 ~ 24 (22)
NS
AST (U /L)
B
28 ~ 91 (75)
65 ~ 72 (66)
36 ~ 8 (69)
NS
C
27 ~ 30 (29)
14 ~ 22 (20)
15 ~ 19 (17)
NS
A
28 ~ 43 (36 )
65 ~ 72 (66)
36 ~ 81 (69)
NS
ALT (U /L)
B
12 ~ 41 (26)
16 ~ 38 (26)
19 ~ 89 (29)
NS
C
42 ~ 131 (50)
54 ~ 90 (85)
71 ~ 95 (83)
NS
A
60,7 ~ 77,0 (66,1)
62,8 ~ 66,5 (66,0)
58,4 ~ 66,3 (63,8)
NS
TP (g /L)
B
58 0,0 ~ 69,9 (62,3)
56,5 ~ 69,6 (62,8)
53,2 ~ 71,5 (59,9)
NS
C
61,1 ~ 65,6 (62,8)
46,3 ~ 63,7 (55,8)
50,2 ~ 57,8 (54,0)
NS
A
37,3 ~ 41,2 (39,6)
36,6 ~ 41,8 (40,6)
32,0 ~ 41,2 (39,6)
NS
ALB (g /L)
B
35,0 ~ 41,4 (37,1)
31,3 ~ 39,8 (35,8)
32,5 ~ 38,4 (34,9)
NS
C
34,6 ~ 38,9 (36,3)
26,4 ~ 37,4 (30,9)
30,7 ~ 32,8 (31,8)
NS
A
23,4 ~ 35,8 (26,6)
24,8 ~ 26,3 (25,7)
26,4 ~ 32,6 (26,6)
NS
GLB (g /L)
B
22,2 ~ 28,5 (25,5)
24,4 ~ 32,2 (27,3)
19,7 ~ 33,1 (25,2)
NS
C
23,9 ~ 29,3 (26,5)
19,9 ~ 26,3 (24,9)
19,5 ~ 25,0 (22,3)
NS
A
126 ~ 190 (159)
127 ~ 248 (147)
159 ~ 186 (172)
NS
ALP (U /L)
B
78 ~ 145 (98)
45 ~ 177 (86)
51 ~ 133 (89)
NS
C
73 ~ 118 (80)
58 ~ 114 (79)
52 ~ 114 (83)
NS
nyrefunksjonstester, En
6,24 ~ 15,08 (6,95)
6,47 ~ 7,68 (7,47)
7,28 ~ 8,44 (8,16)
NS
BUN (mmol /L)
B
8,83 ~ 14.77 (12.24)
0,59 ~ 16.64 (10.18)
6,82 ~ 14,94 (7,92)
NS
C
5,45 ~ 6,45 (6,27)
5,33 ~ 7,07 (6,61)
4,83 ~ 6,45 (5,64)
NS
A
81,0 ~ 121,2 (86,5)
80,6 ~ 99,2 ( 85.4)
81,0 ~ 95,3 (83,7)
NS
Cr (mikromol /L)
B
75,0 ~ 99,0 (94,9)
70,4 ~ 107,4 (88,8)
85.8 ~ 97,8 (91,6)
NS
C
67,3 ~ 85,6 (75,7)
60,3 ~ 69,9 (62,2)
65,8 ~ 66,9 (66,4)
NS
Elektrolytter
En
4,10 ~ 18,97 (4,66)
3,52 ~ 4,72 (4,21)
3,99 ~ 10,97 (4,30)
NS
K + (mmol /L)
B
7,34 ~ 27,13 (10,44)
4,44 ~ 11,09 (6,29)
4,34 ~ 12,29 (4,74)
NS
C
5,14 ~ 5,91 (5,18)
4,98 ~ 6,08 (5,14)
5,31 ~ 6,32 (5,82)
NS
A
139,1 ~ 148,7 (145,3)
142,8 ~ 148,8 (144,2)
142,2 ~ 145,3 (144,7)
NS
na + (mmol /L)
B
124,5 ~ 146,4 (140,4)
137,3 ~ 148,5 (141,65)
133,6 ~ 146,4 (141,1)
NS
C
133,2 ~ 138,7 (133,5)
132,9 ~ 138,9 (135,3)
133,8 ~ 134,3 (134,1)
NS
A
99,8 ~ 121,2 (102,6)
101,9 ~ 107,2 (103,5)
100,5 ~ 110,2 (102,1)
NS
Cl- (mmol /L)
B
94,6 ~ 103,9 (96,6)
96,6 ~ 107,7 (101,1)
97,0 ~ 106.6 ( 100,8)
NS
C
100,0 ~ 104,1 (103,7)
102,2 ~ 106,6 (104,7)
103,8 ~ 104,2 (104,0)
NS
A
3,11 ~ 3,77 (3,39)
3,05 ~ 3,18 (3,12)
3,18 ~ 3,69 (3,63)
NS
Ca ++ (mmol /L)
B
2,80 ~ 4,04 (3,70)
3,41 ~ 3,96 (3,71)
3,32 ~ 3,96 (3,66)
NS
C
3,71 ~ 4,10 (3,80)
3,19 ~ 3,56 (3,45)
3,48 ~ 3,52 (3,50 )
NS
RBC: røde blodceller; WBC: hvite blodlegemer; HGB: hemoglobin; Neu: nøytrofile telle; PLT: blodplater teller; ALT: alanin transami; AST: aspartataminotransferase; A: Ved baseline; B: På dagen for operasjonen; C: På d 8 etter operasjonen; TP: total protein; ALB: albumin; GLB: globulin; BUN: blod urea nitrogen; Cr. Kreatinin
Survival
Dyrene i kontrollgruppen fikk ikke noen aktiv kirurgisk behandling, og bare observert for naturhistorie av sykdomsprogresjon. For dyr i begge CRS og CRS + HIPEC grupper, ble fullstendig cytoreduksjon oppnås enten ved kirurgisk reseksjon eller cauterization for peritoneal karsinomatose, etterlot ingen observer tumornoduler i bukhulen. Gastrisk tumor i seg selv, derimot, ble ikke fjernet, men behandlet ved injeksjon av absolutt alkohol. Median OS var 24,0 d (95% CI 21,8 til 26,2 d) i kontrollgruppen, 25,0 d (95% CI 21,3 til 28,7 d) i CRS gruppe, og 40,0 d (95% CI 34,6 til 45,4 d) i CRS + HIPEC gruppen (P
= 0,00, log rank test). Sammenlignet med CRS bare eller kontroll-gruppe, kan CRS + HIPEC forlenge OS med minst 15 d (60%) (figur 3). Figur 3 Kaplan-Meier overlevelseskurver for kontroll, CRS alene, og CRS + HIPEC grupper. Sammenlignet med CRS bare eller kontroll-gruppe, kan CRS + HIPEC forlenge OS med minst 15 d (60%). (P
= 0,00, log rank test)
post mortem patologiske undersøkelser
Avliving ble utført på de døende kaniner ved overdose injeksjon av 1% pentobarbital natrium gjennom øret blodåre. Detaljert informasjon om postmortem patologiske undersøkelser ble oppført i tabell 2.Table 2 Resultater av post mortem patologisk studie i 3 grupper *
|
Control ( n = 14)
CRS (n = 12) *
CRS + HIPEC (n = 13) §
P
Ulcerøs mage kreft
100%
100%
100% hoteller, NA
Pyloric hindring
100%
100%
100% hoteller, NA
Gastric perforasjon
28.6%
8,3%
8,3%
P
= 0,246
Greater omentum kake
100%
fjernet
fjernet hoteller, NA
Liver metastaser
100%
96,7%
38,5%
P = 0.000
lungemetastaser
0,0%
8,3%
53,8%
P = 0.000
Cancerous membran
100%
100%
53,8%
P = 0.000
Øvre bukveggen kreft
100%
100%
84,6%
P
= 0,128
Tynntarmen tarmen~~POS=HEADCOMP & mesentery seeding
100%
100%
61,5%
P = 0,002
binyrene metastaser
100%
100%
23,5%
P = 0.000
Nyre kapsel invasjon
100%
75,0%
30,8%
P = 0.000
retroperitoneum metastaser
100%
100%
76,9%
P = 0,038
bekken seeding
100%
100%
69,2%
P = 0,009
Urin retensjon
57,1%
75,0%
61,5%
P
= 0.641
Blodig ascites
100%
100%
38,5%
P = 0.000 product: * To dyr ble ekskludert i CRS-gruppen, inkludert en død på grunn anestesi overdose på d ni og en annen død på grunn av postoperativ blødning på d 10.
§ Ett dyr i CRS + HIPEC gruppen ble ekskludert på grunn av anestesi overdose død på d 9. hoteller, NA: ikke anvendelig.
Alvorlige bivirkninger
SAE skjedde i 0 dyr i kontrollgruppen, 2 dyr i CRS alene gruppen inkludert en død som følge av anestesi overdose (OS = 9 d) og en annen død på grunn av postoperativ blødning (OS = 10 d), og tre dyr i CRS + HIPEC gruppen inkludert en død som følge av anestesi overdose (OS = 9 d), og 2 dødsfall på grunn av diaré 23 og 27 d etter operasjonen. En direkte sammenligning i patologiske på d 27 fra en kanin i CRS gruppe (figur 4A) og en kanin i CRS + HIPEC gruppe (figur 4B) viste signifikante forskjeller i PC alvorlighetsgrad. Figur 4 På dag 27, post mortem patologiske undersøkelser av en kanin i CRS-gruppen (2A) og en kanin i CRS + HIPEC gruppen (2B). I CRS gruppe, utbredt PC tilbakefall var tydelig selv etter sytoreductive kirurgi. I CRS + HIPEC gruppen, har hyper chemoperfusion betydelig tilbakestående PC tilbakefall.
Diskusjon
Denne studien gitt nye bevis for å støtte CRS + HIPEC å behandle mage PC. Sammenlignet med kontrollgruppen og CRS alene gruppe, kan den CRS + HIPEC gruppe har en ekstra overlevelse økning på minst 15 d (60%). I tillegg til en slik betydelig overlevelse fordel, har andre forbedringer også blitt observert, inkludert kroppsvekt, PC alvorlighetsgrad, ascites, lever- og nyrefunksjoner, og blodelektrolytter.
Denne studien antyder også at i etablert mage PC, ganske enkelt å utføre CRS kan ikke ta med overlevelsesgevinst. Dyrene i CRS gruppen hadde en median overlevelse på 25 d, som ikke er signifikant forskjellig fra 24 d i kontrollgruppen.
PC er blitt stadig mer anerkjent som et viktig klinisk problem og økende innsats har vært viet til å undersøke mekanismen og mestringsstrategier mot denne sykdommen. Kliniske studier av valgt mage eller kolorektal PC pasienter har gitt bevis i favør av CRS + HIPEC for disse pasientene, og den eneste fase III prospektiv randomisert studie med kolorektal PC pasientene rapporterte en median overlevelse fordel av 70% gevinst i total overlevelse (22,4 måneder i CRS + HIPEC gruppen VS
12,6 måneder med standard palliativt alene) [22]. De oppmuntrende resultatene etter Yonemura [8] og Glehen [9] i mage PC gitt mer overbevisende bevis for å støtte denne kombinerte behandlingsform. Ikke desto mindre strids om nytten og verdien av en slik tilnærming forbli [23, 24]. Det virker usannsynlig at dette problemet vil bli løst innen kort tid i randomiserte kliniske studier. Derfor er det nødvendig å studere behandlingsform under eksperimentelle forhold, der de fleste av konfunderende faktorer kan være godt kontrollert for mer objektiv vurdering av HIPEC.
I de senere årene, økende antall dyremodeller for PC har blitt nøye studert , inkludert naken mus modell av magekreft PC konstruert ved å implantere humane magecancerceller [25-28]; mus tykktarmskreft PC-modellen konstruert ved å injisere tykktarmskreftceller i bukhulen til Balb /C-mus [29]; rotte tykktarmskreft PC-modeller konstruert gjennom injiserende CC531 colon carcinoma celler i bukhulen av Wag /rij rotter [15, 30-33] eller sprøyte syngene kolon adenokarcinomceller (DHD /K12 /TRB) i bukhulen av atymiske BD IX /HansHsd rotter [14, 18, 34, 35]; murine xenograft PC-modell av appendiceal mucinous adenokarsinom konstruert ved å implantere humane appendiceal svulster inn i bukhulen til homozygote nakne mus [36]; mus eggstokkreft PC-modellen konstruert ved å injisere humane serøse eller ovarialcancer celler i bukhulen hos mus [37-39] eller injisering av muse-ovarie overflate-epitelceller (ID8 celler) under ovarial bursa av C57BL6 mus [39].
Sammenlignet med de små dyr PC-modeller, vår kanin modell av mage PC er den første store dyr PC-modell, mer egnet for kompliserte kirurgiske intervensjonsstudier som CRS + HIPEC. I tillegg gjengir denne modellen hele patologiske prosessen fra primære magekreft til utvikling av PC, ligner den komplette klinisk-patologiske trekk ved menneskelig gastric PC.
Så vidt vi vet, har det vært 3 rapporter i litteraturen om effekten av CRS + HIPEC i eksperimentelle dyremodeller av PC. Klaver et al [34] brukte rotte tykktarmskreft PC-modell for å teste om tilsetting av HIPEC til CRS er avgjørende for overlevelse fordel. Rottene ble randomisert inn i 3 behandlingsgrupper på 20 rotter hver, CRS alene, CRS + HIPEC (mitomycin 15 mg /m 2 ved 42,0 ° C i 90 min) og CRS + HIPEC (mitomycin C 35 mg /m 2 ved 42,0 ° C i 90 min). CRS + HIPEC oppnådd en betydelig overlevelse gevinst på over 120% (median overlevelse på 43, 75 og 97 d, P
< 0,01). Pelz et al [15] brukt lignende rottetykktarmskreft PC-modell for å undersøke HIPEC. Etter 10 d av tumorceller inokulering, ble rottene tilfeldig delt inn i 3 grupper på 6 dyr hver, kontroll, HIPEC (mitomycin C 15 mg /m 2 på 40,5 til 41,5 ° C i 90 min), og normathermic intraperitoneal kjemoterapi ( mitomycin C 10 mg /m 2 ip). Selv om studien ikke rapportere total overlevelse, gjorde HIPEC gruppen har betydelig mindre svulst i vekt, færre tumornoduler, nedsatt kreft indeks og bedre klinisk komplett responsrate sammenlignet med kontroll eller normathermic ip mitomycin behandling alene. I en tilsvarende studie på rotte tykktarmskreft PC-modell, Raue et al [36] fant at bare CRS + HIPEC med MMC 15 mg /m 2 på 41,2 til 42,3 ° C i 60 min kan føre til betydelig reduksjon i tumor veie og PC-indeksen. Igjen denne studien ikke rapportere om total overlevelse.
Konklusjoner
Oppsummert har denne studien på den første store dyremodell av mage PC bevist at CRS + HIPEC kan faktisk ta overlevelsesgevinst med akseptabel sikkerhet, som gir bevis for å
|  Hvorfor trenger jeg en koloskopi?
Hvorfor trenger jeg en koloskopi?
 Studien beskriver den opprinnelige baseline sunne tarmmikrobiomdatabasen og overflodsprofil
Studien beskriver den opprinnelige baseline sunne tarmmikrobiomdatabasen og overflodsprofil
 Mikroplast identifisert i menneskelig avfall for første gang
Mikroplast identifisert i menneskelig avfall for første gang
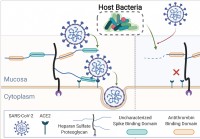 Menneskelig mikrobiom beskjærer slimhinneglykaner,
Menneskelig mikrobiom beskjærer slimhinneglykaner,
 Irritabel tarmsykdom øker risikoen for demens
Irritabel tarmsykdom øker risikoen for demens
 Hydrogenpust er ikke fra bikinitoll
Hydrogenpust er ikke fra bikinitoll
 Anti-coronavirus-molekyler fra mikrober kan være nøkkelen til nye behandlinger
Mikrober i tarmen som produserer fordelaktige forbindelser, kan inneholde nøkkelen til behandling av symptomer på koronavirus. Tarmmikrobiom. Bildekreditt:Anatomy Image/Shutterstock.com
Anti-coronavirus-molekyler fra mikrober kan være nøkkelen til nye behandlinger
Mikrober i tarmen som produserer fordelaktige forbindelser, kan inneholde nøkkelen til behandling av symptomer på koronavirus. Tarmmikrobiom. Bildekreditt:Anatomy Image/Shutterstock.com
 Sterkt mikrobiom tidlig i livet knyttet til færre luftveisinfeksjoner
Det er kolonier av mikroskopiske bakterier i forskjellige deler av menneskekroppen, inkludert nesen, munn, tarm, og lungene. Samlet sett, disse bakteriene er kjent som kroppens mikrobiota. Studier h
Sterkt mikrobiom tidlig i livet knyttet til færre luftveisinfeksjoner
Det er kolonier av mikroskopiske bakterier i forskjellige deler av menneskekroppen, inkludert nesen, munn, tarm, og lungene. Samlet sett, disse bakteriene er kjent som kroppens mikrobiota. Studier h
 Tarmmikrobiota kan forutsi alvorlighetsgraden av COVID-19
COVID-19-pandemien sprer seg til alle hjørner av verden. Men ikke alle blir syke i samme takt. En ny studie publisert på forhåndstrykkserveren medRxiv i april 2020 antyder at sammensetningen av tarm
Tarmmikrobiota kan forutsi alvorlighetsgraden av COVID-19
COVID-19-pandemien sprer seg til alle hjørner av verden. Men ikke alle blir syke i samme takt. En ny studie publisert på forhåndstrykkserveren medRxiv i april 2020 antyder at sammensetningen av tarm