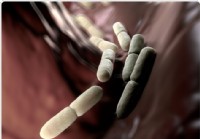
 Bactéries vaginales liées à la naissance prématurée
Bactéries vaginales liées à la naissance prématurée
 Une étude avec des jumeaux montre que les symptômes du COVID-19 ont une contribution génétique
Une étude avec des jumeaux montre que les symptômes du COVID-19 ont une contribution génétique
 Le microbiome intestinal pourrait jouer un rôle dans le COVID-19 sévère
Le microbiome intestinal pourrait jouer un rôle dans le COVID-19 sévère
 Comment les facteurs de l'hôte tels que le microbiome pulmonaire contribuent-ils à l'infection par le SRAS-CoV-2 ?
Comment les facteurs de l'hôte tels que le microbiome pulmonaire contribuent-ils à l'infection par le SRAS-CoV-2 ?
 Les scientifiques transforment le sang de type A en type O universel,
Les scientifiques transforment le sang de type A en type O universel,
 Neil Bell nommé directeur du développement d'Avacta Life Sciences
Neil Bell nommé directeur du développement d'Avacta Life Sciences
 La maladie de Crohn
La maladie de Crohn provoque une inflammation du tractus gastro-intestinal. Elle peut être confondue avec la rectocolite hémorragique et le syndrome du côlon irritable, mais la maladie de Crohn est un
La maladie de Crohn
La maladie de Crohn provoque une inflammation du tractus gastro-intestinal. Elle peut être confondue avec la rectocolite hémorragique et le syndrome du côlon irritable, mais la maladie de Crohn est un
 DeNovix annonce le gagnant du spectrophotomètre/fluoromètre Platinum DS11 FX+
DeNovix Inc. a le plaisir dannoncer le gagnant du concours qui recevra un don dun Spectrophotomètre / Fluoromètre DS11 FX+ couleur platine. Sélectionné au hasard parmi des milliers dentrées, le gagnan
DeNovix annonce le gagnant du spectrophotomètre/fluoromètre Platinum DS11 FX+
DeNovix Inc. a le plaisir dannoncer le gagnant du concours qui recevra un don dun Spectrophotomètre / Fluoromètre DS11 FX+ couleur platine. Sélectionné au hasard parmi des milliers dentrées, le gagnan
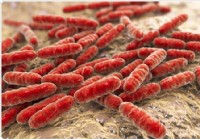 Les bactéries dans le canal de naissance liées à un risque plus faible de cancer de l'ovaire
Une nouvelle étude montre que quelque chose daussi simple quun écouvillonnage cervical pourrait potentiellement aider des centaines de femmes qui présentent un risque extrêmement élevé de cancer de lo
Les bactéries dans le canal de naissance liées à un risque plus faible de cancer de l'ovaire
Une nouvelle étude montre que quelque chose daussi simple quun écouvillonnage cervical pourrait potentiellement aider des centaines de femmes qui présentent un risque extrêmement élevé de cancer de lo