Alosetron (Lotronex) ble godkjent for markedsføring av FDA i februar 2000, men ble trukket tilbake fra markedet i november 2000 på grunn av alvorlige, livstruende gastrointestinale bivirkninger. I juni 2002 ble det godkjent igjen av FDA for markedsføring, men på en begrenset måte som en del av et legemiddelselskap-sponset program for å håndtere risikoen forbundet med behandling. Bruk av alosetron er kun tillatt blant kvinner med alvorlig, diaré-dominerende irritabel tarm-syndrom (IBS) som ikke har respondert på konvensjonell behandling for IBS.
Den opprinnelige offisielle FDA-erklæringen som ble utstedt da alosetron opprinnelig ble trukket tilbake er nedenfor.
-- Medisinsk redaktør, MedicineNet.com
28. november 2000--GLAXO WELLCOME BESTEMMER Å TREKKE LOTRONEX FRA MARKEDET Glaxo Wellcome fra Research Triangle Park, NC, har informert FDA om at de frivillig vil trekke tilbake Lotronex (alosetronhydroklorid)-tabletter fra markedet. Lotronex er en reseptbelagt medisin godkjent for å behandle irritabel tarmsyndrom (IBS) hos kvinner. FDA råder pasienter som tar Lotronex til å kontakte helsepersonell for å diskutere behandlingsalternativer.
Selskapets handling følger et møte som ble holdt tidligere i dag med Food and Drug Administration (FDA) der byrået diskuterte med Glaxo Wellcome risikostyringsalternativer som inkluderte å begrense distribusjonen av stoffet eller tilbaketrekning fra markedsføring.
Dagens handling følger FDA-analyser av post-markedsføringsrapporter om alvorlige bivirkninger, som inkluderte 5 rapporter om dødsfall hos pasienter som tok Lotronex.
Nærmere bestemt har FDA vært bekymret for rapporterte tilfeller av tarmskade som følge av redusert blodtilførsel til tarmen (iskemisk kolitt) og alvorlig blokkert eller sprukket tarm (komplikasjoner av alvorlig forstoppelse).
Per 10. november 2000 hadde FDA mottatt og gjennomgått totalt 70 tilfeller av alvorlige bivirkninger etter markedsføring, inkludert 49 tilfeller av iskemisk kolitt og 21 tilfeller av alvorlig forstoppelse. Av de 70 tilfellene resulterte 34 i sykehusinnleggelse uten kirurgi, 10 resulterte i kirurgiske inngrep og tre resulterte i død. FDA har mottatt ytterligere to rapporter om dødsfall som byrået ikke klassifiserte som tilfeller av iskemisk kolitt eller alvorlige komplikasjoner av forstoppelse.
FDA har overvåket stoffet nøye siden det ble godkjent 9. februar 2000. Før godkjenning ble fire tilfeller av iskemisk kolitt observert i kliniske studier og ble diskutert på et møte i november 1999 i FDAs rådgivende komité for gastrointestinale legemidler. Disse tilfellene var forbigående, milde til moderate og reversible ved seponering av legemidlet.
Mellom godkjenning og 1. juni 2000 mottok FDA syv rapporter etter markedsføring om alvorlige komplikasjoner av forstoppelse. Dette resulterte i sykehusinnleggelse av seks pasienter, hvorav tre måtte opereres. I løpet av samme tidsperiode mottok FDA åtte rapporter etter markedsføring om iskemisk kolitt. Dette resulterte i fire sykehusinnleggelser, fire endoskopiske prosedyrer og ingen operasjoner.
Den 27. juni 2000 innkalte FDA til et offentlig rådgivende komitémøte hvor risikostyringsalternativer som svar på rapportene om alvorlige uønskede hendelser ble diskutert. Ingen dødsfall ble rapportert frem til den datoen. Den rådgivende komitémedlemmene var enige om at både leger og pasienter må informeres om potensielt alvorlige bivirkninger forbundet med Lotronex.
Etter møtet oppdaterte FDA helsepersonellmerkingen for Lotronex og krevde at stoffets sponsor, Glaxo Wellcome, skulle distribuere en medisinveiledning som advarte pasienter direkte om risikoen forbundet med stoffet. I tillegg, på forespørsel fra FDA, utstedte Glaxo Wellcome "Kjære helsepersonell" og "Kjære farmasøyt"-brev for å informere disse gruppene om viktig ny informasjon.
FDA fortsatte å motta alvorlige bivirkningsrapporter om iskemisk kolitt og komplikasjoner av forstoppelse assosiert med Lotronex. I tillegg mottok FDA rapporter om død og mer alvorlige komplikasjoner av iskemisk kolitt som krevde blodoverføring eller kirurgi.
Etter å ha fullført sine nylige analyser av de 70 tilfellene, inkluderte FDAs syn på alternativene markedsføringsuttak eller et begrenset medikamentdistribusjonsprogram. Det begrensede medikamentdistribusjonsprogrammet vil gi:(1) sikker bruk av Lotronex hos passende informerte pasienter, (2) fortsatt tilgang til Lotronex av alvorlig svekkede IBS-pasienter under nøye overvåkede forhold, og (3) fortsatt klinisk forskning på fordeler, risikoer, og sikker og hensiktsmessig bruk av Lotronex. FDA anerkjente at de andre tilgjengelige behandlingene for IBS kan tilby utilstrekkelig lindring fra en tilstand som kan være alvorlig invalidiserende for noen pasienter.
Ved avslutningen av dagens møte informerte Glaxo Wellcome FDA om at de frivillig vil trekke Lotronex fra markedet.
For mer informasjon om dette emnet, besøk Lotronex Information-nettsiden laget av FDAs senter for legemiddelvurdering og forskning. Nettadressen er www.fda.gov/cder/drug/infopage/lotronex/lotronex.htm.
 Hva er C. Diff?
Visste du at tarmen huser rundt 100 billioner bakterier? Selvfølgelig kan disse mikrobene påvirke alt fra tarmhelsen til immunforsvaret ditt hvis noe kaster tarmmikrobiomet ut av hakk. Mens C. diffici
Hva er C. Diff?
Visste du at tarmen huser rundt 100 billioner bakterier? Selvfølgelig kan disse mikrobene påvirke alt fra tarmhelsen til immunforsvaret ditt hvis noe kaster tarmmikrobiomet ut av hakk. Mens C. diffici
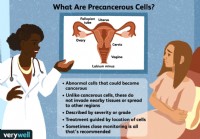 Hva det betyr hvis du har precancerøse celler
Begrepet precancerøse celler kan høres skummelt ut. Det første som må gjøres klart er at ikke alle precancerøse celler blir til kreft. De fleste gjør det faktisk ikke. Men dette er unormale celler, et
Hva det betyr hvis du har precancerøse celler
Begrepet precancerøse celler kan høres skummelt ut. Det første som må gjøres klart er at ikke alle precancerøse celler blir til kreft. De fleste gjør det faktisk ikke. Men dette er unormale celler, et
 Er streptokokker smittsomt? 12 Symptomer og tegn
Hva er streptokokker i halsen? Hvis streptokokker i halsen behandles med antibiotika, er det ikke lenger smittsomt etter 24 timer. Strep hals er en smittsom halsinfeksjon vanligvis forårsaket av gru
Er streptokokker smittsomt? 12 Symptomer og tegn
Hva er streptokokker i halsen? Hvis streptokokker i halsen behandles med antibiotika, er det ikke lenger smittsomt etter 24 timer. Strep hals er en smittsom halsinfeksjon vanligvis forårsaket av gru