FDA-goedkeuring van Pfizer's Bosulif voor de behandeling van chronische myeloïde leukemie (CML)
Door Daniel J. DeNoon
WebMD Gezondheidsnieuws
Beoordeeld door Louise Chang, MD
7 september 2012 -- De FDA heeft Pfizer's Bosulif goedgekeurd voor de behandeling van chronische myeloïde leukemie (CML) voor mensen die niet reageren op andere behandelingen of die andere behandelingen niet kunnen verdragen.
CML is een relatief zeldzame ziekte. Het treft ongeveer 5.400 mensen per jaar. De meeste mensen hebben een zeldzame mutatie, de Philadelphia-mutatie genaamd, die ervoor zorgt dat het beenmerg te veel tyrosinekinase-enzym maakt. Bosulif remt dit enzym.
Andere geneesmiddelen die zijn goedgekeurd voor CML -- Gleevec en Tasigna van Novartis en Sprycel van Bristol-Myers Squibb -- remmen tyrosinekinase op andere manieren.
"Met de goedkeuring van tyrosinekinaseremmers zien we verbeteringen in de behandeling van CML op basis van een beter begrip van de moleculaire basis van de ziekte", zegt Richard Pazdur, MD, directeur van het FDA-kantoor voor hematologie en oncologieproducten, zei in een persbericht.
In klinische onderzoeken had 55% van de CML-patiënten die eerder met Gleevec of andere geneesmiddelen waren behandeld, een normaal bloedbeeld zonder tekenen van leukemie binnen de eerste 48 weken van de behandeling met Bosulif.
De meest voorkomende bijwerkingen van Bosulif zijn diarree, misselijkheid, lage bloedplaatjeswaarden, braken, buikpijn, huiduitslag, bloedarmoede, koorts en vermoeidheid.
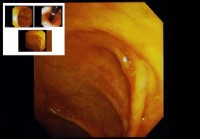 Wat is een chromo-endoscopie?
Wat betekent een chromo-endoscopie? Deze chromo-endoscopie helpt bij het visualiseren van het binnenoppervlak van de darm (epitheel) tijdens endoscopie. Een chromo-endoscopie is een diagnostisch
Wat is een chromo-endoscopie?
Wat betekent een chromo-endoscopie? Deze chromo-endoscopie helpt bij het visualiseren van het binnenoppervlak van de darm (epitheel) tijdens endoscopie. Een chromo-endoscopie is een diagnostisch
 Soorten prikkelbare darmaandoeningen
Kunnen uw maagproblemen worden veroorzaakt door IBD? Heb je last van maagkrampen, een opgeblazen gevoel en andere spijsverteringsproblemen die maar komen en gaan? Dan vraagt u zich misschien af o
Soorten prikkelbare darmaandoeningen
Kunnen uw maagproblemen worden veroorzaakt door IBD? Heb je last van maagkrampen, een opgeblazen gevoel en andere spijsverteringsproblemen die maar komen en gaan? Dan vraagt u zich misschien af o
 IBS behandelen met Viberzi
Viberzi (eluxadoline) is een medicijn dat is goedgekeurd door de Amerikaanse Food and Drug Administration (FDA) voor de behandeling van diarree-dominante IBS (IBS-D) bij volwassenen. Viberzi is ontwor
IBS behandelen met Viberzi
Viberzi (eluxadoline) is een medicijn dat is goedgekeurd door de Amerikaanse Food and Drug Administration (FDA) voor de behandeling van diarree-dominante IBS (IBS-D) bij volwassenen. Viberzi is ontwor