FDA-Zulassung für Bosulif von Pfizer zur Behandlung von chronischer myeloischer Leukämie (CML)
Von Daniel J. DeNoon
WebMD Health News
Überprüft von Louise Chang, MD
7. September 2012 – Die FDA hat Bosulif von Pfizer für die Behandlung von chronischer myeloischer Leukämie (CML) für Personen zugelassen, die auf andere Behandlungen nicht ansprechen oder diese nicht vertragen.
CML ist eine relativ seltene Erkrankung. Etwa 5.400 Menschen trifft es jährlich. Die meisten Menschen haben eine seltene Mutation, die als Philadelphia-Mutation bezeichnet wird und dazu führt, dass das Knochenmark zu viel Tyrosinkinase-Enzym produziert. Bosulif hemmt dieses Enzym.
Andere für CML zugelassene Medikamente – Gleevec und Tasigna von Novartis und Sprycel von Bristol-Myers Squibb – hemmen die Tyrosinkinase auf andere Weise.
"Mit der Zulassung von Tyrosinkinase-Inhibitoren sehen wir Verbesserungen bei der Behandlung von CML, die auf einem besseren Verständnis der molekularen Grundlagen der Krankheit beruhen", sagte Richard Pazdur, MD, Direktor des FDA-Büros für Hämatologie- und Onkologieprodukte in einer Pressemitteilung.
In klinischen Studien kehrten 55 % der CML-Patienten, die zuvor mit Gleevec oder anderen Arzneimitteln behandelt wurden, innerhalb der ersten 48 Wochen der Behandlung mit Bosulif zu normalen Blutwerten ohne Anzeichen von Leukämie zurück.
Die häufigsten Nebenwirkungen von Bosulif sind Durchfall, Übelkeit, niedrige Blutplättchenwerte, Erbrechen, Bauchschmerzen, Hautausschlag, Anämie, Fieber und Müdigkeit.
 Mikroben, die mit Herzinfarkten in Verbindung gebracht werden, finden Studie
Mikroben, die mit Herzinfarkten in Verbindung gebracht werden, finden Studie
 Die Reduzierung dieser Lebensmittelarten kann Ihnen helfen, das Auftreten von Sodbrennen deutlich zu reduzieren
Die Reduzierung dieser Lebensmittelarten kann Ihnen helfen, das Auftreten von Sodbrennen deutlich zu reduzieren
 Was ist der Unterschied zwischen Fluoroskopie und Radiographie?
Was ist der Unterschied zwischen Fluoroskopie und Radiographie?
 Spezielle 50 % Rabatt auf die Dankeschön-Facebook-Party!!!
Spezielle 50 % Rabatt auf die Dankeschön-Facebook-Party!!!
 Mehr Gemüse, Vollkornprodukte und vielfältige Fette, das Rezept von RD Kate Scarlata für eine gesunde Mikrobiota
Mehr Gemüse, Vollkornprodukte und vielfältige Fette, das Rezept von RD Kate Scarlata für eine gesunde Mikrobiota
 Warum sollte ich Schleim in meinem Stuhl haben?
Warum sollte ich Schleim in meinem Stuhl haben?
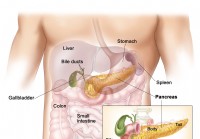 Zollinger-Ellison-Syndrom
Auf dieser Seite: Was ist das Zollinger-Ellison-Syndrom? Wie häufig ist das Zollinger-Ellison-Syndrom? Wer hat eher das Zollinger-Ellison-Syndrom? Was sind die Komplikationen des Zollinger-Ellison-S
Zollinger-Ellison-Syndrom
Auf dieser Seite: Was ist das Zollinger-Ellison-Syndrom? Wie häufig ist das Zollinger-Ellison-Syndrom? Wer hat eher das Zollinger-Ellison-Syndrom? Was sind die Komplikationen des Zollinger-Ellison-S
 Gastroparese
Gastroparese ist eine durch Symptome gekennzeichnete Erkrankung, bei der der Magen zu lange braucht, um seinen Inhalt zu entleeren. Es ist keine Behinderung oder Blockierung erkennbar. Bei den meis
Gastroparese
Gastroparese ist eine durch Symptome gekennzeichnete Erkrankung, bei der der Magen zu lange braucht, um seinen Inhalt zu entleeren. Es ist keine Behinderung oder Blockierung erkennbar. Bei den meis
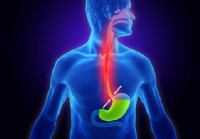 Was sind die Symptome von GERD bei Erwachsenen?
Was ist GERD? GERD-Symptome beginnen mit Sodbrennen und können sich dann zu Brustschmerzen, Übelkeit und Erbrechen, Halsschmerzen und Heiserkeit entwickeln , Husten oder Keuchen, übermäßiger Speich
Was sind die Symptome von GERD bei Erwachsenen?
Was ist GERD? GERD-Symptome beginnen mit Sodbrennen und können sich dann zu Brustschmerzen, Übelkeit und Erbrechen, Halsschmerzen und Heiserkeit entwickeln , Husten oder Keuchen, übermäßiger Speich