Le distinzioni in gastriche gene del cancro firme di espressione derivati da laser cattura microdissezione contro
istologico macrodissection
Abstract
sfondo
campioni di cancro gastrico ottenuti da macrodissection istologico contengono un contenuto relativamente elevato stromale che possono influenzare in modo significativo i profili di espressione genica. Le differenze tra la firma genica derivato da macrodissected campioni di cancro gastrico e la firma ottenuta da cellule epiteliali di cancro gastrico isolati dalle stesse biopsie con laser-capture microdissezione (LCM) sono stati valutati per i loro potenziali errori sperimentali.
Metodi
RNA è stato isolato da campioni di tessuto congelati di biopsie di cancro gastrico da 20 pazienti con entrambe le tecniche macrodissection e LCM istologiche. RNA da LCM è stato oggetto di una serie supplementare di T7 amplificazione di RNA. Profili di espressione è stata effettuata utilizzando Affymetrix array HG-U133A. I geni identificati nelle firme di espressione di ogni metodo di lavorazione del tessuto sono stati confrontati con il gruppo di geni contenuti in regioni cromosomiche trovato al porto del numero di copie aberrazioni nei campioni tumorali di CGH array e alle proteine precedentemente identificati come essere sovraespresso nel cancro gastrico.
Risultati
Geni dimostrato di avere aumentato numero di copie in cancro gastrico sono stati trovati anche essere sovraespresso in campioni ottenuti da macrodissection (LS P
valore < 10
-5), ma non nei dati di matrice generati utilizzando microdissezione . Un set di 58 geni precedentemente identificati sovraespresso nel cancro gastrico è stato anche arricchito nella firma gene identificato da macrodissection (LS P
< 10 -5), ma non nella firma identificato mediante microdissezione (LS P
= 0.013). Al contrario, 66 geni registrati precedentemente da underexpressed nel cancro gastrico sono stati arricchiti nella firma gene identificato mediante microdissezione (LS P
< 10 -5), ma non nella firma identificato da macrodissection (LS P
= 0.89). Conclusioni
La tecnica di campionamento del tumore polarizza i risultati di microarray. LCM può essere un metodo di raccolta e il trattamento più sensibile per l'identificazione di potenziali candidati gene soppressore del tumore nel cancro gastrico con profili di espressione.
Sfondo
Uno dei principali obiettivi di analisi di microarray è l'identificazione di geni differenzialmente espressi in sottoinsiemi di clinica campioni per abbinare terapie specifiche per i sottotipi di tumore. Tuttavia, l'analisi quantitativa gamma espressione di campioni tumorali clinici con alto contenuto stromale è impegnativo in quanto il rapporto tra cellule tumorali epiteliali a cellule stromali possono variare notevolmente. Contaminando stroma può confondere espressione microarray-based e copiare analizza il numero. microdissezione laser (LCM) è una tecnica preziosa che permette di isolare le cellule epiteliali da cellule stromali, arricchendo così per i contenuti epiteliale. La quantità di campione e RNA ottenuto da LCM è spesso molto limitato, tuttavia, e richiede una fase di amplificazione per generare materiale sufficiente per analisi microarray. Questo processo di amplificazione può polarizzazione dei risultati e portare a una serie distorta di geni espressi in modo differenziale [1]. macrodissection istologica (campioni raccolti da sezioni di tessuto guidate da analisi microscopica di una sezione seriale macchiata) fornisce una maggiore quantità di materiale campione rispetto a LCM che può eliminare la necessità di un ulteriore ciclo di amplificazione dell'RNA. Tuttavia, i campioni macrodissected contengono significativamente più contenuti cellule stromali di campioni ottenuti da microdissezione.
Precedenti studi hanno confrontato questi due metodi di lavorazione dei tessuti per i campioni tumorali clinici. Sulla base dei dati provenienti da 14 campioni di adenocarcinoma del retto, Bruin et al
. favorita macrodissection sopra microdissezione causa della relativamente bassa contributo delle componenti stromali in campioni macrodissected da questo tipo di tumore e le polarizzati risultati espressione genica di campioni microdissezione causa l'amplificazione del RNA necessaria per questi campioni [2]. D'altra parte, Klee et al
. ha suggerito che microdissezione profiling identificare in modo univoco un gran numero di geni espressi in modo differenziale non altrimenti trovati usando il campionamento dei tessuti di massa, sulla base di dati provenienti da 10 adenocarcinomi polmonari e 6 campioni adiacenti normali [3]. Questi studi sono stati limitati da campioni di piccole dimensioni, e, quindi, richiedono ulteriore convalida. Non è chiaro se i geni identificati in modo univoco utilizzando campioni di microdissezione rappresentano biomarcatori utili. Bias derivanti da amplificazione RNA deve essere bilanciato con il beneficio di arricchire i campioni per i contenuti epiteliale nel considerare se microdissezione è vantaggioso per profilo di espressione di tumori ad alto contenuto stromale, come ad esempio adenocarcinoma gastrico o pancreatici.
Microdissection è particolarmente utile per arricchire gastrica cellule tumorali cancro ottenuti da campioni di biopsia endoscopica, in particolare da diffuse di tipo carcinoma gastrico che si compone di cellule tumorali sparse mescolate con cellule infiammatorie e fibrosi. Il declino incidenza di carcinoma gastrico nei brevetti in questo secolo sembra essere in gran parte attribuibile ad una diminuzione delle lesioni tipo intestinali, mentre la presenza di tipo diffuso è pensato per essere rimasto lo stesso [4]. Utilizzando campioni ottenuti da LCM, Wu et al
. riferito che maligne contro cellule epiteliali gastriche benigne potrebbero essere distinti con una precisione di 99% basato su un predittore 504 gene [5]. Questo predittore incluso geni noti espressi nell'epitelio gastrico compreso trifoglio fattori 1, 2, e 3 [5]. Utilizzando LCM, Jinawath et al
. identificato 46 geni che possono rappresentare le firme molecolari distinti per i due tipi istologici di cancro gastrico - diffuso e di tipo intestinale tipo di cancro gastrico [6]. Tuttavia, non sono stati effettuati studi fino ad oggi confrontando direttamente la macrodissection vs
. metodi LCM che utilizzano lo stesso set di campioni di cancro gastrico.
In questo studio, abbiamo cercato di valutare le distinzioni tra profili di espressione derivati dagli stessi tumori che sono state elaborate sia da macrodissection e LCM per le analisi di microarray. Data la difficoltà di convalidare tutti i geni espressi in modo differenziale identificate utilizzando ogni tipo di raccolta del campione, abbiamo confrontato i geni identificati tramite il nostro microarray analisi con proteine note per essere sovraespresso nel cancro gastrico. Inoltre, abbiamo determinato se l'espressione dei geni identificati in ciascuna firma correlata con alterazioni nel numero di copie del gene che sono stati identificati dalla serie ibridazione genomica comparativa (CGH) dallo stesso tumore. Precedenti studi di cancro gastrico hanno dimostrato una forte correlazione tra i dati di espressione su array CGH array e [7]. Copia cambiamenti numerici sono stati valutati usando il DNA tumorale macrodissected al fine di evitare il bias da tutto amplificazione del genoma. Abbiamo inoltre stabilito se le firme genetiche che abbiamo ottenuto da ciascun metodo di raccolta e trattamento del campione sono stati arricchiti per le proteine che sono stati precedentemente segnalati da disregolazione geni nel cancro gastrico. I nostri risultati indicano che il metodo LCM è più sensibile per identificare geni che sono underexpressed nel tumore rispetto al tessuto normale (potenziali soppressori tumorali), che identifica macrodissection più geni che sono overexpressed nel cancro. Pertanto, macrodissection e LCM microdissezione appaiono utili per studiare diversi aspetti della biologia del cancro.
Metodi
Pazienti
Venti pazienti che sono stati analizzati in questo studio è una parte di 96 pazienti che hanno partecipato a uno studio prospettico e la cui campioni sono stati utilizzati come un insieme di addestramento espressione di sviluppare un predittore chemio-risposta [8]. Parte di espressione e di dati di CGH array dai loro campioni macrodissected è stato riportato in precedenza [8, 9]. Raccolta dei campioni, il trattamento e il follow-up sono stati eseguiti secondo un protocollo approvato dal Institutional Review Board (IRB) del Cancer Center National Hospital a Goyang, Corea (NCCNHS01-003). Tutti i pazienti hanno firmato un consenso informato IRB approvato. Idoneità per l'arruolamento nello studio ha incluso i seguenti parametri: 1) di età ≥ 18 anni; 2) istologicamente confermato adenocarcinoma gastrico; 3) clinicamente documentata metastasi a distanza; 4) Nessun precedenti o concomitanti neoplasie diverse dal cancro gastrico; 5) nessun precedente storia di chemioterapia, sia adiuvante o palliativa; e 6) un'adeguata funzione di tutti gli organi principali. I pazienti hanno ricevuto cisplatino 60 mg /m 2 IV il giorno 1 e fluorouracile 1000 mg /m 2 IV nei giorni 1-5 di un programma di 3 settimane.
Trasformazione del tessuto
Prima macrodissection, tumore campioni avevano nuclei mediani del tumore del 50% (range interquartile, 30-60%). Macrodissection è stata eseguita come precedentemente descritto [10]. Macrodissection portare a media il 60% dei nuclei tumorali a slitta superiore (range interquartile, 60-72,5%). Per microdissezione, tumorale e normale criosezioni campione di tessuto sono stati tagliati a 10 micron, e conservati congelati a -80 ° C. I vetrini sono stati disidratati usando HistoGene priva di nucleasi (Molecular Devices, Sunnyvale, CA) reagenti in base alle raccomandazioni del fabbricante. Microdissezione è stata effettuata utilizzando PixCell II (Arcturus Bioscience, Mountain View, CA). La disidratazione e LCM è stato limitato a 15 minuti o meno per ogni campione raccolto. Un totale di 10.000 colpi laser (dimensione dello spot di 15 micron di diametro) sono stati raccolti utilizzando CapSure Caps Macro LCM per ogni campione. L'RNA è stato isolato usando PicoPure kit di isolamento di RNA (Molecular Devices). Brevemente, le cellule epiteliali sono state incubate con 50 microlitri di tampone di estrazione in una provetta da 0,5 ml microcentrifuga a 42 ° C per 30 min. DNase (QIAGEN, Valencia, CA) il trattamento è stato effettuato direttamente all'interno della colonna di purificazione, e l'RNA è stato isolato utilizzando il volume di eluizione di 8 ml (Molecular Devices). Cinque ml di RNA da popolazioni di cellule microdissezione è stato convertito a biotinilato, bersaglio antisenso cRNA, utilizzando il due cicli metodo di etichettatura Affymetrix (Santa Clara, CA). Tutti gli obiettivi biotinilati erano frammentati e
15μ g di ciascun stato ibridate a HG-U133A microarray GeneChip seguendo il protocollo del produttore. immagini Scanned Array sono stati rivisti e convertiti a segnalare i dati utilizzando il Affymetrix MAS 5.0 algoritmo.
Array CGH
DNA genomico è stato estratto da campioni utilizzando TRI reagente (Invitrogen, Carlsbad, CA), secondo il protocollo del produttore, e inoltre purificato utilizzando il kit QIAamp DNA Micro (QIAGEN). Per matrice esperimenti CGH, Agilent 4x44k HD-CGH microarray contenenti 44.000 caratteristiche (Agilent Technologies, Santa Clara, CA) sono stati utilizzati. 0,5-1 mg di campioni di DNA genomico del tumore e la stessa quantità di DNA genomico umano da più donatrici anonime (Promega, Madison, WI) sono stati digeriti con AluI (50 unità) e RsaI (50 unità) per 2 ore a 37 ° C . 5 ml di caso Primer è stato mescolato con il modello di DNA digerito. Il riferimento e campione di DNA sono stati etichettati con Agilent Labeling Kit Plus, che include tampone 5x, 10x dNTP, Cy-3/5 dUTP (1,0 mm), e Exo-Klenow Fragment. La miscela della sonda di Cy3 marcato campione di DNA, Cy5 marcato DNA di riferimento (39 ml), 5 ml di Cot-1 DNA umano (Invitrogen), 11 ml di Agilent 10 × agente bloccante e 50 ml di Agilent 2 tampone × ibridazione è stato denaturato a 95 ° C per 3 min e incubate a 37 ° C per 30 min. La sonda è stata applicata alla matrice utilizzando una camera di microarray Agilent ibridazione, e ibridato per 21 ore a 65 ° C in un forno rotante a 20 rpm. Gli array sono stati lavati secondo le raccomandazioni del fabbricante, immersi in Agilent di stabilizzazione e la soluzione di essiccazione, e sottoposti a scansione utilizzando uno scanner microarray Agilent 2565AA DNA. Programma di controllo del programma di scansione del Agilent 7.0 e funzionalità di Agilent Extraction Software Programma 9.5.1 sono stati utilizzati per l'elaborazione dei dati. Array CGH dati sono stati analizzati utilizzando il software CGH Analytics Agilent (versione 3.5.14). Algoritmo ADM-2 con soglia 6, da zero fuzzy e centralizzazione, è stato utilizzato per identificare aberrazione. Criteri per il filtraggio aberrazione erano sonde minimo di 5, media minima di registro assoluto 2 rapporto di 0,5, e le aberrazioni massimo di 1.000.000. Le aberrazioni individuate per ogni campione sono state elencate e graficamente visualizzati.
Geni del cancro gastrico in letteratura
per generare un insieme gene definita dall'utente per le analisi il nostro confronto gene, abbiamo cercato di database PubMed per i geni con proteine specifiche delle cellule cancro gastrico espressione, utilizzando parole chiave del "cancro gastrico", "immunoistochimica" e "overexpressed" o "perdita di espressione". Per le analisi il nostro confronto set di geni, simboli gene di specifici geni del cancro gastrico sono stati mappati per sondare gli ID impostati sulla matrice HG-U133A (http:.. //Www NetAffx com). Ci sono stati 178 ( "overexpressed") e 327 ( "la perdita di espressione") articoli della Pubmed al momento della scrittura.
Analisi statistica sui dati di matrice espressione
dati di microarray Affymetrix HG-U133A gene di espressione sono stati analizzati con set gene algoritmi di analisi di confronto ArrayTools BRB (versione 3.8, del National Cancer Institute, http:.... //Linus NCI NIH gov /BRB-ArrayTools html) [11]. Lo strumento di confronto gene impostare analizza insiemi di geni definiti dall'utente per l'espressione differenziale tra le classi predefinite (i.e
., Il cancro vs
. Normale) di un insieme di dati sorgente. insiemi di geni definiti dall'utente utilizzati in questo studio includono U133A set di sonde corrispondenti a geni con il cambiamento del numero di copie e corrispondenti a geni del cancro gastrico in letteratura. I geni il cui tumore /normale log rapporto 2 è superiore a 0,5 in almeno uno dei 20 campioni di pazienti sono stati inclusi nella lista dei geni con numero di copie di guadagno. Allo stesso modo, i geni con la perdita del numero di copie (log rapporto di 2 < -0.5) sono stati elencati. Questi insiemi di geni definiti dall'utente sono stati analizzati per l'espressione differenziale tra 20 campioni tumorali e 6 campioni normali (cioè
., 3 macrodissected e 3 campioni microdissezione).
Per ogni set di dati di origine, un P
-valore è calcolato per ogni gene per correlare il livello di espressione per l'espressione differenziale tra le classi predefinite, generando un elenco gene ordinati di un dato progetto BRB-ArrayTools. Per un insieme di N
geni, dei minimi quadrati (LS) statistica è definito come il logaritmo naturale negativo medio dei P
-Valori delle opportune singolo gene test univariati [12]. Una statistica di sintesi è calcolato che riassume questi valori P
oltre il set gene definito dall'utente; la statistica riassuntiva è log media (P
) per la sintesi di come la LS P
valori differiscono da una distribuzione uniforme per LS [12]. La statistica riassuntiva è legato alla distribuzione delle statistiche riassuntive per campioni casuali di N
geni, campionati da quelli rappresentati sulla matrice. Qui N
è il numero di geni nel set gene definito dall'utente. 100.000 set di geni a caso sono stati campionati per calcolare questa distribuzione. Il valore
LS P è la proporzione di insiemi casuali di N
geni con piccole statistiche Riassunto rispetto alle LS sommari calcolati per i dati reali.
BRB-ArrayTools valori LS P
stimati per l'arricchimento di le 4 serie di geni nella nostra firma cancro gastrico trascrittoma identificati da ciascun metodo di lavorazione dei tessuti come segue. In primo luogo, al fine di confrontare i 2.324 geni associati con il numero di copie di guadagno con la nostra firma cancro gastrico trascrittoma identificato dalla microdissezione, la statistica LS di 2.324 geni amplificati è stata stimata calcolando un logaritmo naturale negativo media dei valori P rosa della test univariati singolo gene per l'espressione differenziale di ciascuno dei 2.324 geni tra 20 campioni di cancro gastrico microdissezione e 6 campioni normali. Poi BRB-ArrayTools calcolato la percentuale di gruppi casuali di 2.324 geni con piccole statistiche Riassunto rispetto alle LS sommari calcolati per i dati reali (LS P
valore). La firma del cancro gastrico trascrittoma identificato dal microdissezione è stato anche confrontato con 677 geni associati con la perdita del numero di copie, 58 proteine segnalati per essere sovraespresso nel cancro gastrico, e 66 proteine segnalati da underexpressed nel carcinoma gastrico, con rispettivo LS P
valori. LS P
valore inferiore a 0,01 è stato considerato significativo. Le stesse analisi sono state ripetute per gastrica firma cancro trascrittoma identificato con il metodo macrodissection.
Immunoistochimica
TFF1 immunoistochimica è stata eseguita utilizzando campioni di tessuto biopsia chirurgica o endoscopica da 16 pazienti affetti da cancro gastrico (16 cancro e 2 normali campioni di tessuto adiacenti), e 4 volontari sani, che non sono stati inclusi in questo studio DNA microarray. Grossolanamente-normali campioni di tessuto mucosa gastrica sono stati raccolti dal gastrico di volontari sani utilizzando una tecnica di biopsia cieco, con il consenso informato [9]. scivoli di tessuto fissati in formalina e incluso in paraffina (4 micron di spessore) sono state colorate con 13.734-1-AP (Gruppo Proteintech, Chicago, IL) alle 1:50 per 60 minuti a temperatura ambiente e immaginate perossidasi anti-coniglio (K4003, DAKO , Carpinteria, CA) per 30 minuti a RT. La reazione è stata visualizzata utilizzando diaminobenzidina (K3468, DAKO) e di contrasto con ematossilina. espressione TFF1 è stata valutata semi-quantitativamente a 200x
ingrandimento, sulla base di percentuale di cellule marcate positivamente ( "-" = immunostaining in ≤ 10% delle cellule; "+" = 11-50%; "++" = 51- 75%; "+++" = 76-100%) [13, 14]. Immunocolorazione senza anticorpo primario e normale epitelio gastrico di un microarray tessuto di controllo servito come controlli negativi e positivi, rispettivamente, [15]. citoplasmatica macchia che era inequivocabilmente più profondo di sfondo è stato contato come positivo.
Risultati
Determinazione delle firme di espressione genica a livello mondiale da campioni macrodissected e LCM
Tabella 1 delinea le caratteristiche clinico-patologici dei pazienti e volontari inclusi in questo studio microarray. dati microarray è stata ottenuta sia LCM e campioni macrodissected dagli stessi 20 biopsie (Figura 1A). Anche se di qualità accettabile, dati di microarray da campioni LCM hanno generalmente più bassi "presente bando" di campioni macrodissected (dati non riportati
). Analisi delle componenti principali dei modelli di espressione genica globale derivati dalla micro e macro-sezionato tumori gastrici, ei campioni normali ha dimostrato una netta separazione di ciascun campione (Figura 1B). La correlazione di Pearson mediana tra i due metodi di lavorazione era 0,75 (range interquartile, 0,71-0,81) .table 1 caratteristiche clinico-patologici di pazienti e volontari incluso nel microarray
I pazienti (n = 20)
volontari (n = 6)
Baseline caratteristiche clinico-patologici
Età anni
mediana
59
52 gamma
interquartile
54-69
43-61
Sesso - no. (%)
Maschio
16 (80%)
3 (50%)
femminile
4 (20%)
3 (50%) Stato
Prestazioni (PS ) - no. (%)
ECOG1 PS 0 o 1
20 (100%)
tipo istologico - no. (%)
Intestinale
6 (30%) di Lauren
diffusa di Lauren
14 (70%)
Location di lesione primaria - no. (%)
Alto 1/3
4 (20%)
Medio 1/3 Pagina 6 (30%)
Inferiore 1/3
10 (50%)
metastasi a distanza - no. (%)
20 (100%)
trattamento e l'esito
regime chemioterapico - no. (%)
Cisplatino /fluorouracile
20 (100%)
sopravvivenza globale -.
Mese mediana
8,0
Interquartile gamma
5,6-14,7
tempo alla progressione -.
mese mediana
3,5
interquartile gamma
2,3-6,2
1Eastern Cooperative Oncology Group
Figura 1 (A) schema Studio di raccolta dei campioni e l'elaborazione microarray (B) delle componenti principali analisi dei profili di espressione genica di micro e macro-campioni tumorali sezionato da 20 pazienti affetti da cancro gastrico e 6 campioni normali provenienti da volontari sani.
tabelle 2 e 3 mostrano geni sovraespressi in micro e macro-sezionato campioni di cancro gastrico a funzionalità di selezione P
< 10 -6. Morfologia cellulare
(AIF1, E2F1, E2F3, KIR2DL1, KIRREL, NPR1, RUNX2, TRIO
) era la categoria più arricchito funzionale dei 42 geni sovraespressi nei campioni microdissezionate rispetto ai campioni normali (selezione delle funzioni P
< 10 -6) così come individuate dalla Ingenuity Pathway Analysis (IPA) (Tabella 2). Tumore morfologia
(APOE, BIRC5, CD14, COL1A1, COL1A2, Cyr61, FKBP1A, IL8, MCAM, MIF, RHOB
) è stata la categoria funzionale più arricchito tra i 73 geni sovraespressi nei campioni macrodissected (selezione delle funzioni P
< 10 -6) da IPA (Tabella 3). i geni della matrice extracellulare, come il COL6A2, COL1A1, COL1A2
, e
COL5A2, erano prominenti nei campioni macrodissected e presumibilmente contribuito da parte delle cellule stromali. La tabella 4 mostra i geni underexpressed in campioni di cancro gastrico micro e macro sezionato a funzionalità di selezione P
< 10 -6.Table 2 geni sovraespressi nel carcinoma gastrico microdissezione a selezione caratteristica P
< 10-6
Gene
FC1
Gene
FC
BMP3
38.52
HIST1H4C
6.3
BGN
30.3
LEPRE1
5.9
TRIO
18.5
ETNK2
5.6
GADD45GIP1
17.2
TRIP6
5.3
MIER2
16.7
FAM125B
5.3
KIFC3
16.4
NPR1
5.3
217318_x_at
13.7
DSCC1
5.3
217219_at
13.2
CLUL1
5.0
RUNX2
12.5
HMGB3
4.5
SMARCD1
12.0
E2F3
4.3
KIRREL
12.0
AIMP2
4.2
215621_s_at
12.0
ATAD5
4.0
GRM2
10.0
E2F1
3.8
FJX1
10.0
FKSG49
3.7
AIF1
10.0
DVL2
3.7
THY1
9.1
TIPRL
2.9
CARD10
9.1
EIF2C3
2.9
SIM2
9.1
NAT10
2.8
AIF1
9.1
MED27
2.7
APOBEC3G
8.3
PIN4
2.7
RHAG
8.3
CTPS
2.6
cambiamento 1fold, definita dal rapporto espressione del cancro alla normalità (= cancro /normale)
2All questi geni avuto tasso di falsi scoperta < 0,001
Tabella 3 geni sovraespressi nel carcinoma gastrico macrodissected alla funzione di selezione P
. < 10-6
Gene
FC1
Gene
FC
LY6E
24.42
SRM
6.7
IL8
22.7
NGLY1
6.7
CA12
20.0
RHOB
6.3
SBNO2
19.2
ACTN1
5.9
UBE2S
17.2
LOXL2
5.9
CYR61
17.2
COL5A2
5.9
ANGPT2
15.9
TRIM28
5.6
COL6A2
14.3
218982_s_at
5.6
BOP1
13.2
C7orf44
5.3
COL1A1
13.2
UBE2C
5.3
LPL
13.0
CEP76
5.3
MFGE8
12.8
BIRC5
5.3
APOE
12.2
PNO1
5.0
G6PC3
10.9
FSTL1
5.0
215900_at
10.3
GRINA
4.8
NUP62
10.0
MRTO4
4.8
MRPL4
10.0
STC1
4.8
GNL3L
10.0
MRPL12
4.5
MCAM
9.1
FKBP1A
4.5
PDLIM7
9.1
IFI30
4.5
216472_at
9.1
KPNA6
4.3
ACTN1
9.1
216532_x_at
4.3
BYSL
9.1
CENPI
4.2
GNAI2
8.3
PPM1G
4.2
NCAPH2
8.3
ICT1
3.7
CD14
8.3
SFRS14
3.6
EXOSC4
8.3
CTPS
3.6
OBFC2B
8.3
IMP4
3.3
PPP1R15A
7.7
UBE2G2
3.2
COL1A2
7.7
ISG20L2
3.2
GPX1
7.7
EIF4A1
3.1
MIF
7.7
HDGF
2.6
NME1
7.1
PSMD14 2.6
PPIL2
7.1
220856_x_at
2.4
CCDC85B
7.1
CNOT3
2.4
SPARC
6.7
GLT25D1
2.0
C8orf55
6.7
cambiamento 1fold, definita dal rapporto espressione del cancro alla normalità (= cancro /normale)
2All questi geni era falsa tasso di scoperta. < 0,001
Tabella 4 geni underexpressed in micro e macro-sezionato cancro gastrico in funzione selezione P
< 10-6
microdissezione
Macrodissected
|
Gene
FC1
Gene
FC
HPGD
-25.02
208498_s_at
-11.1
HRASLS2
-20.0
SIDT2
-7.7
ABCC3
-20.0
MUC5AC
-5.9
SLC25A37
-16.7
CTAGE5
-5.0
ABHD2
-14.3
GNA11
-3.8
VIPR1
-10.0
ARFIP1
-3.4
CYTIP
-9.1
214316_x_at
-3.3
GALNT6
-9.1
222149_x_at
-3.3
SULT1A2
-9.1
OAS1
-8.3
PDCD4
-7.1
NR3C2
-7.1
DOCK6
-6.3
SULT1A1
-5.9
ZFYVE26
- 5.9
213212_x_at
-5.6
DSCR3
-5.3
TMEM131
-5.3
ECHDC2
-5.0
DENND1B
-5.0
KIAA0141
-4.8
RNF103
-4.8
PDCD4
-4.5
CABIN1
-4.5
222371_at
-4.3
RRBP1
-4.0
CC2D1A
-3.8
216438_s_at
-3.8
SGSM3
-3.8
ARPC2
-3.7
TRAK1
-3.6
GNA11
-3.6
pafah1b1
-3.4
CNDP2
-3.2
SPOP
-3.1
PARP4
-3.1
ERLIN1
-2.9
1fold cambiano, definito dal negativo del rapporto di espressione di normale al cancro (= - (normale /cancro))
2All questi geni avuto false discovery rate < 0,001
Confronto tra espressione e array di dati CGH.
Array CGH analisi è stata effettuata utilizzando il DNA genomico estratto da campioni contenenti macrodissected > cellule tumorali 50% (criteri utilizzati da studi precedenti [16, 17]) dal DNA sufficiente potrebbe essere ottenuta senza la necessità di amplificazione del genoma intero come richiesto per campioni microdissezione. Tutta la amplificazione del genoma del DNA possono potenzialmente introdurre bias artefatta in Array CGH risultati [18]. Illustrato in figura 2 è la frequenza del numero di copie di DNA aberrazioni tra tutti i 20 campioni. Il nostro numero di copie dei dati aberrazione è generalmente in linea con i dati precedentemente riportati [7, 16, 17, 19-23]. Quattro dei 20 pazienti avevano amplificazione del chr8 q24.13-q24.21 (126.357.475-128.822.596) che contiene il MYC
oncogene. Il secondo locus di amplificazione più comune era q21.2 chr17 (36.109.939-36.230.163) che è stato amplificato in 3 pazienti. Sette pazienti non avevano aberrazioni cromosomiche rilevabili. Questi 7 campioni contenevano una mediana di cellule tumorali 70%, mentre gli altri 13 pazienti avevano una mediana di cellule tumorali 60% (P valore
= 0.1). Quindi, la mancanza di aberrazioni cromosomiche rilevabili nei campioni 7 non era dovuta ad una minore percentuale di cellule tumorali in questi campioni. Figura 2 Immagine grafica che illustra la frequenza percentuale di sonde rilevato (aberrazioni) tra tutti i 20 campioni.
C'erano 2.324 geni unici che sono stati associati con il numero di copie guadagno in almeno uno dei 20 pazienti, e 677 geni associati con il numero di copia perdita. Utilizzando confronto set gene analisi, abbiamo confrontato questi insiemi di geni con le nostre firme trascrittoma identificati dai diversi metodi di isolamento del campione. Abbiamo ipotizzato che i geni sregolati associati con aberrazioni del numero di copie sono più probabilità di essere coinvolti come collaboratori di oncogenesi, piuttosto che semplicemente come "spettatori". Quindi, i 2.324 geni contenuti all'interno delle regioni di numero di copia guadagni sono stati analizzati per quanto riguarda la loro espressione da dati di matrice ottenuti con il metodo macrodissection (selezione caratteristica P
< 0,05). La sovrapposizione tra l'elenco dei geni nelle regioni di amplificazione e di arricchimento per la loro espressione in campioni che sono stati macrodissected era statisticamente significativa (P LS
value = 10 -5; vedere Metodi per la descrizione statistica). Tuttavia, questa associazione non è stata osservata quando i dati di espressione è stata analizzata da campioni microdissezione (selezione caratteristica P
< 0,05; P LS
value = 0,41) (Figura 3A). Quindi, non vi era più forte associazione tra il modello di guadagno numero di copie e l'espressione genica solo in campioni che sono stati macrodissected. Ad esempio, MYC
, il gene più frequentemente amplificata nei nostri campioni di pazienti, è stato determinato essere significativamente overexpressed in campioni macrodissected, ma non in quelli che sono stati microdissezione, anche se questo risultato può essere dovuto alla dimensione relativamente piccola campione o eterogeneità all'interno il tumore. Figura 3 Numero dei geni sovrapposizione tra LCM e di espressione su array macrodissected set di dati ei dati CGH array dalla stessa serie di 20 pazienti.
Un elenco di 677 geni è stato identificato in regioni in cui è stato trovato in almeno una delle perdite numero di copie di DNA 20 pazienti dello studio. L'espressione di questi geni è stata analizzata nei set di dati di matrice macro e micro-sezionato. Una significativa associazione è stata trovata tra i geni con perdita di numero di copie e la loro espressione in entrambi i campioni macro e micro-sezionato. (LS P valori
, rispettivamente 0,009 e 0,006 per LCM e campioni macrodissected,) (Figura 3B).
Concordanza di firme gene con geni precedentemente segnalati per essere associate a cancro gastrico
una ricerca bibliografica su PubMed è stata eseguita per identificare precedentemente riportato geni e le proteine sovra e sotto-espresso per il cancro gastrico (parole chiave: immunoistochimica, cancro gastrico, e overexpressed e perdita di espressione). 58 proteine overexpressed nel cancro gastrico sono stati identificati in questo modo. Espressione genica per questi 58 proteine sono stati trovati ad arricchirsi nei dati di espressione da campioni raccolti da macrodissection (LS P
< 10 -5), ma nessun arricchimento nell'espressione dei 58 geni è stato trovato per i campioni raccolti da microdissezione (LS P
= 0,013). Al contrario, 66 proteine segnalati da underexpressed nel carcinoma gastrico sono stati arricchiti nei dati di array di espressione da campioni raccolti da microdissezione (LS P
< 10 -5), ma non da campioni raccolti da macrodissection (LS P
= 0.89) (Tabella 5) .table 5 geni del cancro gastrico in letteratura che sono stati espressi in modo differenziale tra il 20 e il cancro al 6 campioni normali a funzionalità di selezione P
< 0,05 secondo i dati di microarray generato utilizzando ogni metodo di lavorazione dei tessuti
geni sovraespresso nel cancro
underexpressed geni cancer
LCM&Macro1
LCM
Macro
LCM&Macro
LCM2
Macro
APOE
EGFR
AKT1
ANXA10
ANXA7
CDKN2B
AURKA
HGF
ANXA2
CASP6
BAD
FHIT
CCNE1
MET
CALR
CASP7
HLA-B
Cdc20
RHOA
CCNB1
CDH1
HLA-E
CDC25B
TNS4
EEF2
CTNNA1
HLA-G
CXCR4
ESM1
GSN
PRSS8
E2F1
HIF1A
HLA-F
PTEN
EGR1
MINA
IQGAP2
SDHB
GRB2
PHB
KCNE2
SH3GLB1
HK2
Klf4
TFF1
ICAM1
MUC6
INHBA
RARB
LOXL2
SMAD4
MCM3
PTMA
SPARC
1Previously riportato proteine sovraespresso per cancro gastrico che sono stati anche sovraespresso nel nostro microdissezione (LCM) e campioni di cancro macrodissected rispetto ai campioni normali
2Previoulsy riportato proteine underexpressed per cancro gastrico che sono stati anche nel nostro underexpressed microdissezione (LCM) campioni di cancro, ma non nei campioni tumorali macrodissected
Validazione dei microarray dati
al fine di convalidare i nostri dati di microarray, abbiamo effettuato analisi immunoistochimica su un gene identificato come underexpressed in campioni tumorali microdissezionate da 16 pazienti e 4 volontari che non sono stati inclusi nello studio del DNA microarray. TFF1
stato scelto per questo studio di convalida immunoistochimica, perché è significativamente underexpressed nei campioni LCM (P = 0,0036
), ma non nei campioni macrodissected (P
= 0.09), rispetto al normale mucosa gastrica. TFF1 immunoreattività nel cancro è stato valutato come -, +, ++ e +++ a 7 (43,8%), 3 (18,7%), 4 (25,0%) e 2 (12,5%), rispettivamente. Al contrario, tutti i normali campioni 6 mucosa gastrica (4 volontari sani e 2 normali campioni di tessuti adiacenti) conservato TFF1 immunoreattività (+++) (Figura 4). Così, i campioni di cancro gastrico era significativamente più bassa immunoreattività TFF1 del normale mucosa gastrica, in linea con le precedenti relazioni [13, 14] (P Compra di chi-quadrato = 0,007). Figura 4 rappresentativa TFF1 risultati di colorazione immunoistochimica per (A) un adenocarcinoma gastrico dimostrando la perdita di espressione TFF1, e (B) mucosa gastrica da un volontario sano esprimere TFF1 in cellule epiteliali gastriche. (Ingrandimento 200x =)
Questi risultati dimostrano che l'espressione del gene macrodissection a base di analisi di espressione genica ha superato le analisi di campioni di LCM per l'identificazione di geni sovraespressi nel cancro gastrico.
| | 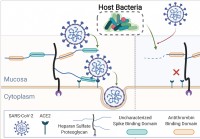 Il microbioma umano elimina i glicani della mucosa,
Il microbioma umano elimina i glicani della mucosa,
 Il microbioma intestinale può avere un ruolo nella grave COVID-19
Il microbioma intestinale può avere un ruolo nella grave COVID-19
 Il sesso orale può scatenare la vaginosi batterica
Il sesso orale può scatenare la vaginosi batterica
 L'alcol danneggia il microbioma in bocca
L'alcol danneggia il microbioma in bocca
 I ricercatori usano la terapia fagica per trattare con successo la malattia epatica alcolica
I ricercatori usano la terapia fagica per trattare con successo la malattia epatica alcolica
 Allergie legate a un maggiore consumo di cibo spazzatura,
Allergie legate a un maggiore consumo di cibo spazzatura,
 I microbi polmonari potrebbero aiutare a prevedere gli esiti nei malati gravi
Un nuovo studio pubblicato su American Journal of Respiratory and Critical Care Medicine mostra che la registrazione del modo in cui gli organismi che vivono allinterno dei polmoni cambiano nel tipo
I microbi polmonari potrebbero aiutare a prevedere gli esiti nei malati gravi
Un nuovo studio pubblicato su American Journal of Respiratory and Critical Care Medicine mostra che la registrazione del modo in cui gli organismi che vivono allinterno dei polmoni cambiano nel tipo
 I batteri dell'acido lattico e i batteri intestinali contribuiscono ai benefici per la salute della segale,
spettacoli di studio Mangiare segale ha una varietà di benefici per la salute. Un nuovo studio dellUniversità della Finlandia orientale mostra ora che sia i batteri dellacido lattico che i batteri int
I batteri dell'acido lattico e i batteri intestinali contribuiscono ai benefici per la salute della segale,
spettacoli di studio Mangiare segale ha una varietà di benefici per la salute. Un nuovo studio dellUniversità della Finlandia orientale mostra ora che sia i batteri dellacido lattico che i batteri int
 I bambini sono immuni preparati per SARS-CoV-2
Negli ultimi 20 anni sono emerse almeno 30 nuove malattie che insieme minacciano la salute di centinaia di milioni di persone. Per molte di queste malattie, non cè cura, cura, o vaccino. Sebbene la ma
I bambini sono immuni preparati per SARS-CoV-2
Negli ultimi 20 anni sono emerse almeno 30 nuove malattie che insieme minacciano la salute di centinaia di milioni di persone. Per molte di queste malattie, non cè cura, cura, o vaccino. Sebbene la ma