Von Salynn Boyles
WebMD Health News
Überprüft von Louise Chang, MD
19. September 2012 – Eine experimentelle Pille ist vielversprechend für die Behandlung von Multipler Sklerose.
In zwei Spätphasenstudien, die im The New England Journal of Medicine erschienen sind , reduzierte das Medikament BG-12 (Dimethylfumarat) die Schübe bei Patienten mit der häufigsten Form von MS um etwa die Hälfte.
Wenn es von der FDA zugelassen wird, wird BG-12, das vom Arzneimittelhersteller Biogen Idec entwickelt wird, das dritte orale Medikament für Menschen mit Multipler Sklerose.
Die zweite – die Pille Aubagio von Sanofi Aventis – hat erst letzte Woche die FDA-Zulassung erhalten.
"Dies ist eine aufregende Zeit in der Entwicklung neuer Medikamente für MS, insbesondere wenn man bedenkt, dass wir noch vor wenigen Jahrzehnten keine wirksamen Behandlungen hatten", sagt Dr. Timothy Coetzee, Chief Research Officer der National MS Society.
Multiple Sklerose ist eine chronische Krankheit, bei der das Immunsystem die Isolierung angreift, die die Nervenfasern des Gehirns und des Rückenmarks umhüllt und schützt.
Bei der häufigsten Form kommt es zu sporadischen Anfällen oder Schüben von Symptomen, denen dann Phasen der Remission folgen. Zu den Symptomen gehören Taubheit, Müdigkeit, Sehstörungen, Krämpfe und Probleme mit der Blasen- und Darmkontrolle.
Menschen mit dieser „schubförmig remittierenden“ Form von MS waren die Zielgruppe für das neue orale Medikament.
Die beiden neu veröffentlichten Studien wurden vom Hersteller des Medikaments finanziert.
In einem Fall hatten Patienten mit schubförmig remittierender Erkrankung, die BG-12 zweimal täglich einnahmen, eine 44-prozentige Reduzierung der Schübe über zwei Behandlungsjahre. In der zweiten Studie betrug die Rückfallreduktion im gleichen Zeitraum 53 %.
Die häufigsten Nebenwirkungen im Zusammenhang mit der Behandlung waren Hitzewallungen und Magenprobleme wie Durchfall und Bauchschmerzen. Aber bei den meisten Patienten traten nach dem ersten Behandlungsmonat weniger dieser Ereignisse auf.
Die zweimal tägliche Behandlung war in einer der Studien unter der Leitung des Neurologen Robert J. Fox, MD, der das Cleveland Clinic Mellen Center for Multiple Sclerosis leitet, auch mit einer 71-prozentigen Reduzierung neuer Hirnläsionen im Zusammenhang mit MS verbunden.
Fox hat als bezahlter Berater von Biogen Idec für Projekte gedient, die nichts mit der BG-12-Studie zu tun haben.
„Meiner Meinung nach bietet BG-12 eine sehr starke Kombination aus (Wirksamkeit), Sicherheit und Verträglichkeit“, sagt er.
Coetzee sagt, es bleibt abzuwarten, ob die neuen oralen Medikamente die injizierbaren Standardbehandlungen der ersten Wahl ersetzen werden.
"Meine Vermutung ist, dass die Injektionen eine wichtige Behandlungsoption bleiben werden", sagt er. "Je mehr Optionen wir haben, desto besser."
Das liegt daran, dass manche Menschen auf bestimmte Behandlungen nicht ansprechen oder sie nicht vertragen.
Anfang dieses Jahres reichte Biogen bei der FDA einen Antrag auf Vermarktung von BG-12 in den USA ein. Eine Sprecherin des Unternehmens sagte, die Behörde könne bis Ende des Jahres über den Antrag entscheiden.
 Klimawanderweg Gefahr von Infektionen durch fleischfressende Bakterien
Klimawanderweg Gefahr von Infektionen durch fleischfressende Bakterien
 Was ist offene und laparoskopische Resektionsrektopexie?
Was ist offene und laparoskopische Resektionsrektopexie?
 Wie lange dauert es, sich von einer Appendektomie zu erholen?
Wie lange dauert es, sich von einer Appendektomie zu erholen?
 Genuss und Wahrnehmung:eine Reise durch das Verdauungssystem
Genuss und Wahrnehmung:eine Reise durch das Verdauungssystem
 Höhepunkte und wichtige Erkenntnisse des Boston Bacterial Meeting (BBM) 2019
Höhepunkte und wichtige Erkenntnisse des Boston Bacterial Meeting (BBM) 2019
 Stuhlfarbänderungen und IBS
Stuhlfarbänderungen und IBS
 Steigende Bioverteidigungsrisiken durch die synthetische Biologie
Eine in Auftrag gegebene Studie des US-Verteidigungsministeriums hat ergeben, dass es mehrere gentechnische Werkzeuge gibt, mit denen in kurzer Zeit biologische Waffen entwickelt werden könnten. In
Steigende Bioverteidigungsrisiken durch die synthetische Biologie
Eine in Auftrag gegebene Studie des US-Verteidigungsministeriums hat ergeben, dass es mehrere gentechnische Werkzeuge gibt, mit denen in kurzer Zeit biologische Waffen entwickelt werden könnten. In
 Die Zeit, als ich meinen Arzt gefeuert habe (und wichtige Änderungen bei der privaten Beratung)
Es war 2007. Mein Arzt blickte von meiner Krankenakte auf und senkte seine Stimme… „Es tut mir leid, ich weiß nicht, was ich Ihnen sagen soll. Essen Sie kein Gluten. Es gibt nichts anderes, was Sie t
Die Zeit, als ich meinen Arzt gefeuert habe (und wichtige Änderungen bei der privaten Beratung)
Es war 2007. Mein Arzt blickte von meiner Krankenakte auf und senkte seine Stimme… „Es tut mir leid, ich weiß nicht, was ich Ihnen sagen soll. Essen Sie kein Gluten. Es gibt nichts anderes, was Sie t
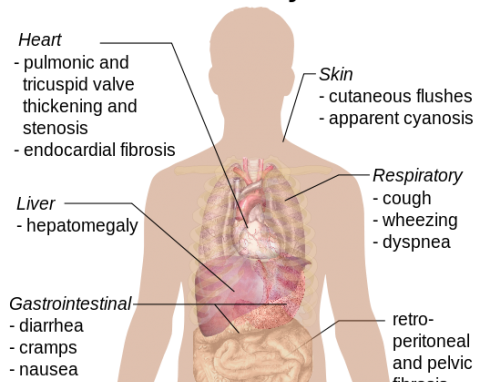 Karzinoidtumoren
Karzinoidtumoren werden als bösartig definiert Proliferation von gut differenzierten neuroendokrinen Zellen (Zellen, die bioaktive Verbindungen erzeugen). Tumore enthalten neuroendokrine sekretorisc
Karzinoidtumoren
Karzinoidtumoren werden als bösartig definiert Proliferation von gut differenzierten neuroendokrinen Zellen (Zellen, die bioaktive Verbindungen erzeugen). Tumore enthalten neuroendokrine sekretorisc