 Az iStock képe egy hasnyálmirigyrákos férfiról
Az iStock képe egy hasnyálmirigyrákos férfiról A hasnyálmirigyrák általában nem okoz tüneteket, amíg meg nem nő, ezért leggyakrabban előrehaladott stádiumban diagnosztizálják, nem pedig a betegség korai szakaszában. Egyes esetekben a fájdalom nélküli sárgaság (a bőr és a szemfehérje sárgás elszíneződése) a hasnyálmirigyrák korai jele lehet. További tünetek, amelyek előrehaladottabb betegség esetén fordulhatnak elő:
Sápadt széklet, hátfájás, hasi fájdalom, sötét vizelet, hasi puffadás, hasmenés és megnagyobbodott nyaki nyirokcsomók is előfordulhatnak.
Tudjon meg többet a hasnyálmirigyrák tüneteiről »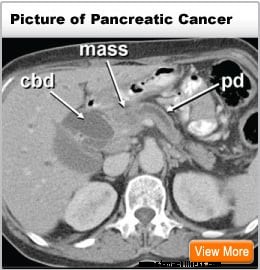
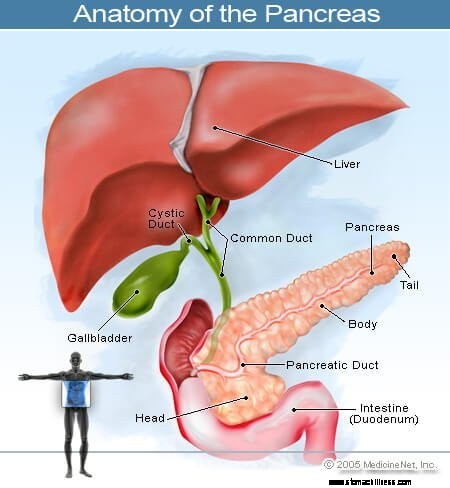 A hasnyálmirigyben kezdődő rákot hasnyálmirigyráknak nevezik. A hasnyálmirigy ezen a képe a has hátsó részén, a gyomor mögötti elhelyezkedését mutatja.
A hasnyálmirigyben kezdődő rákot hasnyálmirigyráknak nevezik. A hasnyálmirigy ezen a képe a has hátsó részén, a gyomor mögötti elhelyezkedését mutatja. A hasnyálmirigy egy hormontermelő szerv a hasban, amely a gerinc előtt, a köldök szintje felett helyezkedik el. Két fő funkciót lát el:
Az enzimek segítik az emésztést azáltal, hogy a fehérjéket, zsírokat és szénhidrátokat kisebb részekre aprítják, hogy a szervezet könnyebben felszívódhasson, és szövetek és energia építőköveiként hasznosulhasson. Az enzimek a hasnyálmirigyből egy csőrendszeren, az úgynevezett „csatornákon” keresztül távoznak, amelyek összekötik a hasnyálmirigyet a belekkel, ahol az enzimek keverednek a lenyelt táplálékkal.
A hasnyálmirigy mélyen a hasüregben helyezkedik el, és számos olyan fontos szerkezet közvetlen közelében van, mint a vékonybél (a nyombél) és az epeutak, valamint fontos erek és idegek.
Testünkben minden nap minden másodpercben hatalmas pusztulási és helyreállítási folyamat megy végbe. Az emberi test több billió sejtből áll, és naponta több milliárd sejt kopik el vagy pusztul el. Minden alkalommal, amikor a szervezet új sejtet hoz létre egy elhasználódott sejt helyére, a test megpróbálja tökéletes másolatot készíteni az elpusztuló sejtről, általában úgy, hogy a hasonló egészséges sejteket két sejtre osztják, mert a haldokló sejtnek volt egy feladata. , és az újonnan készített cellának képesnek kell lennie ugyanazt a funkciót ellátni. Annak ellenére, hogy rendkívül elegáns rendszerek működnek a folyamat során előforduló hibák kijavítására, a test naponta több tízezer hibát követ el a normál sejtosztódás során, akár véletlenszerű hibák, akár a testen belüli környezeti nyomás miatt. Ezeknek a hibáknak a többségét kijavítják, vagy a hiba az újonnan készített sejt elpusztulásához vezet, és egy másik új sejtet készítenek. Néha olyan hibát követnek el, amely ahelyett, hogy gátolja a sejt növekedési és túlélési képességét, lehetővé teszi, hogy az újonnan létrehozott sejt szabályozatlan módon növekedjen. Amikor ez megtörténik, az a sejt rákos sejtté válik, amely képes osztódni a normál sejtosztódást szabályozó fékektől és egyensúlyoktól függetlenül. A rákos sejt elszaporodik, rákos vagy rosszindulatú daganat alakul ki.
A daganatok két kategóriába sorolhatók:„jóindulatú” daganatok és „rosszindulatú” vagy rákos daganatok. Mi a különbség? A válasz az, hogy a jóindulatú daganat csak abban a szövetben nő, amelyből származik. A jóindulatú daganatok néha meglehetősen nagyra nőhetnek, vagy gyorsan növekedhetnek, és súlyos tüneteket okozhatnak. Például egy nő méhében lévő mióma vérzést vagy fájdalmat okozhat, de soha nem jut el a méhen kívülre, nem támadja meg a környező szöveteket, és nem nő új daganatként a test más részében (áttétet nem hoz létre). A miómák, mint minden jóindulatú daganat, nem képesek sejteket leadni a vérbe és a nyirokrendszerbe, és nem tudnak eljutni a test más részeire és növekedni. A rák viszont olyan sejteket irthat ki az eredeti daganatból, amelyek pitypangmagként lebeghetnek a szélben a véráramon vagy a nyirokrendszeren keresztül, a daganattól távoli szövetekben landolnak, és a test más részein új daganatokká fejlődhetnek. Ez a metasztázisnak nevezett folyamat a rákos daganatok meghatározó jellemzője. A hasnyálmirigyrák sajnos különösen jó modell erre a folyamatra. A hasnyálmirigyrák ilyen módon korán áttétet adhat más szervekre. Emellett növekedhetnek és közvetlenül behatolhatnak a szomszédos struktúrákba, ami gyakran lehetetlenné teszi a daganat műtéti eltávolítását.
A rákot azon szövetek alapján nevezik el, amelyekből az elsődleges daganat származik. Ezért a májba terjedő tüdőrák nem „májrák”, hanem metasztatikus tüdőrákként írják le, és az agyba terjedő emlőrákban szenvedő beteget nem úgy írják le, hogy „agydaganat” van, hanem úgy, hogy áttétes emlőrák.


Mi az a Polycythemia Vera?
További információ
A hasnyálmirigyben kialakuló rákos megbetegedések két fő kategóriába sorolhatók:(1) az endokrin hasnyálmirigy (az inzulint és más hormonokat termelő rész) rákos megbetegedései „szigetsejtnek” vagy „hasnyálmirigy neuroendokrin daganatának vagy PNET-nek” nevezik, és (2) rákos megbetegedések. az exokrin hasnyálmirigy (az enzimeket termelő rész). A szigetsejtrák ritka, és jellemzően lassan nő az exokrin hasnyálmirigyrákokhoz képest. A szigetsejt-daganatok gyakran hormonokat bocsátanak ki a véráramba, és az általuk termelt hormonok (inzulin, glukagon, gasztrin és más hormonok) is jellemzik őket. Az exokrin hasnyálmirigy rákos megbetegedései (exokrin rákos megbetegedések) azokból a sejtekből fejlődnek ki, amelyek a vékonybélbe enzimeket szállító csatornarendszert szegélyezik, és ezeket általában hasnyálmirigy-adenokarcinómáknak nevezik. A laphámsejtes hasnyálmirigyrák ritka. A hasnyálmirigy-adenokarcinóma a legtöbb hasnyálmirigy-csatornarákot magában foglalja, és ennek az áttekintésnek a fő témája.
Az exokrin hasnyálmirigy csatornáit szegélyező sejtek gyorsabban osztódnak, mint az őket körülvevő szövetek. Érthetetlen okokból ezek a sejtek hibát követhetnek el, amikor lemásolják DNS-üket, miközben osztódnak, hogy más elhaló sejteket helyettesítsenek. Ily módon abnormális sejtet lehet létrehozni. Amikor egy abnormális duktális sejt szabályozatlan módon osztódásba kezd, olyan növekedés alakulhat ki, amely abnormális megjelenésű és működésű sejtekből áll. A mikroszkóp alatt felismerhető kóros elváltozásokat "diszpláziának" nevezik. A diszpláziás sejtek gyakran további DNS-hibákon eshetnek át idővel, és még abnormálisabbá válhatnak. Amikor ezek a diszpláziás sejtek behatolnak a csatorna falain keresztül a környező szövetbe, a diszplázia rákossá válik.
Egy 2016-ban közzétett tanulmányban a kutatók 456 hasnyálmirigy-ductalis adenokarcinóma gének elemzéséről számoltak be. Az adenokarcinómák ezt követő expressziós analízise lehetővé tette, hogy négy altípusba sorolják őket. Ezeket az altípusokat korábban nem ismerték fel. Az altípusok a következők:
Ezek az új eredmények lehetővé tehetik a jövő rákos betegek kezelését az altípusuktól függően, és remélhetőleg még hatékonyabban. Például az immunogén altípus reagálhat olyan terápiára, ahol az immunrendszert úgy alakítják át, hogy megtámadja az ilyen típusú rákos sejteket.
A hasnyálmirigyrákot nem szabad összetéveszteni a hasnyálmirigy-gyulladás kifejezéssel. A hasnyálmirigy-gyulladást egyszerűen a hasnyálmirigy gyulladásaként határozzák meg, és főként alkoholfogyasztás és/vagy epekőképződés okozza (körülbelül 80-90%). Ennek ellenére a krónikus hasnyálmirigy-gyulladás társul hasnyálmirigyrákhoz.
Évente körülbelül 53 670 hasnyálmirigyrák-eset fordul elő az Egyesült Államokban. A legtöbb ember, akinél hasnyálmirigyrák alakul ki, ezt hajlamosító kockázati tényezők nélkül teszi. A legnagyobb kockázati tényező azonban talán az életkor növekedése; 60 év felettiek nagyobb kockázatnak teszik ki az egyént. Ritkán előfordulhatnak olyan családi vagy örökletes genetikai szindrómák, amelyek olyan genetikai mutációkból erednek, amelyek családon belül futnak le, és nagyobb kockázatot jelentenek az egyéneknek, mint például a BRCA-2 és kisebb mértékben a BRCA-1 génmutációk. A családi szindrómák szokatlanok, de fontos, hogy tájékoztassák az orvost, ha a családban másnál is diagnosztizáltak rákot, különösen hasnyálmirigyrákot. Ezenkívül úgy gondolják, hogy bizonyos viselkedések vagy állapotok kissé növelik az egyén hasnyálmirigyrák kialakulásának kockázatát. Például az afro-amerikaiak nagyobb kockázatnak lehetnek kitéve, csakúgy, mint azok a közeli családtagok, akiknél korábban hasnyálmirigyrákot diagnosztizáltak. Egyéb viselkedések vagy állapotok, amelyek veszélyeztethetik az embereket, közé tartozik a dohányzás, az elhízás, az ülő életmód, a cukorbetegség, a krónikus hasnyálmirigy-gyulladás (hasnyálmirigy-gyulladás) és a zsíros (vagy nyugati) étrend. A korábbi gyomorműtét mérsékelten növelheti a kockázatot, csakúgy, mint bizonyos krónikus fertőzések, például a hepatitis B és H. pylorit (a gyomor nyálkahártyájának bakteriális fertőzése). Bizonyos gyógyszerek (szitagliptin [Januvia], exenatid [Byetta], liraglutid [Victoza], valamint metformin és szitagliptin [Janumet]) összefüggésbe hozhatók a hasnyálmirigyrák kialakulásával. A hasnyálmirigy-ciszták bizonyos típusai veszélyeztethetik a hasnyálmirigyrák kialakulását. Néhány kutató szerint a kávé és az üdítő fogyasztása növeli a hasnyálmirigyrák kockázatát. Amikor a hasnyálmirigyrák elkezdődik, általában a hasnyálmirigy csatornáit bélelő sejtekben kezdődik, és hasnyálmirigy-adenokarcinómának nevezik. vagy hasnyálmirigy-exokrin rák . A fent említett kapcsolódó kockázatok ellenére a legtöbb hasnyálmirigyrákban szenvedő embernél nem találnak azonosítható okot.
A "Küldés" gombra kattintva elfogadom a MedicineNet Általános Szerződési Feltételeit és Adatvédelmi szabályzatát. Azt is elfogadom, hogy e-maileket kapok a MedicineNettől, és tudomásul veszem, hogy bármikor leiratkozhatok a MedicineNet előfizetésekről.
Mivel a hasnyálmirigy mélyen a hasban, a gerinc előtt fekszik, a hasnyálmirigyrák gyakran hónapokig csendben fejlődik, mielőtt felfedezik. A rák korai tünetei és/vagy első jelei hiányozhatnak, vagy meglehetősen finomak lehetnek. Könnyebben azonosítható tünetek alakulnak ki, ha a daganat elég nagyra nő ahhoz, hogy más közeli struktúrákat, például idegeket (ami általános fájdalmat és/vagy hátfájdalmat okoz), a beleket (ami befolyásolja az étvágyat és hányingert okoz súlycsökkenéssel) vagy epeutak (amely sárgaságot vagy a bőr besárgulását okozza, és étvágytalanságot és viszketést okozhat). A nők tünetei ritkán térnek el a férfiak tüneteitől. Miután a daganat rákos sejteket bocsát ki a vérbe és a nyirokrendszerbe, és áttéteket ad, általában további tünetek jelentkeznek, a metasztázis helyétől függően. A hasnyálmirigyrák gyakori metasztázisai közé tartozik a máj, a nyirokcsomók és a hasnyálkahártya (úgynevezett hashártya; az ascites folyadék felhalmozódhat áttétes hasnyálmirigyrák esetén). Sajnos a legtöbb hasnyálmirigyrákot azután találják meg, hogy a rák a hasnyálmirigyen túl nőtt vagy továbbhaladt, vagy más helyekre metasztatizálódott.
Általánosságban elmondható, hogy a hasnyálmirigyrák jeleit és tüneteit exokrin vagy endokrin rákos sejtek is előállíthatják. Az exokrin hasnyálmirigyrák számos jele és tünete a hasnyálmirigyen keresztül a májból a bélbe epét szállító csatorna elzáródásából ered. Az exokrin hasnyálmirigyrák tünetei közé tartozik a
Az endokrin hasnyálmirigyrák jelei és tünetei gyakran az általuk termelt hormonfelesleggel és ennek következtében számos különböző tünethez kapcsolódnak. Az ilyen tünetek a hormonokhoz kapcsolódnak, és a következők:
A nem működő neuroendokrin daganatok nem termelnek többlet hormonokat, de nagyra nőhetnek és kiterjedhetnek a hasnyálmirigyből. A tünetek ilyenkor hasonlóak lehetnek a fent leírt endokrin hasnyálmirigyrákokhoz.
A legtöbb embernek nincs szüksége hasnyálmirigyrák-szűrésre, és a szűrésre rendelkezésre álló vizsgálatok gyakran összetettek, kockázatosak, drágák vagy érzéketlenek a rák korai szakaszában. Azok, akik alkalmasak lehetnek a minősítésre, általában olyan tényezőkkel rendelkeznek, amelyek növelik a hasnyálmirigyrák kockázatát, mint például a hasnyálmirigy-ciszták, a hasnyálmirigyrákban szenvedő első fokú rokonok vagy a hasnyálmirigyrákhoz kapcsolódó genetikai szindrómák anamnézisében. A legtöbb szűrővizsgálat CT-vizsgálatból, ultrahangból, mágneses rezonancia cholangiopancreatography (MRCP), endoszkópos retrográd cholangiopancreatography (ERCP) vagy endoszkópos ultrahangból áll. Sajnos a hasnyálmirigyrák korai felismerése nehéz, mert kevés vagy egyáltalán nem jelentkezik a tünet.
A legtöbb hasnyálmirigyrákos ember először nem specifikus tünetekre panaszkodik az alapellátó orvoshoz (lásd a fenti tünetek szakaszt). Néhány figyelmeztető jel a fájdalom, a gyomor-bélrendszeri tünetek, a fogyás, a fáradtság és a megnövekedett hasi folyadék. Ezek a panaszok kiértékelést indítanak el, amely gyakran tartalmaz fizikális vizsgálatot (általában normális), vérvizsgálatot, röntgenfelvételt és ultrahangot. Ha hasnyálmirigyrák van jelen, körülbelül 75% a valószínűsége annak, hogy az ultrahang a hasnyálmirigy rendellenességét tárja fel. Ha problémát azonosítanak vagy gyanítanak, az értékelés következő lépéseként gyakran számítógépes tomográfiás (CT) vizsgálatot végeznek; egyes klinikusok az MRI-t részesítik előnyben. Ha hasnyálmirigy-tömeg látható, az felveti a hasnyálmirigyrák gyanúját, és az orvos biopsziát végez a diagnózis felállítása érdekében.
Különféle stratégiák alkalmazhatók a feltételezett rák biopsziájának elvégzésére. Gyakran előfordul, hogy a hasfalon keresztül a máj tűbiopsziáját (perkután májbiopsziát) alkalmazzák, ha úgy tűnik, hogy a rák átterjedt a májra. Ha a daganat a hasnyálmirigyben lokalizálódik, a hasnyálmirigy biopsziáját általában CT segítségével végzik el. Közvetlen biopszia is készíthető endoszkóppal, amelyet a torkon és a belekben helyeznek el. Az endoszkóp hegyén található kamera lehetővé teszi az endoszkópos szakember számára, hogy az endoszkópot a bélben továbbítsa. Az endoszkóp csúcsán található ultrahangos készülék meghatározza a hasnyálmirigy biopsziás területét, és egy biopsziás tűt átvezetnek az endoszkóp egy működő csatornáján, hogy szövetet nyerjenek a feltételezett rákból. Végső soron a szövetdiagnózis az egyetlen módja annak, hogy biztosan megállapítsák a diagnózist, és az orvosok csapata azon dolgozik, hogy a lehető legegyszerűbb módon készítsék el a szöveti diagnózist.
A radiológiai vizsgálatokon kívül a hasnyálmirigyrák gyanúja felmerülhet egy „tumormarker” emelkedéséből is, amely vérvizsgálat abnormálisan magas lehet hasnyálmirigyrákos betegeknél. A hasnyálmirigyrákhoz leggyakrabban kapcsolódó tumormarkert CA19-9-nek nevezik. Gyakran hasnyálmirigyráksejtek bocsátják ki a véráramba, és megemelkedhet azokban a betegekben, akiknél újonnan kiderült, hogy hasnyálmirigyrákja van. Sajnos, bár a CA19-9 teszt rákkal kapcsolatos, nem specifikus a hasnyálmirigyrákra. Más rákos megbetegedések, valamint bizonyos jóindulatú állapotok a CA 19-9 emelkedését okozhatják. Néha (az esetek körülbelül 20%-ában) a CA19-9 normális szinten van a vérben a hasnyálmirigyrák megerősített diagnózisa ellenére, így a tumormarker nem tökéletes. Hasznos lehet azonban a betegség lefolyása alatt követni, mivel annak emelkedése és csökkenése korrelálhat a rák növekedésével, és segíthet a megfelelő terápia meghatározásában.
Amint a hasnyálmirigyrákot diagnosztizálják, „stádiumba” kerül. A hasnyálmirigyrák négy szakaszra oszlik, amelyek közül az 1. stádium a legkorábbi stádium (a 0. stádium nem számít), és a IV. szakasz a legelőrehaladottabb (áttétet adó betegség). Az alábbiakban a hasnyálmirigyrák stádiumai találhatók a Nemzeti Rákkutató Intézet szerint:
0. szakasz :A rák csak a hasnyálmirigy-csatornák nyálkahártyájában található. A 0. stádiumot in situ carcinomának is nevezik.
I. szakasz :A rák kialakult, és csak a hasnyálmirigyben található.
II. szakasz :A rák átterjedhetett vagy előrehaladt a közeli szövetekre, szervekre és a hasnyálmirigy közelében lévő nyirokcsomókra.
III. szakasz :A rák átterjedt vagy előrehaladt a hasnyálmirigy közelében lévő fő erekbe, és átterjedhetett a közeli nyirokcsomókra.
IV. szakasz :A rák bármilyen méretű lehet, és átterjedt a távoli szervekre, például a májra, a tüdőre és a peritoneális üregre. Elterjedhetett a hasnyálmirigy közelében lévő szervekre és szövetekre vagy a nyirokcsomókra is. Ezt a szakaszt végstádiumú hasnyálmirigyráknak is nevezik.
Sok daganatos megbetegedéstől eltérően azonban a hasnyálmirigyrákos betegeket jellemzően három kategóriába sorolják:helyi betegségben szenvedők, lokálisan előrehaladott, nem reszekálható betegségben szenvedők és áttétes betegségben szenvedők. Az e három csoportba tartozó betegek kezdeti terápiája gyakran eltérő.
Az I. és II. stádiumú rákban szenvedő betegekről azt gondolják, hogy lokális vagy "reszekálható" rákosak (műtéttel teljesen eltávolítható rák). A III. stádiumú rákban szenvedő betegek „lokálisan előrehaladott, nem reszekálható” betegségben szenvednek. Ebben a helyzetben a gyógyulás lehetősége elveszett, de a helyi kezelések, például a sugárterápia továbbra is lehetségesek. A IV. stádiumú hasnyálmirigyrákban szenvedő betegeknél a kemoterápia leggyakrabban javasolt a rákkal kapcsolatos tünetek szabályozására és az élet meghosszabbítására. Az alábbiakban áttekintjük a hasnyálmirigyrák három csoportjának (reszekálható, lokálisan előrehaladott nem reszekálható és metasztatikus hasnyálmirigyrák) általános kezelését.
If a pancreatic cancer is found at an early stage (stage I and stage II) and is contained locally within or around the pancreas, surgery may be recommended (resectable pancreatic cancer). Surgery is the only potentially curative treatment for pancreatic cancer. The surgical procedure most commonly performed to remove a pancreatic cancer is a Whipple procedure (pancreatoduodenectomy or pancreaticoduodenectomy). It often comprises removal of a portion of the stomach, the duodenum (the first part of the small intestine), pancreas, a portion of the main bile duct, lymph nodes, and gallbladder. It is important to be evaluated at a hospital with lots of experience performing pancreatic cancer surgery because the operation is a big one, and evidence shows that experienced surgeons better select people who can get through the surgery safely and also better judge who will most likely benefit from the operation. In experienced hands, the mortality from the surgery itself is less than 4%.
After the Whipple surgery, patients typically spend about one week in the hospital recovering from the operation. Complications from the surgery can include blood loss (anemia), leakage from the reconnected intestines or ducts, or slow return of bowel function. Recovery to presurgical health often can take several months.
After patients recover from a Whipple procedure for pancreatic cancer, treatment to reduce the risk of the cancer returning is a standard recommendation. This treatment, referred to as "adjuvant therapy (chemotherapy)," has proven to lower the risk of recurrent cancer. Typically, physicians recommend six months of adjuvant chemotherapy, sometimes with radiation incorporated into the treatment plan.
Some patients with pancreatic cancer experience blockage of bile and/or pancreas ducts and thus may need a surgeon to place a stent to allow drainage through the stent.
Unfortunately, only about 20 people out of 100 diagnosed with pancreatic cancer are found to have a tumor that is amenable to surgical resection or is borderline resectable. The rest have pancreatic tumors that are too locally advanced to completely remove or have metastatic spread at the time of diagnosis. Even among patients whose cancers are amenable to surgery, statistical data suggest that only 20% live 5 years. Most pancreatic cancer patients do not qualify for a pancreas transplant because of their advanced disease; most pancreas transplants are done in patients with diabetes that results from the removal of the endocrine portion of the pancreas and not for pancreatic cancer. Consequently, remission rates are fair to poor.
If a pancreatic cancer is found when it has grown into important local structures but not yet spread to distant sites, this is described as locally advanced, unresectable (inoperable) pancreatic cancer (stage III). The standard of care in the United States for the treatment of locally advanced cancer is a combination of low-dose chemotherapy given simultaneously with radiation treatments to the pancreas and surrounding tissues. Radiation treatments are designed to lower the risk of local growth of the cancer, thereby minimizing the symptoms that local progression causes (back or belly pain, nausea, loss of appetite, intestinal blockage, jaundice). Radiation treatments are typically given Monday through Friday for about five weeks. Chemotherapy given concurrently (at the same time; FOLFOX combination therapy) may improve the effectiveness of the radiation and may lower the risk for cancer spread outside the area where the radiation is delivered. When the radiation is completed and the patient has recovered, more chemotherapy often is recommended. Recently, newer forms of radiation delivery (proton therapy, stereotactic radiosurgery, gamma knife radiation, Nanoknife, CyberKnife radiation) have been utilized in locally advanced pancreatic cancer with varying degrees of success, but these treatments can be more toxic and are, for now, largely experimental; individuals should discuss with their doctors what treatment(s) are best for their condition.
Once a pancreatic cancer has spread beyond the vicinity of the pancreas and involves other organs, it has become a problem through the system. As a result, a systemic treatment is most appropriate and chemotherapy (for example, nab-paclitaxel [Abraxane] in combination with gemcitabine [Gemzar]) is recommended. Chemotherapy travels through the bloodstream and goes anywhere the blood flows and, as such, treats most of the body. It can attack a cancer that has spread through the body wherever it is found. In metastatic pancreatic cancer, chemotherapy is recommended for individuals healthy enough to receive it. It has been proven to both extend the lives of patients with pancreatic cancer and to improve their quality of life. These benefits are documented, but unfortunately the overall benefit from chemotherapy in pancreatic cancer treatment is modest and chemotherapy prolongs life for the average patient by only a few months. Chemotherapy options for patients with pancreatic cancer vary from treatment with a single chemotherapy agent like Tarceva or Onivyde to treatment with as many as two or three chemotherapy agents or immunotherapy agents given together (for example, capecitabine plus ruxolitinib). The aggressiveness of the treatment is determined by the cancer doctor (medical oncologist) and by the overall health and strength of the individual patient.
Side effects of treatment for pancreatic cancer vary depending on the type of treatment. For example, radiation treatment (which is a local treatment) side effects tend to accumulate throughout the course of radiation therapy and include fatigue, nausea, and diarrhea. Chemotherapy side effects depend on the type of chemotherapy given (less aggressive chemotherapy treatments typically cause fewer side effects whereas more aggressive combination regimens are more toxic) and can include fatigue, loss of appetite, change in taste, hair loss (although not usually), and lowering of the immune system with risk for infections (immunosuppression). While these lists of side effects may seem worrisome, radiation doctors (radiation oncologists) and medical oncologists have much better supportive medications than they did in years past to control any nausea, pain, diarrhea, or immunosuppression related to treatment. The risks associated with pancreatic cancer treatment must be weighed against the inevitable and devastating risks associated with uncontrolled pancreatic cancer and, if the treatments control progression of the cancer, most patients feel better on treatment than they otherwise would.
Pancreatic cancer is a difficult disease. Even for surgically resectable (and therefore potentially curable) pancreatic tumors, the risk of cancer recurrence and subsequent death remains high. Consequently, the prognosis of pancreatic cancer usually ranges from fair to poor. Only about 20% of patients undergoing a Whipple procedure for potentially curable pancreatic cancer live five years, with the rest surviving on average less than two years. For patients with incurable (locally advanced unresectable or metastatic) pancreatic cancer, survival is even shorter; typically, it is measured in months. With metastatic disease (stage IV), the average survival is just over six months. The American Cancer Society statistics suggest that for all stages of pancreatic cancer combined, the one-year survival rate is 20% and the mortality rate is 80%, while the five-year survival rate is 6% with a mortality rate of 94%. These rates are mainly based on patients diagnosed between 1985 and 2004 and are representative of those patients according to the American Cancer Society (ACS). These data-based survival rates are what are available currently, but they are only estimates and are not predictive about what may happen to each individual. Currently, the ACS advises patients to discuss their individual situation and prognosis with their treatment team of physicians. Doctors around the world continue to study pancreatic cancer and strive to improve treatments, but progress has been difficult to achieve.
Doctors and researchers all over the world are hard at work developing better treatments for pancreatic cancer. Cooperative cancer research led by centers of excellence in this country and many others continue daily to test new surgical techniques, radiation strategies, chemotherapy agents, and alternative therapies in an effort to improve care. Given the slow progress experienced over the last quarter century, many doctors feel that every eligible patient with pancreatic cancer should be offered enrollment in a research trial. New cytotoxic combinations of drugs are being tried in clinical trials. For example, Folfirinox, a new combination regimen consisting of four different chemicals has shown increased survival times for patients in clinical trials. In addition, patients who received one of two vaccines, GVAX and CRS-207, showed about a doubling of survival time compared to patients that did not receive the vaccine; this vaccine protocol is still undergoing clinical trials. For a complete list of clinical trials in pancreatic cancer treatment, please check online at http://www.cancer.gov.
Complimentary or alternative medicine is of unclear benefit in pancreatic cancer treatment. No specific complimentary or alternative therapy has been proven beneficial, but many adjunctive treatments have been tried. Compounds such as curcumin, the principle ingredient in turmeric, have shown efficacy in nonhuman research and are being tested in clinical trials in pancreatic cancer. Given the modest benefit derived from chemotherapy and radiation in this disease, alternative approaches in the treatment of pancreatic cancer in conjunction with (rather than instead of) standard treatment is warranted.
At this time, there is no known surveillance strategy to reduce the risk of pancreatic cancer for the general population. With only 48,900 new diagnoses a year, screening blood tests or X-rays have never been proven to be cost effective or beneficial. Additionally, doctors do not routinely screen individuals with family members diagnosed with pancreatic cancer aside from the rare instance where a known genetic risk factor is present. Some researchers suggest vitamin D blood levels above 40 ng/ml may reduce the risk of pancreatic cancer.
There are many fine organizations helping to provide support for individuals and families battling pancreatic cancer. Many hospitals provide support networks utilizing the expertise of trained social workers with experience in caring for people with cancer. Additionally, the Pancreatic Cancer Action Network (PANCAN) and the American Cancer Society both provide information and support for people living with pancreatic cancer. Visit their web sites at http://www.pancan.org and http://www.cancer.org. Diet recommendations can be found at ACS Guidelines on Nutrition and Physical Activity for Cancer Prevention.
Again, both PANCAN and the American Cancer Society are excellent resources for additional information regarding pancreatic cancer. The American Society of Clinical Oncology web site (http://www.cancer.net) also boasts a wealth of information for patients, family members, and professionals interesting in learning more about this disease. November is Pancreatic Awareness Month with the goal to make pancreas care an everyday event (http://daysofyear.com/pancreatic-cancer-awareness-month/).
 Az akut hasnyálmirigy-gyulladás osztályozása – Az akut has diagnosztizálása
Az akut hasnyálmirigy-gyulladás osztályozása – Az akut has diagnosztizálása
 Mikor érdemes orvoshoz menni aranyérrel?
Mikor érdemes orvoshoz menni aranyérrel?
 A mozgásszegénység elkerülése:költözz az egészség megőrzése érdekében
A mozgásszegénység elkerülése:költözz az egészség megőrzése érdekében
 A rotavírus szerepet játszik az 1 -es típusú cukorbetegség kialakulásában
A rotavírus szerepet játszik az 1 -es típusú cukorbetegség kialakulásában
 1. hét, élelmiszer-újrabevezető áttekintés az elemi étrend után
1. hét, élelmiszer-újrabevezető áttekintés az elemi étrend után
 Gastrokolikus reflexe IBS-sel
Gastrokolikus reflexe IBS-sel
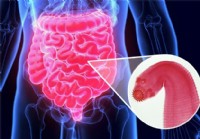 Emésztőrendszeri betegségek:Amit a galandférgekről tudni kell
Bélparazita A galandférgek lapos, tagolt férgek, amelyek behatolhatnak az emberek és állatok emésztőrendszerébe. Paraziták, ami azt jelenti, hogy szükségük van egy gazdatestre a túléléshez. A hús a
Emésztőrendszeri betegségek:Amit a galandférgekről tudni kell
Bélparazita A galandférgek lapos, tagolt férgek, amelyek behatolhatnak az emberek és állatok emésztőrendszerébe. Paraziták, ami azt jelenti, hogy szükségük van egy gazdatestre a túléléshez. A hús a
 Genetika:van előre meghatározott halálos ítéleted?
Amikor megszületett az első gyermekem, a barátok és a család azt mondogatták:„Ó, a te szemeid vannak !” vagy „Istenem, megvan az anyja mosolya !” Mosolyognék… de legbelül összerándulnék. Ez a hang a
Genetika:van előre meghatározott halálos ítéleted?
Amikor megszületett az első gyermekem, a barátok és a család azt mondogatták:„Ó, a te szemeid vannak !” vagy „Istenem, megvan az anyja mosolya !” Mosolyognék… de legbelül összerándulnék. Ez a hang a
 Mi történik, ha a Crohn-kórt nem kezelik?
A Crohn-betegség kezelés nélkül súlyosbodik. Ha nem kezelik, a Crohn-kór az egész bélrendszerben elterjed, súlyos tüneteket és kilátástalan kezelést okozva. A vastagbélrák nagyobb valószínűséggel alak
Mi történik, ha a Crohn-kórt nem kezelik?
A Crohn-betegség kezelés nélkül súlyosbodik. Ha nem kezelik, a Crohn-kór az egész bélrendszerben elterjed, súlyos tüneteket és kilátástalan kezelést okozva. A vastagbélrák nagyobb valószínűséggel alak