 iStockin kuva miehestä, jolla on haimasyöpä
iStockin kuva miehestä, jolla on haimasyöpä Haimasyöpä ei tyypillisesti aiheuta oireita ennen kuin se on kasvanut, joten se diagnosoidaan useimmiten pitkälle edenneissä vaiheissa eikä varhaisessa vaiheessa. Joissakin tapauksissa keltaisuus (ihon ja silmänvalkuaisten kellertävä värjäytyminen) ilman kipua voi olla varhainen merkki haimasyövästä. Muita oireita, joita voi esiintyä pidemmälle edenneen taudin yhteydessä, ovat:
Myös kalpea uloste, selkäkipu, vatsakipu, tumma virtsa, vatsan turvotus, ripuli ja niskan imusolmukkeiden suureneminen voivat esiintyä.
Lue lisää haimasyövän oireista »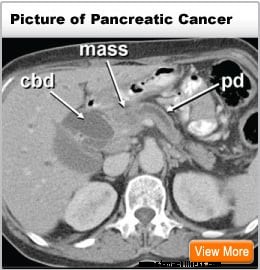
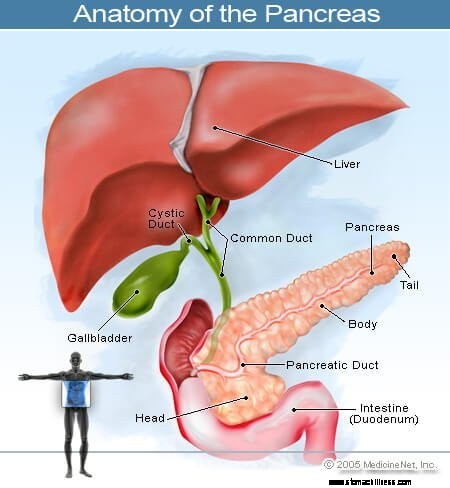 Haimasta alkavaa syöpää kutsutaan haimasyöväksi. Tämä kuva haimasta näyttää sen sijainnin vatsan takaosassa mahalaukun takana.
Haimasta alkavaa syöpää kutsutaan haimasyöväksi. Tämä kuva haimasta näyttää sen sijainnin vatsan takaosassa mahalaukun takana. Haima on hormoneja tuottava elin vatsassa, joka sijaitsee selkärangan edessä napatason yläpuolella. Se suorittaa kaksi päätoimintoa:
Entsyymit auttavat ruuansulatuksessa pilkkomalla proteiinit, rasvat ja hiilihydraatit pienemmiksi osiin, jotta ne imeytyvät paremmin elimistöön ja toimivat kudosten ja energian rakennuspalikoina. Entsyymit poistuvat haimasta putkien kautta, joita kutsutaan "kanaviksi", jotka yhdistävät haiman suolistoon, jossa entsyymit sekoittuvat nautitun ruoan kanssa.
Haima sijaitsee syvällä vatsassa ja on lähellä monia tärkeitä rakenteita, kuten ohutsuolen (pohjukaissuolen) ja sappitiehyet sekä tärkeitä verisuonia ja hermoja.
Joka sekunti joka päivä kehossamme tapahtuu valtava tuhoutumis- ja korjausprosessi. Ihmiskeho koostuu biljoonista soluista ja joka päivä miljardit solut kuluvat tai tuhoutuvat. Joka kerta kun keho tekee uuden kuluvan solun tilalle, keho yrittää tehdä täydellisen kopion kuolevasta solusta, yleensä antamalla samanlaiset terveet solut jakautua kahdeksi soluksi, koska kuolevalla solulla oli tehtävänsä. , ja juuri tehdyn solun on kyettävä suorittamaan sama toiminto. Huolimatta erittäin tyylikkäistä järjestelmistä tämän prosessin virheiden korjaamiseksi, keho tekee kymmeniä tuhansia virheitä päivittäin normaalissa solunjakautumisessa joko satunnaisten virheiden tai kehon sisäisen ympäristön paineen vuoksi. Suurin osa näistä virheistä korjataan tai virhe johtaa juuri tehdyn solun kuolemaan, ja sitten tehdään uusi uusi solu. Joskus tehdään virhe, joka sen sijaan, että estäisi solun kykyä kasvaa ja selviytyä, sallii juuri tehdyn solun kasvaa säätelemättömällä tavalla. Kun näin tapahtuu, kyseisestä solusta tulee syöpäsolu, joka pystyy jakautumaan normaalia solunjakautumista säätelevistä rajoituksista ja tasapainoista riippumatta. Syöpäsolu lisääntyy ja syöpä tai pahanlaatuinen kasvain kehittyy.
Kasvaimet jakautuvat kahteen luokkaan:"hyvänlaatuiset" kasvaimet ja "pahanlaatuiset" tai syöpäkasvaimet. Mikä on ero? Vastaus on, että hyvänlaatuinen kasvain kasvaa vain kudoksessa, josta se syntyy. Hyvänlaatuiset kasvaimet voivat joskus kasvaa melko suuriksi tai kasvaa nopeasti ja aiheuttaa vakavia oireita. Esimerkiksi naisen kohdun fibroidi voi aiheuttaa verenvuotoa tai kipua, mutta se ei koskaan kulje kohdun ulkopuolelle, tunkeudu ympäröiviin kudoksiin tai kasva uutena kasvaimena muualla kehossa (metastasoitunut). Fibroidit, kuten kaikki hyvänlaatuiset kasvaimet, eivät pysty irrottamaan soluja vereen ja imusolmukkeisiin, eivätkä ne voi kulkeutua muihin paikkoihin kehossa ja kasvaa. Syöpä puolestaan voi irrottaa alkuperäisestä kasvaimesta soluja, jotka voivat kellua voikukansiementen tavoin tuulessa verenkierron tai imusolmukkeiden läpi, laskeutua kasvaimesta kaukana oleviin kudoksiin ja kehittyä uusiksi kasvaimiksi muissa kehon osissa. Tämä prosessi, jota kutsutaan metastaasiksi, on syöpäkasvaimen määrittävä ominaisuus. Haimasyöpä on valitettavasti erityisen hyvä malli tälle prosessille. Haimasyövät voivat metastasoitua varhain muihin elimiin tällä tavalla. Ne voivat myös kasvaa ja tunkeutua suoraan viereisiin rakenteisiin, mikä tekee usein kasvaimen kirurgisen poistamisen mahdottomaksi.
Syövät nimetään niiden kudosten mukaan, joista primaarinen kasvain syntyy. Näin ollen keuhkosyöpä, joka kulkeutuu maksaan, ei ole "maksasyöpä", vaan sitä kuvataan metastaattiseksi keuhkosyöväksi, ja potilasta, jolla on aivoihin leviävä rintasyöpä, ei kuvata olevan "aivokasvain" vaan pikemminkin. metastaattinen rintasyöpä.


Mikä on Polycythemia Vera?
Lisätietoja aiheesta
Haimassa kehittyvä syöpä jakautuu kahteen pääluokkaan:(1) endokriinisen haiman (insuliinia ja muita hormoneja valmistavan osan) syöpiä kutsutaan "saarekesoluiksi" tai "haiman neuroendokriinisiksi kasvaimiksi tai PNETeiksi" ja (2) syöpiksi. eksokriininen haima (osa, joka tuottaa entsyymejä). Saaristosolusyövät ovat harvinaisia ja kasvavat tyypillisesti hitaasti verrattuna eksokriinisiin haimasyöpiin. Saaristosolukasvaimet vapauttavat usein hormoneja verenkiertoon, ja niille on lisäksi tunnusomaista niiden tuottamat hormonit (insuliini, glukagoni, gastriini ja muut hormonit). Eksokriinisen haiman syövät (eksokriiniset syövät) kehittyvät soluista, jotka reunustavat entsyymejä ohutsuoleen kuljettavien kanavien järjestelmää, ja niitä kutsutaan yleisesti haiman adenokarsinoomiksi. Levysoluhaimasyöpä on harvinainen. Haiman adenokarsinooma käsittää suurimman osan kaikista haimasyöpistä, ja se on tämän katsauksen pääaihe.
Eksokriinisen haiman kanavia reunustavat solut jakautuvat nopeammin kuin niitä ympäröivät kudokset. Syistä, joita emme ymmärrä, nämä solut voivat tehdä virheen kopioidessaan DNA:taan jakautuessaan korvatakseen muut kuolevat solut. Tällä tavalla voidaan tehdä epänormaali solu. Kun epänormaali kanavasolu alkaa jakautua säätelemättömällä tavalla, voi muodostua kasvua, joka koostuu epänormaalilta näyttävistä ja toimivista soluista. Epänormaalit muutokset, jotka voidaan tunnistaa mikroskoopilla, kutsutaan "dysplasiaksi". Usein dysplastiset solut voivat kohdata lisää DNA-virheitä ajan myötä ja muuttua entistä epänormaalimmiksi. Kun nämä dysplastiset solut tunkeutuvat sen kanavan seinämien läpi, joista ne tulevat ympäröivään kudokseen, dysplasiasta on tullut syöpä.
Vuonna 2016 julkaistussa tutkimuksessa tutkijat raportoivat geenien analyysistä 456 haiman tiehyen adenokarsinoomassa. Näiden adenokarsinoomien myöhempi ilmentymisanalyysi mahdollisti niiden määrittelyn neljään alatyyppiin. Näitä alatyyppejä ei ole aiemmin havaittu. Alatyyppejä ovat:
Nämä uudet havainnot voivat mahdollistaa tulevien syöpäpotilaiden hoidon tarkemmin alatyypistä riippuen ja toivottavasti tehokkaammin. Immunogeeninen alatyyppi saattaa esimerkiksi mahdollisesti reagoida hoitoon, jossa immuunijärjestelmä suunnitellaan uudelleen hyökkäämään tämäntyyppisiä syöpäsoluja vastaan.
Haimasyöpää ei pidä sekoittaa termiin haimatulehdus. Haimatulehdus määritellään yksinkertaisesti haiman tulehdukseksi, ja se johtuu pääasiassa alkoholin väärinkäytöstä ja/tai sappikivien muodostumisesta (noin 80–90 %). Siitä huolimatta krooninen haimatulehdus liittyy haimasyöpään.
Noin 53 670 haimasyöpätapausta tapahtuu vuosittain Yhdysvalloissa. Useimmat ihmiset, joille kehittyy haimasyöpä, tekevät niin ilman altistavia riskitekijöitä. Ehkä suurin riskitekijä on kuitenkin iän lisääntyminen; yli 60-vuotias asettaa henkilön suuremmalle riskille. Harvoin voi esiintyä familiaalisia tai perinnöllisiä geneettisiä oireyhtymiä, jotka johtuvat perheissä esiintyvistä geneettisistä mutaatioista, jotka asettavat yksilöille suuremman riskin, kuten BRCA-2- ja vähemmässä määrin BRCA-1-geenimutaatiot. Perheen oireyhtymät ovat epätavallisia, mutta on tärkeää kertoa lääkärille, jos jollain muulla perheessä on diagnosoitu syöpä, erityisesti haimasyöpä. Lisäksi tiettyjen käytösten tai tilojen uskotaan lisäävän hieman yksilön riskiä sairastua haimasyöpään. Esimerkiksi afroamerikkalaiset voivat olla suuremmassa vaarassa, samoin kuin henkilöt, joilla on läheisiä perheenjäseniä, joilla on aiemmin diagnosoitu haimasyöpä. Muita käyttäytymismalleja tai sairauksia, jotka voivat vaarantaa ihmisiä, ovat tupakointi, liikalihavuus, istuvat elämäntavat, diabetes, krooninen haimatulehdus (haimatulehdus) ja rasvainen (tai länsimainen) ruokavalio. Aiempi mahaleikkaus voi lisätä riskiä kohtalaisesti, samoin kuin tietyt krooniset infektiot, kuten hepatiitti B ja H. pylori (vatsan limakalvon bakteeri-infektio). Tietyt lääkkeet (sitagliptiini [Januvia], eksenatidi [Byetta], liraglutidi [Victoza] ja metformiini ja sitagliptiini [Janumet]) on yhdistetty haimasyövän kehittymiseen. Tietyt haimakystatyypit voivat altistaa yksilöille haimasyövän kehittymisen. Muutamat tutkijat ehdottavat, että kahvin ja limsan juominen lisää haimasyövän riskiä. Kun haimasyöpä alkaa, se alkaa yleensä soluista, jotka reunustavat haiman kanavia, ja sitä kutsutaan haiman adenokarsinoomaksi. tai haiman eksokriininen syöpä . Huolimatta yllä mainituista riskeistä, useimmilta ihmisiltä, joille kehittyy haimasyöpä, ei löydy tunnistettavaa syytä.
Napsauttamalla "Lähetä" hyväksyn MedicineNetin käyttöehdot ja tietosuojakäytännön. Hyväksyn myös sähköpostien vastaanottamisen MedicineNetiltä ja ymmärrän, että voin kieltäytyä MedicineNet-tilauksista milloin tahansa.
Koska haima sijaitsee syvällä vatsassa selkärangan edessä, haimasyöpä kasvaa usein hiljaa kuukausia ennen kuin se löydetään. Varhaiset syövän oireet ja/tai ensimmäiset merkit voivat puuttua tai olla melko hienovaraisia. Helpommin tunnistettavat oireet kehittyvät, kun kasvain kasvaa tarpeeksi suureksi painaakseen muita lähellä olevia rakenteita, kuten hermoja (joka aiheuttaa yleistyvää kipua ja/tai selkäkipua), suolistossa (joka vaikuttaa ruokahaluun ja aiheuttaa pahoinvointia painonpudotuksen ohella) tai sappitiehyet (joka aiheuttaa keltaisuutta tai ihon keltaisuutta ja voi aiheuttaa ruokahaluttomuutta ja kutinaa). Naisten oireet poikkeavat harvoin miesten oireista. Kun kasvain levittää syöpäsoluja vereen ja imusolmukkeisiin ja metastasoituu, ilmaantuu yleensä lisäoireita, riippuen etäpesäkkeen sijainnista. Usein haimasyövän etäpesäkkeitä ovat maksa, imusolmukkeet ja vatsan limakalvo (kutsutaan vatsakalvoksi; askitesnestettä voi kertyä metastasoituneessa haimasyövässä). Valitettavasti useimmat haimasyövät löydetään sen jälkeen, kun syöpä on kasvanut tai edennyt haiman ulkopuolelle tai metastasoitunut muihin paikkoihin.
Yleensä haimasyövän merkkejä ja oireita voivat tuottaa eksokriiniset tai endokriiniset syöpäsolut. Monet eksokriinisen haimasyövän merkit ja oireet johtuvat haiman läpi kulkevan kanavan tukkeutumisesta maksasta sappia suolistoon kuljettavassa tilassa. Eksokriinisen haimasyövän oireita ovat mm.
Endokriinisten haimasyöpien merkit ja oireet liittyvät usein niiden tuottamiin ylimääräisiin hormoneihin ja sen seurauksena useisiin erilaisiin oireisiin. Tällaiset oireet liittyvät hormoneihin ja ovat seuraavat:
Toimimattomat neuroendokriiniset kasvaimet eivät tuota liikaa hormoneja, mutta voivat kasvaa suuriksi ja levitä haimasta. Oireet voivat tällöin olla kuten mikä tahansa yllä kuvatuista endokriinisistä haimasyövistä.
Suurin osa ihmisistä ei tarvitse seulontaa haimasyövän varalta, ja usein saatavilla olevat testit ovat monimutkaisia, riskialttiita, kalliita tai epäherkkiä syövän alkuvaiheessa. Kelpoisilla on yleensä joukko tekijöitä, jotka lisäävät haimasyövän riskiä, kuten haimakystat, haimasyöpää sairastavat ensimmäisen asteen sukulaiset tai haimasyöpään liittyvät geneettiset oireyhtymät. Useimmat seulontatestit koostuvat CT-skannauksista, ultraäänistä, magneettiresonanssikolangiopankreatografiasta (MRCP), endoskooppisesta retrogradisesta kolangiopankreatografiasta (ERCP) tai endoskooppisesta ultraäänestä. Valitettavasti haimasyövän varhainen havaitseminen on vaikeaa, koska oireita on vähän tai ei ollenkaan.
Useimmat haimasyöpää sairastavat ihmiset menevät ensin peruslääkärin puoleen valittaen epäspesifisistä oireista (katso oireet-osio yllä). Joitakin varoitusmerkkejä ovat kipu, maha-suolikanavan oireet, laihtuminen, väsymys ja lisääntynyt vatsan neste. Nämä valitukset käynnistävät arvioinnin, joka sisältää usein fyysisen tutkimuksen (yleensä normaali), verikokeet, röntgenkuvat ja ultraäänitutkimukset. Jos haimasyöpä on läsnä, todennäköisyys, että ultraääni paljastaa haiman poikkeavuuden, on noin 75%. Jos ongelma havaitaan tai sitä epäillään, arvioinnin seuraavana vaiheena suoritetaan usein tietokonetomografia (CT). Jotkut kliinikot suosivat MRI:tä. Jos haimamassaa nähdään, se herättää epäilyn haimasyövästä ja lääkäri tekee sitten koepalan diagnoosin määrittämiseksi.
Erilaisia strategioita voidaan käyttää epäillyn syövän biopsian suorittamiseen. Usein käytetään maksan neulabiopsiaa vatsan seinämän läpi (perkutaaninen maksabiopsia), jos näyttää siltä, että syöpä on levinnyt maksaan. Jos kasvain pysyy haimassa, tehdään yleensä haiman biopsia suoraan TT:n avulla. Suora biopsia voidaan tehdä myös endoskoopilla, joka laitetaan kurkkuun ja suolistoon. Endoskoopin kärjessä olevan kameran avulla endoskooppi voi viedä endoskooppia eteenpäin suolessa. Endoskoopin kärjessä oleva ultraäänilaite paikantaa haiman biopsia-alueen, ja biopsian neula viedään endoskoopin työkanavan läpi kudoksen saamiseksi epäillystä syövästä. Viime kädessä kudosdiagnoosi on ainoa tapa tehdä diagnoosi varmasti, ja lääkäreiden tiimi työskentelee saadakseen kudosdiagnoosin mahdollisimman helpolla tavalla.
Radiologisten testien lisäksi haimasyöpäepäily voi johtua "kasvainmarkkerin" noususta, verikokeesta, joka voi olla epänormaalin korkea haimasyöpää sairastavilla ihmisillä. Haimasyöpään yleisimmin liittyvä kasvainmerkki on nimeltään CA19-9. Haimasyöpäsolut vapauttavat sitä usein verenkiertoon, ja se voi lisääntyä potilailla, joilla on äskettäin todettu haimasyöpä. Valitettavasti, vaikka CA19-9-testi liittyy syöpään, se ei ole spesifinen haimasyövälle. Muut syövät sekä jotkin hyvänlaatuiset sairaudet voivat aiheuttaa CA 19-9:n kohoamisen. Joskus (noin 20 % ajasta) CA19-9 on normaalilla tasolla veressä vahvistetusta haimasyövän diagnoosista huolimatta, joten kasvainmerkki ei ole täydellinen. Sitä voi kuitenkin olla hyödyllistä seurata sairauden aikana, koska sen nousu ja lasku voivat korreloida syövän kasvun kanssa ja auttaa ohjaamaan asianmukaista hoitoa.
Kun haimasyöpä on diagnosoitu, se on "lavastettu". Haimasyöpä jaetaan neljään vaiheeseen, joista vaihe 1 on varhaisin vaihe (vaihetta 0 ei lasketa) ja vaihe IV on edistynein (metastaattinen sairaus). Seuraavat ovat haimasyövän vaiheet National Cancer Instituten mukaan:
Vaihe 0 :Syöpää löytyy vain haimatiehyiden limakalvosta. Vaihe 0 kutsutaan myös karsinoomaksi in situ.
Vaihe I :Syöpä on muodostunut ja se on vain haimassa.
Vaihe II :Syöpä on voinut levitä tai edetä läheisiin kudoksiin ja elimiin sekä imusolmukkeisiin lähellä haimaa.
Vaihe III :Syöpä on levinnyt tai edennyt suuriin verisuoniin lähellä haimaa ja on voinut levitä läheisiin imusolmukkeisiin.
Vaihe IV :Syöpä voi olla minkä kokoinen tahansa ja se on levinnyt kaukaisiin elimiin, kuten maksaan, keuhkoihin ja peritoneaalionteloon. Se on myös voinut levitä elimiin ja kudoksiin lähellä haimaa tai imusolmukkeisiin. Tätä vaihetta on kutsuttu myös loppuvaiheen haimasyöväksi.
Toisin kuin monet syövät, haimasyöpää sairastavat potilaat ryhmitellään kuitenkin tyypillisesti kolmeen luokkaan:ne, joilla on paikallinen sairaus, ne, joilla on paikallisesti edennyt sairaus, jota ei voida leikata, ja ne, joilla on metastaattinen sairaus. Alkuhoito vaihtelee usein näiden kolmen ryhmän potilaiden osalta.
Potilailla, joilla on vaiheen I ja II syöpä, uskotaan olevan paikallinen tai "resekoitava" syöpä (syöpä, joka voidaan poistaa kokonaan leikkauksella). Potilailla, joilla on vaiheen III syöpä, on "paikallisesti edennyt, ei leikattavissa oleva" tauti. Tässä tilanteessa mahdollisuus parantua on menetetty, mutta paikalliset hoidot, kuten sädehoito, ovat edelleen vaihtoehtoja. Potilaille, joilla on vaiheen IV haimasyöpä, kemoterapiaa suositellaan yleisimmin syöpään liittyvien oireiden hallintaan ja eliniän pidentämiseen. Alla tarkastellaan yleisiä hoitoja haimasyöpien kolmelle ryhmälle (resekoitava, paikallisesti edennyt ei-leikkaussyöpä ja metastaattinen haimasyöpä).
If a pancreatic cancer is found at an early stage (stage I and stage II) and is contained locally within or around the pancreas, surgery may be recommended (resectable pancreatic cancer). Surgery is the only potentially curative treatment for pancreatic cancer. The surgical procedure most commonly performed to remove a pancreatic cancer is a Whipple procedure (pancreatoduodenectomy or pancreaticoduodenectomy). It often comprises removal of a portion of the stomach, the duodenum (the first part of the small intestine), pancreas, a portion of the main bile duct, lymph nodes, and gallbladder. It is important to be evaluated at a hospital with lots of experience performing pancreatic cancer surgery because the operation is a big one, and evidence shows that experienced surgeons better select people who can get through the surgery safely and also better judge who will most likely benefit from the operation. In experienced hands, the mortality from the surgery itself is less than 4%.
After the Whipple surgery, patients typically spend about one week in the hospital recovering from the operation. Complications from the surgery can include blood loss (anemia), leakage from the reconnected intestines or ducts, or slow return of bowel function. Recovery to presurgical health often can take several months.
After patients recover from a Whipple procedure for pancreatic cancer, treatment to reduce the risk of the cancer returning is a standard recommendation. This treatment, referred to as "adjuvant therapy (chemotherapy)," has proven to lower the risk of recurrent cancer. Typically, physicians recommend six months of adjuvant chemotherapy, sometimes with radiation incorporated into the treatment plan.
Some patients with pancreatic cancer experience blockage of bile and/or pancreas ducts and thus may need a surgeon to place a stent to allow drainage through the stent.
Unfortunately, only about 20 people out of 100 diagnosed with pancreatic cancer are found to have a tumor that is amenable to surgical resection or is borderline resectable. The rest have pancreatic tumors that are too locally advanced to completely remove or have metastatic spread at the time of diagnosis. Even among patients whose cancers are amenable to surgery, statistical data suggest that only 20% live 5 years. Most pancreatic cancer patients do not qualify for a pancreas transplant because of their advanced disease; most pancreas transplants are done in patients with diabetes that results from the removal of the endocrine portion of the pancreas and not for pancreatic cancer. Consequently, remission rates are fair to poor.
If a pancreatic cancer is found when it has grown into important local structures but not yet spread to distant sites, this is described as locally advanced, unresectable (inoperable) pancreatic cancer (stage III). The standard of care in the United States for the treatment of locally advanced cancer is a combination of low-dose chemotherapy given simultaneously with radiation treatments to the pancreas and surrounding tissues. Radiation treatments are designed to lower the risk of local growth of the cancer, thereby minimizing the symptoms that local progression causes (back or belly pain, nausea, loss of appetite, intestinal blockage, jaundice). Radiation treatments are typically given Monday through Friday for about five weeks. Chemotherapy given concurrently (at the same time; FOLFOX combination therapy) may improve the effectiveness of the radiation and may lower the risk for cancer spread outside the area where the radiation is delivered. When the radiation is completed and the patient has recovered, more chemotherapy often is recommended. Recently, newer forms of radiation delivery (proton therapy, stereotactic radiosurgery, gamma knife radiation, Nanoknife, CyberKnife radiation) have been utilized in locally advanced pancreatic cancer with varying degrees of success, but these treatments can be more toxic and are, for now, largely experimental; individuals should discuss with their doctors what treatment(s) are best for their condition.
Once a pancreatic cancer has spread beyond the vicinity of the pancreas and involves other organs, it has become a problem through the system. As a result, a systemic treatment is most appropriate and chemotherapy (for example, nab-paclitaxel [Abraxane] in combination with gemcitabine [Gemzar]) is recommended. Chemotherapy travels through the bloodstream and goes anywhere the blood flows and, as such, treats most of the body. It can attack a cancer that has spread through the body wherever it is found. In metastatic pancreatic cancer, chemotherapy is recommended for individuals healthy enough to receive it. It has been proven to both extend the lives of patients with pancreatic cancer and to improve their quality of life. These benefits are documented, but unfortunately the overall benefit from chemotherapy in pancreatic cancer treatment is modest and chemotherapy prolongs life for the average patient by only a few months. Chemotherapy options for patients with pancreatic cancer vary from treatment with a single chemotherapy agent like Tarceva or Onivyde to treatment with as many as two or three chemotherapy agents or immunotherapy agents given together (for example, capecitabine plus ruxolitinib). The aggressiveness of the treatment is determined by the cancer doctor (medical oncologist) and by the overall health and strength of the individual patient.
Side effects of treatment for pancreatic cancer vary depending on the type of treatment. For example, radiation treatment (which is a local treatment) side effects tend to accumulate throughout the course of radiation therapy and include fatigue, nausea, and diarrhea. Chemotherapy side effects depend on the type of chemotherapy given (less aggressive chemotherapy treatments typically cause fewer side effects whereas more aggressive combination regimens are more toxic) and can include fatigue, loss of appetite, change in taste, hair loss (although not usually), and lowering of the immune system with risk for infections (immunosuppression). While these lists of side effects may seem worrisome, radiation doctors (radiation oncologists) and medical oncologists have much better supportive medications than they did in years past to control any nausea, pain, diarrhea, or immunosuppression related to treatment. The risks associated with pancreatic cancer treatment must be weighed against the inevitable and devastating risks associated with uncontrolled pancreatic cancer and, if the treatments control progression of the cancer, most patients feel better on treatment than they otherwise would.
Pancreatic cancer is a difficult disease. Even for surgically resectable (and therefore potentially curable) pancreatic tumors, the risk of cancer recurrence and subsequent death remains high. Consequently, the prognosis of pancreatic cancer usually ranges from fair to poor. Only about 20% of patients undergoing a Whipple procedure for potentially curable pancreatic cancer live five years, with the rest surviving on average less than two years. For patients with incurable (locally advanced unresectable or metastatic) pancreatic cancer, survival is even shorter; typically, it is measured in months. With metastatic disease (stage IV), the average survival is just over six months. The American Cancer Society statistics suggest that for all stages of pancreatic cancer combined, the one-year survival rate is 20% and the mortality rate is 80%, while the five-year survival rate is 6% with a mortality rate of 94%. These rates are mainly based on patients diagnosed between 1985 and 2004 and are representative of those patients according to the American Cancer Society (ACS). These data-based survival rates are what are available currently, but they are only estimates and are not predictive about what may happen to each individual. Currently, the ACS advises patients to discuss their individual situation and prognosis with their treatment team of physicians. Doctors around the world continue to study pancreatic cancer and strive to improve treatments, but progress has been difficult to achieve.
Doctors and researchers all over the world are hard at work developing better treatments for pancreatic cancer. Cooperative cancer research led by centers of excellence in this country and many others continue daily to test new surgical techniques, radiation strategies, chemotherapy agents, and alternative therapies in an effort to improve care. Given the slow progress experienced over the last quarter century, many doctors feel that every eligible patient with pancreatic cancer should be offered enrollment in a research trial. New cytotoxic combinations of drugs are being tried in clinical trials. For example, Folfirinox, a new combination regimen consisting of four different chemicals has shown increased survival times for patients in clinical trials. In addition, patients who received one of two vaccines, GVAX and CRS-207, showed about a doubling of survival time compared to patients that did not receive the vaccine; this vaccine protocol is still undergoing clinical trials. For a complete list of clinical trials in pancreatic cancer treatment, please check online at http://www.cancer.gov.
Complimentary or alternative medicine is of unclear benefit in pancreatic cancer treatment. No specific complimentary or alternative therapy has been proven beneficial, but many adjunctive treatments have been tried. Compounds such as curcumin, the principle ingredient in turmeric, have shown efficacy in nonhuman research and are being tested in clinical trials in pancreatic cancer. Given the modest benefit derived from chemotherapy and radiation in this disease, alternative approaches in the treatment of pancreatic cancer in conjunction with (rather than instead of) standard treatment is warranted.
At this time, there is no known surveillance strategy to reduce the risk of pancreatic cancer for the general population. With only 48,900 new diagnoses a year, screening blood tests or X-rays have never been proven to be cost effective or beneficial. Additionally, doctors do not routinely screen individuals with family members diagnosed with pancreatic cancer aside from the rare instance where a known genetic risk factor is present. Some researchers suggest vitamin D blood levels above 40 ng/ml may reduce the risk of pancreatic cancer.
There are many fine organizations helping to provide support for individuals and families battling pancreatic cancer. Many hospitals provide support networks utilizing the expertise of trained social workers with experience in caring for people with cancer. Additionally, the Pancreatic Cancer Action Network (PANCAN) and the American Cancer Society both provide information and support for people living with pancreatic cancer. Visit their web sites at http://www.pancan.org and http://www.cancer.org. Diet recommendations can be found at ACS Guidelines on Nutrition and Physical Activity for Cancer Prevention.
Again, both PANCAN and the American Cancer Society are excellent resources for additional information regarding pancreatic cancer. The American Society of Clinical Oncology web site (http://www.cancer.net) also boasts a wealth of information for patients, family members, and professionals interesting in learning more about this disease. November is Pancreatic Awareness Month with the goal to make pancreas care an everyday event (http://daysofyear.com/pancreatic-cancer-awareness-month/).
 Suora totuus online-terveysliiketoiminnan rakentamisesta
En koskaan uskonut, että pieni SCD Lifestyle -blogimme antaisi minun lopettaa työni… Mutta eräänä päivänä, neljäntenä vuonna tätä tehdessämme, lopetin insinöörityöni. Kävelin pois. Otin harppauksen.
Suora totuus online-terveysliiketoiminnan rakentamisesta
En koskaan uskonut, että pieni SCD Lifestyle -blogimme antaisi minun lopettaa työni… Mutta eräänä päivänä, neljäntenä vuonna tätä tehdessämme, lopetin insinöörityöni. Kävelin pois. Otin harppauksen.
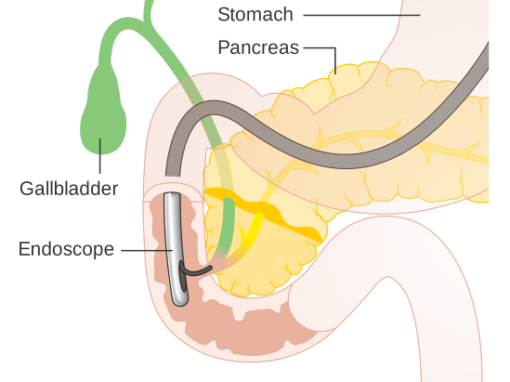 Mikä on ERCP?
Endoskooppinen retrogradinen kolangiopankreatografia ( ERCP) on endoskooppinen toimenpide, jossa sivulta katsova ylempi endoskooppi ohjataan ohutsuolen (pohjukaissuolen) ensimmäiseen pisteeseen, jollo
Mikä on ERCP?
Endoskooppinen retrogradinen kolangiopankreatografia ( ERCP) on endoskooppinen toimenpide, jossa sivulta katsova ylempi endoskooppi ohjataan ohutsuolen (pohjukaissuolen) ensimmäiseen pisteeseen, jollo
 Mitä tietää mahasyövän etäterveydestä
Telehealth – tapa vastaanottaa terveydenhuoltopalveluita etänä erilaisten viestintätekniikoiden avulla – mahdollistaa hoidon toimittamisen ilman henkilökohtaista vuorovaikutusta. Etäterveyskäynnit ova
Mitä tietää mahasyövän etäterveydestä
Telehealth – tapa vastaanottaa terveydenhuoltopalveluita etänä erilaisten viestintätekniikoiden avulla – mahdollistaa hoidon toimittamisen ilman henkilökohtaista vuorovaikutusta. Etäterveyskäynnit ova