ПОНЕДЕЛЬНИК, 19 декабря 2016 г. (HealthDay News). Противораковый препарат Rubraca (рукапариб) получил одобрение Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США в ускоренном порядке для лечения распространенного рака яичников.
Одобрение ограничено случаями, когда рак вызван специфическими генными мутациями, известными как "вредные BRCA".
Гены BRCA обычно восстанавливают поврежденную ДНК и предназначены для предотвращения роста опухоли, сообщило агентство в понедельник в пресс-релизе. Но мутации в этих генах могут привести к раку.
Рубрака предназначена для ингибирования определенного фермента, вырабатываемого поврежденным геном BRCA.
Согласно прогнозам Национального института рака США, на которые ссылается FDA, в этом году у более чем 22 000 женщин будет диагностирован рак яичников, и более 14 000 из них умрут от этого заболевания.
FDA одновременно одобрило диагностический экран FoundationFocus CDxBRCA. По данным FDA, этот скрининг выявляет наличие вредных мутаций BRCA в опухолях женщин с раком яичников.
Препарат Rubraca оценивали в клинических исследованиях с участием 106 женщин с распространенным раком яичников с мутацией BRCA. По данным агентства, у 54% участников, получавших Rubraca, наблюдалось полное или частичное уменьшение опухолей, продолжавшееся в среднем 9,2 месяца.
Наиболее распространенными побочными эффектами препарата были тошнота, утомляемость, рвота, анемия, боль в животе, необычные вкусовые ощущения и потеря аппетита. FDA предупредило, что препарат также связан с проблемами костного мозга, острым миелоидным лейкозом и вредом для развивающегося плода.
Rubraca продается компанией Clovis Oncology из Боулдера, штат Колорадо.
-- Скотт Робертс

Авторское право © HealthDay, 2016. Все права защищены.
 Вальпроевая кислота для профилактики мигрени
Вальпроевая кислота для профилактики мигрени
 Преддиабет
Преддиабет
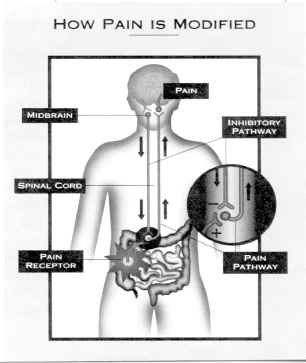 Центрально опосредованный абдоминальный болевой синдром
Центрально опосредованный абдоминальный болевой синдром
 Как работает трансъюгулярный внутрипеченочный портосистемный шунт (TIPS)?
Как работает трансъюгулярный внутрипеченочный портосистемный шунт (TIPS)?
 синдром Золлингера-Эллисона
синдром Золлингера-Эллисона
 Бактериальный профиль кишечника может предсказать повреждение кишечника после лучевой терапии
Бактериальный профиль кишечника может предсказать повреждение кишечника после лучевой терапии
 Микробиота кишечника помогает регулировать кровяное давление и пищеварение
Могут ли пробиотики вызывать высокое кровяное давление? Пришло время узнать о роли кишечных бактерий и пробиотиков в здоровье сердца. Что такое пробиотики? Микробиом и здоровье сердца Кишечные бактер
Микробиота кишечника помогает регулировать кровяное давление и пищеварение
Могут ли пробиотики вызывать высокое кровяное давление? Пришло время узнать о роли кишечных бактерий и пробиотиков в здоровье сердца. Что такое пробиотики? Микробиом и здоровье сердца Кишечные бактер
 Поможет ли вылечить геморрой?
Что такое геморрой? Геморрой очень распространен и появляется, когда вены под слизистой оболочкой прямой кишки и ануса набухают и выпячиваются. Да, вы можете загнать геморрой обратно. Геморрой оче
Поможет ли вылечить геморрой?
Что такое геморрой? Геморрой очень распространен и появляется, когда вены под слизистой оболочкой прямой кишки и ануса набухают и выпячиваются. Да, вы можете загнать геморрой обратно. Геморрой оче
 Пластик, который сейчас обычно встречается в стуле человека
Ежегодно в океаны попадает около восьми миллиардов метрических тонн пластика. Это огромное количество пластика либо смывается на берег, либо распадается на крошечные кусочки диаметром менее 5 миллимет
Пластик, который сейчас обычно встречается в стуле человека
Ежегодно в океаны попадает около восьми миллиардов метрических тонн пластика. Это огромное количество пластика либо смывается на берег, либо распадается на крошечные кусочки диаметром менее 5 миллимет