 Bij mensen met ernstigere GERD kan voedsel uit de maag in de slokdarm of mond terugvloeien, vooral wanneer activiteiten de druk verhogen in de buik, bijvoorbeeld bij hoesten en buigen.
Bij mensen met ernstigere GERD kan voedsel uit de maag in de slokdarm of mond terugvloeien, vooral wanneer activiteiten de druk verhogen in de buik, bijvoorbeeld bij hoesten en buigen.
Slikgerelateerde symptomen van dysfagie
Het meest voorkomende sliksymptoom van dysfagie is het gevoel dat ingeslikt voedsel blijft plakken, hetzij in de onderhals of op de borst.
Bij neurologische problemen kan het moeilijk zijn om te slikken omdat voedsel niet door de tong in de keel kan worden gestuwd.
Oudere personen met een kunstgebit kunnen hun voedsel niet goed kauwen en daardoor grote stukken vast voedsel doorslikken die vast komen te zitten.
Dysfagie is de medische term voor het symptoom van moeite met slikken, afgeleid van de Latijnse en Griekse woorden die moeite met eten betekenen.
Slikken is een complexe handeling.
Gezien de complexiteit ervan, is het geen wonder dat slikken, beginnend met de samentrekking van de bovenste keelholte, is 'geautomatiseerd', wat betekent dat er geen gedachte meer nodig is om te slikken als het slikken eenmaal is begonnen. Het slikken wordt gecontroleerd door automatische reflexen waarbij zenuwen in de keelholte en de slokdarm betrokken zijn, evenals een slikcentrum in de hersenen dat door zenuwen met de keelholte en de slokdarm is verbonden. (Een reflex is een mechanisme dat wordt gebruikt om veel organen aan te sturen. Reflexen vereisen zenuwen in een orgaan zoals de slokdarm om te voelen wat er in dat orgaan gebeurt en om de informatie naar andere zenuwen in de wand van het orgaan of buiten het orgaan te sturen De informatie wordt in deze andere zenuwen verwerkt en passende reacties op omstandigheden in het orgaan worden bepaald. Vervolgens sturen weer andere zenuwen berichten van de verwerkende zenuwen terug naar het orgaan om de functie van het orgaan te regelen, bijvoorbeeld de samentrekking van de spieren van het orgaan. Bij het slikken vindt de verwerking van reflexen voornamelijk plaats in de zenuwen in de wand van de keelholte en de slokdarm, evenals in de hersenen.)
De complexiteit van het slikken verklaart ook waarom er zoveel oorzaken zijn van dysfagie. Er kunnen problemen optreden met:
De problemen kunnen liggen in de keelholte of de slokdarm, bijvoorbeeld bij de fysieke vernauwing van de keelholte of de slokdarm. Dysfagie kan ook te wijten zijn aan ziekten van de spieren of de zenuwen die de spieren van de keelholte en de slokdarm aansturen, of schade aan het slikcentrum in de hersenen. Ten slotte bevatten de keelholte en het bovenste derde deel van de slokdarm spieren die hetzelfde zijn als de spieren die we vrijwillig gebruiken (zoals onze armspieren), skeletspieren genoemd. Het onderste tweederde deel van de slokdarm bestaat uit een ander type spier dat bekend staat als gladde spieren. Ziekten die voornamelijk de skeletspieren of gladde spieren in het lichaam aantasten, kunnen dus de keelholte en de slokdarm aantasten, wat extra mogelijkheden toevoegt aan de oorzaken van dysfagie.
Er zijn twee symptomen die vaak worden gezien als problemen met slikken (dysfagie) die dat waarschijnlijk niet zijn. Deze symptomen zijn odynofagie en globusgevoel.
Odynofagie betekent pijnlijk slikken. Soms is het voor individuen niet gemakkelijk om onderscheid te maken tussen odynofagie en dysfagie. Voedsel dat bijvoorbeeld in de slokdarm blijft plakken, is vaak pijnlijk. Is dit dysfagie of odynofagie of beide? Technisch gezien is het dysfagie, maar individuen kunnen het omschrijven als pijnlijk slikken (d.w.z. odynofagie). Bovendien kunnen patiënten met gastro-oesofageale refluxziekte (GERD) dysfagie beschrijven terwijl ze in werkelijkheid odynofagie hebben. De pijn die ze voelen na het slikken verdwijnt wanneer de ontsteking van GERD wordt behandeld en verdwijnt en is vermoedelijk te wijten aan pijn veroorzaakt door voedsel dat door het ontstoken deel van de slokdarm gaat.
Odynofagie kan ook optreden bij andere aandoeningen die verband houden met ontsteking van de slokdarm, bijvoorbeeld virale en schimmelinfecties. Het is belangrijk om onderscheid te maken tussen dysfagie en odynofagie, omdat de oorzaken van elk heel verschillend kunnen zijn.
Een globusgevoel verwijst naar een gevoel dat er een brok in de keel is. De klont kan continu aanwezig zijn of alleen bij het slikken. De oorzaken van een globusgevoel zijn divers en vaak wordt er geen oorzaak gevonden. Globusgevoel is op verschillende manieren toegeschreven aan een abnormale functie van de zenuwen of spieren van de keelholte en GERD. Het globusgevoel wordt meestal duidelijk beschreven door individuen en veroorzaakt zelden verwarring met echte dysfagie.
Zoals eerder besproken, zijn er veel oorzaken van dysfagie. Voor het gemak kunnen oorzaken van dysfagie in twee groepen worden ingedeeld;
Oorzaken kunnen ook verschillend in verschillende groepen worden ingedeeld.
Bij neurologische problemen kan het moeilijk zijn om te slikken omdat de bolus niet door de tong in de keel kan worden gestuwd. Oudere personen met een kunstgebit kunnen hun voedsel niet goed kauwen en daardoor grote stukken vast voedsel doorslikken die vast komen te zitten. (Toch gebeurt dit meestal wanneer er een bijkomend probleem is in de keelholte of slokdarm, zoals een vernauwing.)
Het meest voorkomende sliksymptoom van dysfagie is echter het gevoel dat ingeslikt voedsel blijft plakken, hetzij in de onderhals of op de borst. Als voedsel in de keel blijft plakken, kan er sprake zijn van hoesten of stikken met slijm van het ingeslikte voedsel. Als voedsel in het strottenhoofd komt, zal ernstiger hoesten en verstikking worden uitgelokt. Als het zachte gehemelte niet werkt en de neusholtes niet goed afsluit, kan voedsel - met name vloeistoffen - met het slikken in de neus terugvloeien. Soms kan voedsel direct na het doorslikken weer in de mond komen.
Voedsel dat in de slokdarm blijft plakken, kan daar voor langere tijd blijven. Dit kan het gevoel geven dat de borstkas vol raakt naarmate er meer voedsel wordt gegeten, wat ertoe kan leiden dat een persoon moet stoppen met eten en mogelijk vloeistoffen moet drinken in een poging het voedsel weg te spoelen. Het onvermogen om grotere hoeveelheden voedsel te eten kan leiden tot gewichtsverlies. Bovendien kan het voedsel dat in de slokdarm achterblijft 's nachts uit de slokdarm terugvloeien terwijl het individu slaapt, en het individu kan midden in de nacht worden gewekt door hoesten of stikken die wordt veroorzaakt door het oprispingen van voedsel. Als voedsel het strottenhoofd, de luchtpijp en/of de longen binnendringt, kan dit astma-episodes veroorzaken en zelfs leiden tot infectie van de longen en aspiratiepneumonie. Terugkerende longontsteking kan leiden tot ernstig, permanent en progressief longletsel. Af en toe worden mensen niet uit hun slaap gewekt door het oprispingen van voedsel, maar worden ze 's ochtends wakker om uitgebraakt voedsel op hun kussen te vinden.
Personen die voedsel in hun slokdarm houden, kunnen klagen over symptomen van brandend maagzuur (GERD). Hun symptomen kunnen inderdaad te wijten zijn aan GERD, maar zijn waarschijnlijker te wijten aan het achtergehouden voedsel en reageren niet goed op de behandeling van GERD.
Met de spastische motiliteitsstoornissen kunnen individuen episodes van pijn op de borst ontwikkelen die zo ernstig kunnen zijn dat ze een hartaanval nabootsen en ervoor zorgen dat de individuen naar de eerste hulp gaan. De oorzaak van de pijn bij de spastische slokdarmaandoeningen is onduidelijk, hoewel de leidende theorie is dat het te wijten is aan spasmen van de slokdarmspieren.
Odynofagie en globusgevoel. De occasionele moeilijkheid om dysfagie van odynofagie te onderscheiden is al besproken, evenals het verschil tussen dysfagie en een globusgevoel.
Tracheo-oesofageale fistel. Een aandoening die kan worden verward met dysfagie is een tracheo-oesofageale fistel. Een tracheo-oesofageale fistel is een open communicatie tussen de slokdarm en de luchtpijp die vaak ontstaat als gevolg van kanker van de slokdarm, maar die ook kan optreden als een aangeboren (aangeboren) geboorteafwijking. Doorgeslikt voedsel kan hoesten veroorzaken die het hoesten nabootst als gevolg van disfunctie van de spieren van de keelholte waardoor voedsel het strottenhoofd kan binnendringen; in het geval van een fistel is het hoesten echter het gevolg van de passage van voedsel uit de slokdarm door de fistel en in de luchtpijp.
Ruminatiesyndroom. Ruminatiesyndroom is een syndroom waarbij voedsel moeiteloos terug in de mond sijpelt nadat een maaltijd is voltooid. Het komt meestal voor bij jongere vrouwen en kan mogelijk worden verward met dysfagie. Er is echter geen gevoel dat voedsel blijft plakken na het doorslikken.
Gastro-oesofageale refluxziekte (GERD). Mensen met ernstigere GERD kunnen voedsel uit de maag in de slokdarm of mond laten terugvloeien, vooral wanneer activiteiten de druk in de buik verhogen, bijvoorbeeld bij hoesten en buigen. Regurgitatie kan ook 's nachts optreden terwijl personen met GERD slapen, zoals bij mensen met slikstoornissen die voedsel in hun slokdarm hebben.
Hartziekte. De spastische motiliteitsstoornissen die dysfagie veroorzaken, kunnen gepaard gaan met spontane pijn op de borst, dat wil zeggen pijn op de borst die niet gepaard gaat met slikken. Ondanks de aanwezigheid van dysfagie, moet altijd worden aangenomen dat spontane pijn op de borst het gevolg is van een hartaandoening totdat hartaandoeningen als oorzaak van de pijn op de borst zijn uitgesloten. Daarom is het belangrijk om zorgvuldig te testen op hartaandoeningen voordat de slokdarm wordt beschouwd als de oorzaak van pijn op de borst wanneer een patiënt met dysfagie klaagt over episodes van spontane pijn op de borst.
De geschiedenis van een persoon met dysfagie geeft vaak belangrijke aanwijzingen voor de onderliggende oorzaak van de dysfagie.
De aard van het symptoom of de symptomen geeft de belangrijkste aanwijzingen voor de oorzaak van dysfagie. Slikken dat moeilijk te starten is of dat leidt tot oprispingen van de neus, hoesten of verstikking, is hoogstwaarschijnlijk te wijten aan een oraal of faryngeaal probleem. Slikken waarbij voedsel in de borstkas (slokdarm) blijft steken, is hoogstwaarschijnlijk te wijten aan een slokdarmprobleem.
Dysfagie die snel vordert gedurende weken of een paar maanden, suggereert een kwaadaardige tumor. Dysfagie voor vast voedsel alleen suggereert een fysieke belemmering van de doorgang van voedsel, terwijl dysfagie voor zowel vast als vloeibaar voedsel waarschijnlijker wordt veroorzaakt door een ziekte van de gladde spieren van de slokdarm. Intermitterende symptomen worden ook eerder veroorzaakt door ziekten van gladde spieren dan door obstructie van de slokdarm, aangezien disfunctie van de spier vaak intermitterend is.
Reeds bestaande ziekten bieden ook aanwijzingen. Degenen met ziekten van de skeletspier (bijvoorbeeld polymyositis), de hersenen (meestal beroerte) of het zenuwstelsel hebben meer kans op dysfagie op basis van disfunctie van de orofaryngeale spieren en zenuwen. Mensen met collageen-vaatziekten, bijvoorbeeld sclerodermie, hebben meer kans op problemen met de slokdarmspieren, vooral ineffectieve peristaltiek.
Patiënten met een voorgeschiedenis van GERD hebben meer kans op slokdarmvernauwingen als oorzaak van hun dysfagie, hoewel ongeveer 20% van de patiënten met stricturen minimale of geen symptomen van GORZ hebben vóór het begin van dysfagie. Er wordt aangenomen dat reflux die 's nachts optreedt, schadelijker is voor de slokdarm. Er is ook een hoger risico op slokdarmkanker bij personen met langdurige GERD.
Gewichtsverlies kan een teken zijn van ernstige dysfagie of een kwaadaardige tumor. Vaker dan afvallen, beschrijven mensen een verandering in hun eetpatroon - kleinere happen, extra kauwen - die maaltijden verlengt, zodat ze de laatste aan tafel zijn die klaar is met eten. Dit laatste patroon, indien aanwezig gedurende een langere periode, suggereert een niet-kwaadaardige, relatief stabiele of langzaam progressieve oorzaak voor de dysfagie. Afleveringen van pijn op de borst die niet te wijten zijn aan een hartaandoening, duiden op spieraandoeningen van de slokdarm. Geboorte en verblijf in Midden- of Zuid-Amerika wordt in verband gebracht met de ziekte van Chagas.
Het lichamelijk onderzoek is van beperkte waarde bij het suggereren van oorzaken voor dysfagie. Afwijkingen van het neurologisch onderzoek wijzen op neurologische of spierziekten. Door een individueel slikken te observeren, kan men bepalen of het moeilijk is om te slikken, een teken van een neurologische aandoening. Tumoren in de nek wijzen op de mogelijkheid van compressie van de keelholte. Een luchtpijp die niet met de hand heen en weer kan worden bewogen, suggereert een tumor lager in de borstkas die de luchtpijp en mogelijk de slokdarm heeft ingesloten. Het waarnemen van atrofie (verminderde grootte) of fasciculaties van de tong (fijne trillingen) suggereert ook ziekten van het zenuwstelsel of de skeletspier.
Endoskopie. Endoscopie omvat het inbrengen van een lange (één meter), flexibele buis met een lamp en een camera aan het uiteinde door de mond, keelholte, slokdarm en in de maag. Het slijmvlies van de keelholte en de slokdarm kan visueel worden beoordeeld en er kunnen biopsieën (kleine stukjes weefsel) worden verkregen voor onderzoek onder de microscoop of voor bacteriële of virale culturen.
Endoscopie is een uitstekend middel om tumoren, stricturen en Schatzki-ringen te diagnosticeren, evenals infecties van de slokdarm. Het is ook erg goed voor het diagnosticeren van divertikels van de middelste en onderste slokdarm, maar slecht voor het diagnosticeren van divertikels in de bovenste slokdarm (Zenker's diverticulum).
Het is mogelijk om afwijkingen van de slokdarmspiercontractie waar te nemen, maar slokdarmmanometrie is een test die veel beter geschikt is om de functie van de slokdarmspieren te evalueren. Resistance passing the endoscope through the lower esophageal sphincter combined with a lack of esophageal contractions is a fairly reliable sign of achalasia or Chagas disease (due to the inability of the lower esophageal sphincter to relax), but it is important when there is resistance to exclude the presence of a stricture or cancer which also can cause resistance. Finally, there is a characteristic appearance of the esophageal lining when infiltrated with eosinophils that strongly suggests the presence of eosinophilic esophagitis.
X-rays. There are two different types of X-rays that can be done to diagnose the cause of dysphagia. The barium swallow or esophagram is the simplest type. For the barium swallow, mouthfuls of barium are swallowed, and X-ray films are taken of the esophagus at several points in time while the bolus of barium traverses the esophagus. The barium swallow is excellent for diagnosing moderate-to-severe external compression, tumors, and strictures of the esophagus. Occasionally, however, Schatzki's rings can be missed.
Another type of X-ray study that can be done to evaluate swallowing is the video esophagram or video swallow, sometimes called a video-fluoroscopic swallowing study. For the video swallow, instead of several static X-ray images of the bolus traversing the esophagus, a video X-ray is taken. The video study can be reviewed frame by frame and is able to show much more than the barium swallow. This usually is not important for diagnosing tumors or strictures, which are well seen on barium swallow, but it is more effective for suggesting problems with the contraction of the muscles of the esophagus and pharynx (though esophageal manometry, discussed later, is still better for studying contraction), milder external compression of the esophagus, and Schatzki's rings. The video study can be extended to include the pharynx where it is the best method for demonstrating osteophytes, cricopharyngeal bars, and Zenker's diverticuli. A modified barium swallow is a version of the test evaluating the oropharyngeal phases of swallowing. A speech pathologist is usually involved with the evaluation to determine subtle sequence and phase abnormalities.
The video swallow also is excellent for diagnosing penetration of barium (the equivalent of food) into the larynx and trachea due to neurological and muscular problems of the pharynx that may be causing coughing or choking after swallowing food.
Esophageal manometry. Esophageal manometry, also known as esophageal motility testing, is a means to evaluate the function of pharyngeal and esophageal muscles. For manometry, a thin, flexible catheter is passed through the nose and pharynx and into the esophagus. The catheter is able to sense pressure at multiple locations along its length in both the pharynx and the esophagus. When the pharyngeal and esophageal muscles contract, they generate a pressure on the catheter which is sensed, measured and recorded from each location. The magnitude of the pressure at each pressure-sensing location and the timing of the increases in pressure at each location in relation to other locations give an accurate picture of how the muscles of the pharynx and esophagus are contracting.
The value of manometry is in diagnosing and differentiating among diseases of the muscle or the nerves controlling the muscles that result in muscle dysfunction of the pharynx and esophagus. Thus, it is useful for diagnosing the swallowing dysfunction caused by diseases of the brain, skeletal muscle of the pharynx, and smooth muscle of the esophagus.
Esophageal impedence. Esophageal impedence testing utilizes catheters similar to those used for esophageal manometry. Impedence testing, however, senses the flow of the bolus through the esophagus. Thus, it is possible to determine how well the bolus is traversing the esophagus and correlate the movement with concomitantly recorded esophageal pressures determined by manometry. (It also can be used to sense reflux of stomach contents into the esophagus among patients with GERD.) Multiple sites along the length of the esophagus can be tested to assess the movement of the bolus and presence of reflux, including how high up it extends.
Esophageal acid testing. Esophageal acid testing is not a test that directly diagnoses diseases of the esophagus. Rather, it is a method for determining whether or not there is reflux of acid from the stomach into the esophagus, a cause of the most common esophageal problem leading to dysphagia, esophageal stricture. For acid testing, a thin catheter is inserted through the nose, down the throat, and into the esophagus. At the tip of the catheter and placed just above the junction of the esophagus with the stomach is an acid-sensing probe. The catheter coming out of the nose passes back over the ear and down to the waist where it is attached to a recorder. Each time acid refluxes (regurgitates) from the stomach and into the esophagus it hits the probe, and the reflux of acid is recorded by the recorder. At the end of a prolonged period, usually 24 hours, the catheter is removed and the information from the recorder is downloaded into a computer for analysis. Most people have a small amount of reflux of acid, but individuals with GERD have more. Thus, acid testing can determine if GERD is likely to be the cause of the esophageal problem such as a stricture, as well as if treatment of GERD is adequate by showing the amount of acid that refluxes during treatment is normal.
An alternative method of esophageal acid testing uses a small capsule containing an acid-sensing probe that is attached to the esophageal lining just above the junction of the esophagus with the stomach. The capsule wirelessly transmits the presence of episodes of acid regurgitation to a receiver carried on the chest. The capsule records for two or three days and later is shed into the esophagus and passes out of the body in the stool.
Other tests The diagnosis of muscular dystrophies and metabolic myopathies usually involves a combination of tests including blood tests that can suggest muscle injury, electromyograms to determine if nerves and muscles are working normally, biopsies of muscles, and genetic testing.
The treatment of dysphagia varies and depends on the cause of the dysphagia. One option for supporting patients either transiently or long-term until the cause of the dysphagia resolves is a feeding tube. The tube for feeding may be passed nasally into the stomach or through the abdominal wall into the stomach or small intestine. Once oral feeding resumes, the tube can be removed.
Treatment for obstruction of the pharynx or esophagus requires removal of the obstruction.
Tumors usually are removed surgically although occasionally they can be removed endoscopically, totally or partially. Radiation therapy and chemotherapy also may be used particularly for malignant tumors of the pharynx and its surrounding tissues. If malignant tumors of the esophagus cannot be easily removed or the tumor has spread and survival will be limited, swallowing can be improved by placing stents within the esophagus across the area of obstruction. Occasionally, obstructing tumors can be dilated the same way as strictures. (See below.)
Strictures and Schatzki's rings usually are treated with endoscopic dilation, a procedure in which the narrowed area is stretched either by a long, semi-rigid tube passed through the mouth or a balloon that is blown up inside the esophagus.
The most common infiltrating disease causing dysphagia is eosinophilic esophagitis which usually is successfully treated with swallowed corticosteroids. The role of food allergy as a cause of eosinophilic esophagitis is debated; however, there are reports of using elimination diets to identify specific foods that are associated with allergy. Elimination of these foods has been reported to prevent or reverse the infiltration of the esophagus with eosinophils, particularly in children.
Diverticuli of the pharynx and esophagus usually are treated surgically by excising them. Occasionally they can be treated endoscopically. Cricopharyngeal bars are treated surgically by cutting the thickened muscle. Osteophytes also can be removed surgically.
Congenital abnormalities of the esophagus usually are treated surgically soon after birth so that oral feeding can resume.
As previously discussed, strokes are the most common disease of the brain to cause dysphagia. Dysphagia usually is at its worst immediately after the stroke, and often the dysphagia improves with time and even may disappear. If it does not disappear, swallowing is evaluated, usually with a video swallowing study. The exact abnormality of function can be defined and different maneuvers can be performed to see if they can counter the effects of the dysfunction. For example, in some patients it is possible to prevent aspiration of food by turning the head to the side when swallowing or by drinking thickened liquids (since thin liquids is the food most likely to be aspirated).
Tumors of the brain, in some cases, can be removed surgically; however, it is unlikely that surgery will reverse the dysphagia. Parkinson's disease and multiple sclerosis can be treated with drugs and may be useful in patients with dysphagia.
Achalasia is treated like a stricture of the esophagus with dilation, usually with a balloon. A second option is surgical treatment in which the muscle of the lower esophageal sphincter is cut (a myotomy) in order to reduce the pressure and obstruction caused by the non-relaxing sphincter. Drugs that relax the sphincter usually have little or a transient effect and are useful only when achalasia is mild.
An option for individuals who are at high risk for surgery or balloon dilation is injection of botulinin toxin into the sphincter. The toxin paralyzes the muscle of the sphincter and causes the pressure within the sphincter to decrease. The effects of botulinin toxin are transient, however, and repeated injections usually are necessary. It is best to treat achalasia early before the obstruction causes the esophagus to enlarge (dilate) which can lead to additional problems such as food collecting above the sphincter with regurgitation and aspiration.
In other spastic motility disorders, several drugs may be tried, including anti-cholinergic medications, peppermint, nitroglycerin, and calcium channel blockers, but the effectiveness of these drugs is not clear and studies with them are nonexistent or limited.
For patients with severe and uncontrollable symptoms of pain and/or dysphagia, a surgical procedure called a long myotomy occasionally is performed. A long myotomy is similar to the surgical treatment for achalasia but the cut in the muscle is extended up along the body of the esophagus for a variable distance in an attempt to reduce pressures and obstruction to the bolus.
There is no treatment for ineffective peristalsis, and individuals must change their eating habits. Fortunately, ineffective peristalsis infrequently causes severe dysphagia by itself. When moderate or severe dysphagia is associated with ineffective peristalsis it is important to be certain that there is no additional obstruction of the esophagus, for example, by a stricture due to GERD, that is adding to the effects of reduced muscle function and making dysphagia worse than the ineffective peristalsis alone. Most causes of obstruction can be treated.
There are effective drug therapies for polymyositis and myasthenia gravis that should also improve associated dysphagia. Treatment of the muscular dystrophies is primarily directed at preventing deformities of the joints that commonly occur and lead to immobility, but there are no therapies that affect the dysphagia. Corticosteroids and drugs that suppress immunity sometimes are used to treat some of the muscular dystrophies, but their effectiveness has not been demonstrated.
There is no treatment for the metabolic myopathies other than changes in lifestyle and diet.
Diseases that reduce the production of saliva can be treated with artificial saliva or over-the-counter and prescription drugs that stimulate the production of saliva.
There is no treatment for Alzheimer's disease.
With the exception of dysphagia caused by stroke for which there can be marked improvement, dysphagia from other causes is stable or progressive, and the prognosis depends on the underlying cause, its tendency to progress, the availability of therapy, and the response to therapy.
Recent developments in the diagnostic arena are beginning to bring new insights into esophageal function, specifically, high resolution and 3D manometry, and endoscopic ultrasound.
High resolution and 3D manometry
High resolution and 3D manometry are extensions of standard manometry that utilize similar catheters. The difference is that the pressure-sensing locations on the catheters are very close together and ring the catheter. Recording of pressures from so many locations gives an extremely detailed picture of how esophageal muscle is contracting. The primary value of these diagnostic procedures is that they "integrate" the activities of the esophagus so that the overall pattern of swallowing can be recognized, which is particularly important in complex motility disorders. In addition, their added detail allows the recognition of subtle abnormalities and hopefully will be able to help define the clinical importance of subtle abnormalities of muscle contraction associated with lesser degrees of dysphagia.
Endoscopic ultrasonography has been available for many years but has recently been applied to the evaluation of esophageal muscle diseases. Ultrasound uses sound waves to penetrate tissues. The sound waves are reflected by the tissues and structures they encounter, and, when analyzed, the reflections give information about the tissues and structures from which they are reflected. In the esophagus, endoscopic ultrasonography has been used to determine the extent of penetration of tumors into the esophageal wall and the presence of metastases to adjacent lymph nodes. More recently, endoscopic ultrasonography has been used to obtain a detailed look at the muscles of the esophagus. What has been found is that in some disorders, particularly the spastic motility disorders, the muscle of the esophagus is thickened. Moreover, thickening of the muscle sometimes can be recognized only by ultrasonography even when spastic abnormalities are not seen with manometry. The exact role of endoscopic ultrasonography has not yet been determined but is an exciting area for future research.
 Leaky Gut Syndroom is niet alleen eng, maar ook uiterst gevaarlijk voor uw gezondheid
Leaky Gut Syndroom is niet alleen eng, maar ook uiterst gevaarlijk voor uw gezondheid
 Wat Dr. Tom O'Bryan me heeft geleerd over glutengerelateerde aandoeningen
Wat Dr. Tom O'Bryan me heeft geleerd over glutengerelateerde aandoeningen
 Leidt hypertensie altijd tot ernstige COVID-19?
Leidt hypertensie altijd tot ernstige COVID-19?
 Meer rauw rundvlees teruggeroepen vanwege salmonella:USDA
Meer rauw rundvlees teruggeroepen vanwege salmonella:USDA
 Omgaan met het prikkelbare darm syndroom
Omgaan met het prikkelbare darm syndroom
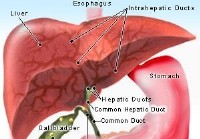 Choledocale cyste
Choledocale cyste
 Wereldgezondheidsdag – Laten we het hebben over SIBO
Het thema van Wereldgezondheidsdag 2017 is depressie, je zou je kunnen afvragen:waarom zouden we het erover hebben? Depressie treft mensen van alle leeftijden en uit alle lagen van de bevolking. Het k
Wereldgezondheidsdag – Laten we het hebben over SIBO
Het thema van Wereldgezondheidsdag 2017 is depressie, je zou je kunnen afvragen:waarom zouden we het erover hebben? Depressie treft mensen van alle leeftijden en uit alle lagen van de bevolking. Het k
 3 genezingscasestudy's:hoe lang duurt het voordat je je beter voelt?
De laatste tijd krijgen we veel vragen in de trant van:Wanneer word ik beter? Ik krijg de hele tijd dit soort e-mails: “Hallo jongens, ik kreeg 5 jaar geleden de diagnose coeliakie en ik begon 2 we
3 genezingscasestudy's:hoe lang duurt het voordat je je beter voelt?
De laatste tijd krijgen we veel vragen in de trant van:Wanneer word ik beter? Ik krijg de hele tijd dit soort e-mails: “Hallo jongens, ik kreeg 5 jaar geleden de diagnose coeliakie en ik begon 2 we
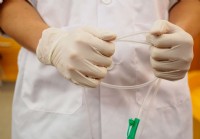 Soorten voedingssondes en hun gebruik
Een plastic voedingssonde is een medisch hulpmiddel dat wordt gebruikt om een persoon te voeden die niet in staat is voedsel of drank veilig via de mond in te nemen. Dit probleem kan te wijten zijn
Soorten voedingssondes en hun gebruik
Een plastic voedingssonde is een medisch hulpmiddel dat wordt gebruikt om een persoon te voeden die niet in staat is voedsel of drank veilig via de mond in te nemen. Dit probleem kan te wijten zijn