variabilità genetica in CYP3A4
e CYP3A5
in primario del fegato, dello stomaco e pazienti con carcinoma colorettale
Abstract
sfondo
enzimi metabolizzano i farmaci svolgere un ruolo nella carcinogenesi chimica attraverso l'attivazione enzimatica di procarcinogeni di metaboliti biologicamente reattivi. Il ruolo dei polimorfismi del gene di diversi enzimi del citocromo P450 a rischio di cancro dell'apparato digerente è stato ampiamente studiato. Tuttavia, gli enzimi metabolizzano i farmaci con la più ampia specificità di substrato, CYP3A4 e CYP3A5, non sono stati analizzati finora. Questo studio si propone di esaminare le associazioni tra CYP3A4 comune e polimorfismi CYP3A5 e rischio di cancro dell'apparato digerente.
Metodi
CYP3A4 e CYP3A5 genotipi sono stati determinati in 574 individui, tra cui 178 pazienti con tumore primario del fegato, 82 pazienti con cancro gastrico, 151 pazienti con . Il cancro colorettale, e 163 individui sani
Risultati
Le frequenze alleliche variante per i pazienti con cancro al fegato, cancro gastrico, il cancro del colon-retto e controlli sani, sono rispettivamente pari a: CYP3A4 * 1B
, 4,8% (95% CI 2,6-7,0), 3,7% (0,8-6,6) 4,3% (2,0-6,6) e 4,3% (2,1-6,5); CYP3A5 * 3
, 91,8% (93,0-97,4), 95,7% (92,6-98,8), 91,7% (88,6-94,8) e il 90,8% (87,7-93,9). L'associazione tra il CYP3A4 * 1B
e CYP3A5 * 3
varianti alleliche non differiva in modo significativo tra i pazienti e controlli. Non ci sono differenze di genotipi, frequenze alleliche, o associazione tra varianti alleliche sono state osservate in materia di sesso, età al momento della diagnosi, sede del tumore o stadio.
Conclusione
polimorfismi comuni dal CYP3A4
e CYP3A5
geni fanno non modificare il rischio di sviluppare tumori digestivi in Europa occidentale.
Sfondo
l'identificazione di geni a bassa penetranza in grado di aumentare il rischio di sviluppare il cancro potrebbe costituire uno strumento importante per l'identificazione degli individui con suscettibilità alterata ereditabile. A questo proposito, il ruolo degli enzimi che metabolizzano i farmaci nel rischio di cancro è stato oggetto di diverse centinaia di studi condotti negli ultimi dieci anni [1]. L'ipotesi principale sottostante il legame tra enzimi che metabolizzano i farmaci e carcinogenesi chimica si basa sull'attivazione enzimatica di procarcinogeni metaboliti biologicamente reattivi. Questi metaboliti reattivi potrebbero interagire con il DNA, causando in tal modo l'espressione genica alterata o funzione, e alla fine carcinogenesi. Il metabolismo primario di una varietà di sostanze cancerogene xenobiotici è mediato principalmente dal citocromo P450 (CYP) enzimi appartenenti alle CYP 1, 2 o 3 famiglie, che insieme costituiscono 25 diversi isoenzimi. Tra questi, i più rilevanti sono CYP1A1, CYP1A2, CYP1B1, CYP2E1, CYP3A4 e CYP3A5 [2-4]. La maggior parte di questi ultimi enzimi sono polimorfici, alleli mutati che causano abolito, ridotta o alterata attività enzimatica. Fino ad oggi, molti studi si sono concentrati sul ruolo dei polimorfismi del gene o attività degli enzimi del CYP1A1 [5-11], CYP1A2 [7, 12-14], CYP1B1 [7, 15] e CYP2E1 [6, 16-19] in digestivo il rischio di cancro. Tuttavia, l'impatto sul rischio di cancro dei polimorfismi degli enzimi CYP con la specificità di substrato più ampio, vale a dire il CYP3A4 e CYP3A5, non è stato analizzato in dettaglio finora.
CYP3A4 e CYP3A5 enzimi sono i principali enzimi per il metabolismo dei farmaci negli adulti [ ,,,0],20], entrambi gli enzimi che costituiscono quasi il 30% del totale dei enzimi CYP espresse nel fegato umano [21]. Dal momento che nessuna quantificazione individualizzato di CYP3A4 e CYP3A5 in vivo
è attualmente possibile a causa di una vasta sovrapposizione specificità di substrato, le attività enzimatiche unite sono designati come CYP3A [22]. Entrambi CYP3A4 e CYP3A5 sono espressi nel fegato, stomaco, colon-retto l'epitelio e nel tessuto del cancro colorettale [23-26], anche se le grandi differenze interindividuali esistono nella espressione di entrambi gli enzimi [27-29]. Oltre un effetto locale delle attività enzimatiche nel metabolismo dei cancerogeni, CYP3A4 metabolismo /5-dipendente nell'intestino prossimale è tale da incidere luminale o la consegna vascolare di molecole cancerogene al fegato o del colon.
Questi fatti prevedono la ipotesi plausibile per l'attivazione procarcinogen dietetico organo-specifica e quindi al rischio di cancro dell'apparato digerente. L'ipotesi che giustifica il presente studio si basa nel fatto che le attività del CYP3A4 e CYP3A5 enzimi sono coinvolti nella attivazione di diversi procarcinogeni, tra cui l'aflatossina B1 stergmatocystin, ammine eterocicliche alimentare derivata, alfa-hydroxytamoxifen e N'-nitrosonornicotine, e che sia enzimi sono espresse ad un livello elevato nel tratto digestivo [27, 30-36]. Così, si può ipotizzare che le differenze genetiche che causano la variabilità nella regolazione, espressione o attività degli enzimi CYP3A sarebbero i fattori rilevanti che modificano suscettibilità al cancro o risultato clinico. Queste associazioni allele-malattia sono già stati indicati per i polimorfismi del gene CYP3A e della prostata, della mammella e il cancro ai polmoni [37-43], anche se con risultati controversi. Anche se CYP3A4 e CYP3A5 giocano un ruolo biologico rilevante nel fegato e nell'intestino dell'epitelio, nessuno studio ha affrontato se il polimorfismo di questi enzimi sono legati al rischio di cancro dell'apparato digerente, probabilmente perché varianti alleliche di geni corrispondenti sono appena stati descritti. A questo proposito, nuovi risultati mostrano che CYP3A5
genotipi che portano a elevata attività enzimatica sono legati al cancro esofageo [44]. Tuttavia l'interazione di CYP3A4
e CYP3A5
polimorfismi del gene e il rischio di sviluppare i principali tumori dell'apparato digerente come il fegato, stomaco o tumori colorettali rimane inesplorato. Questo studio si propone di analizzare tale interazione.
Metodi
Il gruppo di studio consisteva di 411 pazienti non imparentati con tumori digestivi, tra cui 178 pazienti con tumore primario del fegato, 82 pazienti con cancro gastrico e 151 pazienti con tumore del colon-retto, e 163 sani soggetti. Tabella I mostra una sintesi dei gruppi di studio inclusi nello studio. Tutti i partecipanti erano individui bianchi spagnoli, che vivono nelle stesse aree come i pazienti (Madrid e le zone circostanti), e sono stati inclusi nello studio dopo aver dato il consenso informato scritto. Tutti i pazienti con diagnosi di fegato, stomaco o il cancro del colon che hanno partecipato le collaborando Servizi delle ospedali selezionati sono stati inclusi nello studio. La diagnosi è basata su istologica analisi delle biopsie endoscopiche e /o campioni di resezione chirurgica. I dati riguardanti noti malattie digestive precedenti, l'alcol e il consumo di tabacco, test sierici per l'epatite B e virus dell'epatite C e di altre malattie sono stati raccolti. forti bevitori sono stati definiti come individui che bevono più di 50 grammi di alcool per day.Table 1 Sintesi dei gruppi di studio.
NO
MASCHI FEMMINE
età media (SD; GAMMA)
cancro del fegato
178
145
33
66.1 (9.8; 20-88)
cancro gastrico
82
54
28
67,7 (13,9; 31-99)
del colon-retto cancro
151
82
69
66,3 (11,2; 33-89)
soggetti sani
163
111
52
46,3 (12,7; 21-95)
No: numero di soggetti
Tutti i pazienti sono stati invitati a partecipare allo studio, e tutti loro hanno accettato di farlo. I campioni di controllo sono stati ottenuti da studenti di medicina, Università e personale ospedaliero. Un esame medico è stato fatto per identificare i soggetti in buona salute. Oltre il 95% dei soggetti sani richiesti accettato di partecipare allo studio. Il protocollo è stato approvato dal Comitato Etico dell'Ospedale San Carlos Università di Madrid. Un possibile fattore confondente nel presente studio è che, all'interno di un gruppo di studio, la frequenza di individui con un determinato allele variante può cambiare con l'età nel caso in cui la presenza di tali allele sarebbe collegato a gravi malattie. Se un genotipo determinato ha un "effetto protettivo" contro qualsiasi malattia, può essere previsto che in popolazioni composte da soggetti anziani vi è un aumento della frequenza di una tale genotipo protezione. Per questo abbiamo inserito all'interno del gruppo di controllo un sottogruppo selezionato di 41 soggetti sani di età compresa tra 90 e 95 anni [45]. L'analisi del CYP3A4 e CYP3A5
genotipo indica le frequenze per i genotipi che erano identici a quelli dei soggetti sani più giovani. Le frequenze di CYP3A4 * 1B
e CYP3A5 * 3
alleli erano simili per i controlli più giovani e più anziani (vedi sezione Risultati). 4,33% e il 90,7% per i controlli più giovani e 4,18 e 91,2% per i controlli più anziani. Un'altra possibile confonditore è legato al fatto che i soggetti di controllo sono altamente persone, e le differenze nello stile di vita istruiti rispetto ai pazienti oncologici possono essere previsti. Dal momento che i tumori digestivi sono in parte legate alla dieta, questi cambiamenti nello stile di vita possono essere rilevanti. Tuttavia, è opportuno precisare che i pazienti e controlli sono stati intervistati per assicurare che la dieta e lo stile di vita non fanno differiscono tra pazienti e soggetti di controllo
. I campioni di sangue da tutti i partecipanti sono stati conservati a -80 ° C fino al momento dell'analisi. Il DNA genomico è stato preparato da leucociti periferici, e sciolto in sterile 10 mM Tris-HCl, pH 8,0, 1 mM di acido etilendiamminotetraacetico, ad una concentrazione finale di 400 a 600 mg per ml. campioni di DNA sono stati purificati secondo le procedure standard [46] e conservati a 4 ° C in fiale di plastica sterili.
Le analisi per il CYP3A4 * 1B
e CYP3A5 * 3
varianti del gene sono state effettuate mediante amplificazione di restrizione procedure come descritto altrove [47, 48]. Queste varianti alleliche sono stati analizzati al posto di altri, perché queste sono le varianti comuni che causano cambiamenti funzionali. [47, 48] Analisi statistica
Lo studio
. È stato progettato tenendo in considerazione la frequenza attesa di individui che esprimono CYP3A5, cioè aventi almeno un CYP3A5 * 1
allele, che rappresenta il 13% della popolazione caucasica [20]. Il design permette l'identificazione come statisticamente significativo di un aumento di 1,7 volte o una diminuzione di 2 volte nella frequenza per expressers CYP3A5 tra i pazienti affetti da cancro. potenza statistica è stata valutata con un modello genetico per analizzare la frequenza per portatori del gene della malattia con un valore RR = 2.5 (α = 0,05). La potenza calcolata per le associazioni con il rischio di cancro per la presenza del CYP3A4 * 1B
e CYP3A5 * 3
alleli è 90,2% e del 99,3% per il cancro al fegato, il 74,5% e il 93,9% per il cancro gastrico e il 87,7% e 98,8 % per il cancro del colon-retto, rispettivamente. I valori di confronto tra i gruppi sono stati calcolati utilizzando il pacchetto statistico SPSS 11.0.1. (SPSS Inc. Chicago, Illinois, USA). Il Chi-quadro (X 2) test è stato utilizzato per il confronto delle frequenze genotipiche e associazione di CYP3A4 e CYP3A5
varianti alleliche, a meno che le condizioni per l'applicazione di questo test non erano adeguate. In questi casi, il test esatto di Fisher è stato utilizzato per calcolare il valore p
.
Risultati
sette diverse combinazioni di CYP3A4 e CYP3A5
genotipi sono stati identificati nei gruppi di studio. La sintesi dei genotipi è mostrato nella Tabella 2. Il confronto delle frequenze genotipiche tra i pazienti affetti da cancro digestivi e controlli sani indica una frequenza del genotipo simile tra i gruppi di studio. Non sono state osservate differenze statisticamente significative. Le frequenze alleliche variante, come calcolato da genotipi riportati nella Tabella 2, erano quasi identici per tutti i gruppi di studio: CYP3A4 * 1B
era presente con frequenze alleliche di 4,8 (95% CI 2,6-6,9), 3,7 (95% CI 0.8 -6.5) e del 4,3% (95% CI 2,0-6,6) per il fegato, lo stomaco e pazienti con cancro colorettale, rispettivamente, e 4,3% (2,1-6,5) per gli individui sani. Le frequenze alleliche per CYP3A5 * 3
erano 91,9 (IC 95% 89,0-94,7), 95,7 (95% CI 92,6-98,8), e il 91,7% (95% CI 88,6-94,8) per il fegato, lo stomaco e pazienti con cancro colorettale , rispettivamente, e il 90,8% (95% CI 87,7-93,9) tra gli individui sani. sono state osservate differenze statisticamente significative nelle frequenze alleliche, anche se la frequenza del funzionale allele CYP3A5 * 1
tra i pazienti di cancro dello stomaco è inferiore (circa il 50%) rispetto a quelli osservati per il resto dei gruppi di studio (p = 0,051 come rispetto ai soggetti sani) .table 2 CYP3A4
e CYP3A5
genotipi in pazienti affetti da cancro dell'apparato digerente e individui sani di controllo.
CYP3A5
Il cancro del fegato
N (frequenza; 95% CI)
Il cancro dello stomaco
N (frequenza; 95% CI)
Il cancro colorettale
N (frequenza; 95% CI)
soggetti di controllo
N (frequenza; 95% CI)
* 1A /* 1A
* 3 /* 3
144 (80,9; 75,1-86,7)
74 (90,2; 83,8-96,7)
121 (80,1; 73,8-86,5)
134 (82,2; 76,4-88,1)
* 1A /* 1A
* 1 /* 3
17 (9,6; 5,2-13,9)
2 (2.4; 0-5,8)
18 (11,9; 6,8-17,1)
14 (8,6; 4,3-12,9)
* 1A /* 1A
* 1 /* 1
0 0
0
1 (0,6; 0-1,8)
* 1A /1B *
* 3 /* 3
5 (2,8; 0,4-5,2)
1 (1,2; 0-3,6)
5 (3,3; 0,5-6,2)
1 (0,6; 0-1,8)
* 1A /1B *
* 1 /* 3
12 (6,7; 3,1-10,4)
5 (6,1; 0,9-11,3)
6 (4,0; 0,9-7,1)
12 (7,4; 3,3-11,4)
* 1A /1B *
* 1 /* 1
0 0
0
1 (0,6; 0-1,8)
* 1B /1B *
* 1 /* 3
0 0
1 (0,7; 0-2,0)
0
entrambi CYP3A4 CYP3A5
genotipi
ed erano in equilibrio di Hardy-Weinberg tra casi e controlli e le frequenze alleliche variante sono coerenti con quelli riportati per entrambi, europei e americani caucasici [20, 49]. Per quanto riguarda l'associazione tra il CYP3A4 * 1B
e CYP3A5 * 1
alleli, la proporzione di individui che portano entrambe le varianti è molto più elevato per tutti i gruppi di studio (6,7%, 6,1% e 4,6% per il fegato, gastrica o del colon-retto malati di cancro e 7,4% per i soggetti di controllo) del previsto da parte di un'associazione casuale di questi alleli (0,3-0,8% degli individui, come calcolato da frequenze alleliche reali nei gruppi di studio). Questi risultati sono in accordo con un precedente studio che presenti una tale associazione SNP in un'altra popolazione caucasica con una frequenza del 7,1%. [22, 43]. Tra i pazienti, età alla diagnosi era simile in tutti i sottogruppi di pazienti, e questo parametro non è stato legato ai genotipi. Per quanto riguarda i soggetti di controllo, le frequenze per il CYP3A4 * 1B
e CYP3A5 * 3
alleli erano 4,33% e del 90,7% per i controlli più giovani e 4,18 e 91,2% per i controlli più anziani. Sesso, precedente terapia chirurgica o la chemioterapia, abuso di alcool o uso di tabacco non influenzano la distribuzione dei polimorfismi studiati tra i pazienti. Tra i pazienti di cancro al fegato sono state osservate differenze nella distribuzione dei polimorfismi riguardanti infezione cronica da virus dell'epatite B o C. Tra i pazienti di cancro gastrico sono state osservate differenze statisticamente significative per quanto riguarda la sede anatomica del tumore. Al contrario, differenze significative che mostrano un aumento della frequenza di portatori del CYP3A4 * 1A
inclusa CYP3A5 * 3
aplotipo, sono stati osservati tra i pazienti con tipo intestinale cancro gastrico, rispetto ai controlli sani (95,3% contro 82,8 %, p. < 0,05)
pazienti con carcinoma colorettale sono stati divisi in tre sottogruppi in base alla sede anatomica del tumore (non-sigma, sigma e retto), perché le differenze di associazione di altri polimorfismi di droga enzimi che metabolizzano relativi al sito del tumore sono stati riportati [50, 51]. I risultati sono riassunti nella Tabella 3. Un eccesso di pazienti con tumore del colon-sigma non trasportano i combinati genotipo CYP3A4 * 1A /1B *
più CYP3A5 * 3 /* 3
è stata osservata, rispetto ai soggetti sani (Chi -square = 10.3, p = 0,0015, non significativa rispetto multipla analisi) per quanto riguarda allele frequenze, frequenza di CYP3A4 * 1B
allele è stato del 6,6%, 5,9% e l'1% e il CYP3A5 * 3 frequenza era 91,1%, 90,1% e il 93,6% tra i pazienti con colon non-sigma, sigma e del retto, rispettivamente. La percentuale di individui che trasportano CYP3A4 * 1B
e CYP3A5 * 1
alleli è stata del 13,3%, 9,8% e 1,8% per i pazienti con colon non-sigma, sigma e del retto, rispettivamente. Nessuna di queste differenze erano statisticamente significative. Non ci sono differenze per quanto riguarda stadio Dukes 'del tumore sono stati observed.Table 3 CYP3A4
e CYP3A5
genotipi in pazienti affetti da cancro del colon-retto secondo sito del tumore.
CYP3A4
CYP3A5
NON-sigma
N (FREQUENZA; 95% CI)
sigma
N (FREQUENZA; 95% CI)
RETTO
N (FREQUENZA; 95% CI)
* 1A /* 1A
* 3 /* 3
33 (73,3; 60,4-86,3)
40 (78.4; 67,1-89,7)
48 (87,3; 78,5-96,1)
* 1A /* 1A
* 1 /* 3
6 (13.3; 3,4-23,3)
6 (11,8; 2,9-20,6)
6 (10,9; 2,7-19,1)
* 1A /1B *
* 3 /* 3
4 (8,8; 0,6-17,2) *
1 (2,0; 0-5,8)
0
* 1A /1B *
* 1 /* 3
2 (4,4; 0 -10.5) Sims 3 (5,9; 0-12,3)
1 (1,8; 0-5,3)
* 1B /1B *
* 1 /* 3
0
1 (2,0; 0-5,8)
0
* p < 0,0015 rispetto ai soggetti sani
Discussione
metabolismo relative a enzimi CYP differiscono tra organi e tessuti, e di conseguenza si prevede che la specificità del tessuto verso sostanze cancerogeni è legato alla espressione site-specific di enzimi xenobiotici metabolizzano. tumori digestivi sono fortemente correlate a fattori dietetici, e sono stati proposti meccanismi che coinvolgono l'interazione di tali fattori dietetici con polimorfismi determinati enzimi di xenobiotici metabolizzano [10]. La maggior parte dei CYP
geni espressi in nell'intestino umano e nel fegato,
cioè CYP1A1, CYP1A2
, CYP1B1
, CYP3A4 e CYP3A5
[25], sono di grande rilevanza per agente cancerogeno attivazione. Con l'eccezione di CYP3A4
e CYP3A5
, tutti i geni che codificano per questi enzimi sono stati studiati per quanto riguarda il rischio di cancro dell'apparato digerente [1]. Questo studio è stato finalizzato a colmare la lacuna in base alle attuali conoscenze del ruolo putativo di polimorfismi dei due rimanenti importanti enzimi CYP nel tratto digestivo.
L'attività degli enzimi del CYP3A mostra variabilità interindividuale per l'effetto combinato della genetica e l'interazione con i farmaci o sostanze chimiche ambientali [22]. Sia il CYP3A4 e CYP3A5
geni sono polimorfici e diverse varianti alleliche sono stati descritti sia per il CYP3A4
o il gene CYP3A5
(per un elenco aggiornato di alleli, vedere [52]). Solo due varianti alleliche che sono al linkage disequilibrium, vale a dire il CYP3A4 * 1B
e CYP3A5 * 3 Quali sono comuni a tutti diverse etnie e hanno rilevanza funzionale. Altre varianti alleliche sono o estremamente rare o irrilevante per l'attività enzimatica [20], e quindi non sono stati analizzati in questo studio. Evidenze
attuali indicano che il CYP3A4 * 1B
e CYP3A5 * 3 Quali sono polimorfismi funzionali a vivo
. Per quanto riguarda il CYP3A4 * 1B
, sembra modificare la capacità di metabolizzare alcuni substrati del CYP3A, come la chinina [53], anche se non influenza il metabolismo di altri substrati quali midazolam o destrometorfano [49, 54]. CYP3A5 * 3
è il CYP3A5 comune
allele ed è associata con gravemente ridotta attività enzimatica [20].
Il presente studio fornisce nuove scoperte sul ruolo putativo di CYP3A4
e CYP3A5
polimorfismi nel rischio di cancro dell'apparato digerente. Nonostante la presenza di attività degli enzimi del CYP3A nell'intestino e nel fegato, e del ruolo rilevante di tali attività enzimatiche in attivazione cancerogena, i nostri risultati non supportano un importante collegamento tra comuni CYP3A4
e CYP3A5
polimorfismi e cancro dell'apparato digerente rischio. Tuttavia la possibilità di un basso a moderato effetto di questi polimorfismi in particolare nel gruppo più piccolo, cancro allo stomaco, non può essere esclusa. Piccole differenze nelle frequenze per gli individui con il CYP3A4 * 1A
più CYP3A5 * sono stati osservati 3
aplotipi in alcuni sottogruppi di cancro gastrico o del colon, rispetto ai soggetti sani, con valori di p sotto 0.05. Queste differenze non possono essere considerati statisticamente significativi in molteplici-confronto analisi, e non sembrano avere un rilevante impatto clinico. Tuttavia, questo è un argomento che merita studi di indagine e ulteriori dovrebbero concentrarsi sul ruolo di tali polimorfismi nel fegato, cancro gastrico o del colon-retto nelle popolazioni con tassi di incidenza estreme di questi tumori.
Conclusione
Prendendo insieme i risultati riportati in il presente studio, si può concludere che i polimorfismi comuni di enzimi CYP3A con rilevanza funzionale non sono fattori significativi nella carcinogenesi digestivo in Europa occidentale. Questo è in contrasto con altri tumori umani che sono legati a tali polimorfismi. Dal momento che le budella umane sono i tessuti principali che hanno contatti con agenti cancerogeni alimentari, è interessante che il rischio di cancro dell'apparato digerente non viene modificato da fattori genetici che sono legati ad altri tumori umani come quello alla prostata, al seno o ai polmoni, rafforzando così l'ipotesi che l'associazione di CYP3A
polimorfismi con prostata o cancro al seno sono legati a sostanze endogene piuttosto che xenobiotici cancerogeni [37-43].
dichiarazioni
Ringraziamenti
ringraziamo la signora Diana Herrero per l'assistenza tecnica e il Prof. James McCue per l'assistenza nella redazione di lingua. Il sostegno finanziario: Grants FIS 051.056 dal Fondo de Investigación Sanitaria, Instituto de Salud Carlos III (Madrid, Spagna), SAF-2.003-00.967 dal Ministerio de Ciencia y Tecnología, Madrid, Spagna e concedere SCSS0414 dalla Junta de Extremadura, Consejería de Sanidad y consumo, Merida (Spagna).
concorrenti interessi
L'autore (s) dichiarano di non avere interessi in gioco.
Other Languages
- fr:La variabilité génétique dans le CYP3A4 et CYP3A5in primaire du foie, de l'estomac et les patients atteints de cancer colorectal
- de:Genetische Variabilität in CYP3A4 und CYP3A5in primären Leber, Magen-und Darmkrebs-Patienten
- es:La variabilidad genética de CYP3A4 y de hígado primario CYP3A5in, cáncer gástrico y colorrectal patients
- nl:Genetische variatie in CYP3A4 en CYP3A5in primaire lever-, maag- en darmkanker patients
- da:Genetisk variation i CYP3A4 og CYP3A5in primære lever, mave og kolorektal cancer patienter
- sv:Genetisk variation i CYP3A4 och CYP3A5in primär lever, mag- och kolorektal cancer patients
- fi:Geneettinen vaihtelu CYP3A4 ja CYP3A5in ensisijainen maksan, mahalaukun ja paksusuolen ja peräsuolen syövän patients
- no:Genetisk variasjon i CYP3A4 og CYP3A5in primær lever, mage og pasienter med kolorektal kreft
- sk:Genetická variabilita v CYP3A4 a CYP3A5in primárne pečene, žalúdka a pacientov s kolorektálnym karcinómom
- it:Variabilità genetica in CYP3A4 e CYP3A5in primario del fegato, cancro gastrico e del colon-retto patients
- pt:Variabilidade genética em CYP3A4 e CYP3A5in primário do fígado, estômago e pacientes com câncer colorretal
- sl:Genetska variabilnost CYP3A4 in CYP3A5in primarni jeter, želodca in debelega črevesa patients
- lt:Genetinis kintamumas CYP3A4 ir CYP3A5in pirminis kepenų, skrandžio ir storosios žarnos vėžys patients
- hu:Genetikai variabilitás CYP3A4 és CYP3A5in primer májrák, gyomorrák és végbélrák patients
- ru:Генетическая изменчивость в CYP3A4 и CYP3A5in первичной печени, желудка и колоректального рака patients
- lb:Genetesch Verännerlechkeet an CYP3A4 an CYP3A5in Primärschoul Liewer, gastric an colorectal Kriibs Patienten
- hr:Genetska varijabilnost u CYP3A4 i CYP3A5in primarni jetre, želuca i rak debelog crijeva patients
|  Formula a base di latte di capra buona per la salute dell'intestino dei bambini
Formula a base di latte di capra buona per la salute dell'intestino dei bambini
 Andare avanti,
Andare avanti,
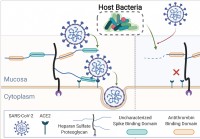 Il microbioma umano elimina i glicani della mucosa,
Il microbioma umano elimina i glicani della mucosa,
 Il modello di topo appena nato fornisce indizi sulla causa di una devastante malattia intestinale nei prematuri anemici
Il modello di topo appena nato fornisce indizi sulla causa di una devastante malattia intestinale nei prematuri anemici
 E. coli superbatterio che si diffonde a causa della scarsa igiene del bagno,
E. coli superbatterio che si diffonde a causa della scarsa igiene del bagno,
 La perdita del microbioma dovuta all'uso di antibiotici influisce sulla risposta al vaccino antinfluenzale
La perdita del microbioma dovuta all'uso di antibiotici influisce sulla risposta al vaccino antinfluenzale
 Gli scienziati risolvono il misterioso caso di sindrome da birrificio automobilistico
I ricercatori in Cina hanno fatto unimportante scoperta che spiega il caso confuso di un uomo di 27 anni che aveva una storia di intossicazione senza bere alcolici. Hanno scoperto che unabbondanza d
Gli scienziati risolvono il misterioso caso di sindrome da birrificio automobilistico
I ricercatori in Cina hanno fatto unimportante scoperta che spiega il caso confuso di un uomo di 27 anni che aveva una storia di intossicazione senza bere alcolici. Hanno scoperto che unabbondanza d
 I messaggeri proteici del microbioma umano fanno luce sulla salute umana
Il corpo umano è stato studiato per secoli, ma ci sono ancora misteri che devono ancora svelarsi. Ad esempio, si è scoperto che ci sono trilioni di batteri che vivono allinterno del corpo, quelli che
I messaggeri proteici del microbioma umano fanno luce sulla salute umana
Il corpo umano è stato studiato per secoli, ma ci sono ancora misteri che devono ancora svelarsi. Ad esempio, si è scoperto che ci sono trilioni di batteri che vivono allinterno del corpo, quelli che
 I microbi intestinali nelle vespe aiutano a sconfiggere i pesticidi
Uno studio intrigante pubblicato nel febbraio 2020 sulla rivista Cellula ospite e microbi riferisce che quando le vespe sono esposte allatrazina, un pesticida comunemente usato, il microbioma intest
I microbi intestinali nelle vespe aiutano a sconfiggere i pesticidi
Uno studio intrigante pubblicato nel febbraio 2020 sulla rivista Cellula ospite e microbi riferisce che quando le vespe sono esposte allatrazina, un pesticida comunemente usato, il microbioma intest