A máj nagy szerv, és jelentős mennyiségű májszövetet kell károsítani, mielőtt egy személy betegség tüneteit tapasztalná. A tünetek a májbetegség típusától is függhetnek. Ha a tünetek jelentkeznek, azok a következők lehetnek:
A PBC-ben szenvedő betegeknél alkalmazott kezelések a következőkre oszthatók:
A PBC-ben az epeutak pusztulása bizonyos mérgező epesavak visszatartásához vezet a májsejtekben (hepatocitákban). Úgy gondolják, hogy ezek a mérgező epesavak a hepatociták pusztulását és a májfunkció fokozatos elvesztését okozzák. Az ursodeoxikólsav (az UDCA ennek a kémiai névnek a rövidítése) egy természetben előforduló epesav, amelyet kis mennyiségben a normál májsejtek termelnek. Az UDCA felírható ursodiolként (Urso-250, Actigal és generikus készítmények). Orálisan bevéve az UCDA felszívódik a bélből, a májsejtek felveszik és feldolgozzák, majd az epével visszaszállítják a bélbe. Az UDCA-nak legalább négy jótékony hatása van a PBC-ben:
Négy nagyszabású klinikai vizsgálat hasonlította össze az UDCA hatékonyságát és biztonságosságát egy inaktív gyógyszerrel (placebóval). Ezeket a kontrollos vizsgálatokat tüneti és tünetmentes betegeken is elvégezték, akiknek májbiopsziáikon a szöveti rendellenességek (patológia) skálája volt, a korai betegségtől a cirrhosisig. Az UDCA-kezelés a májvérvizsgálati eltérések javulásához vezetett, jelentősen csökkentve a bilirubin, az alkalikus foszfatáz, a gamma-glutamil-transzferáz (GGT) és a koleszterin emelkedett szintjét. Az UDCA azonban nem javította a fáradtságot, nem akadályozta meg vagy javította a csontritkulást, és változó hatással volt a viszketésre. A négy vizsgálat közül háromban hasonló dózisú UDCA-t (13-15 mg/ttkg/nap) alkalmaztak, és összesen 548 beteg elemzéséhez kombinálták.
A kombinált elemzés eredményei azt mutatták, hogy az UDCA szignifikánsan növelte a túlélést akár 4 éves kezelés után is, májátültetés nélkül. A negyedik nagyszabású vizsgálatban alacsonyabb dózisú UDCA-t használtak (10-12 mg/kg/nap). Ennek a vizsgálatnak az eredményei némileg eltértek a másik három vizsgálat eredményeitől. Ez elsősorban a 2 mg/dl-nél alacsonyabb bilirubinszintű betegeknél mutatta ki az UDCA-kezelés előnyeit. A másik három, önmagában vagy kombinált vizsgálat azonban nem erősítette meg ezt a bilirubinnal kapcsolatos megfigyelést. Valójában ezek a vizsgálatok mindegyike előnyt mutatott az előrehaladott betegségben szenvedő és emelkedett bilirubinszintű betegek számára. Ezenkívül az UDCA csökkentette a portális hipertónia kialakulását. Fontos megjegyezni, hogy annak ellenére, hogy egyértelmű előnyökkel jár, az UDCA-kezelés elsősorban késlelteti progresszióját, és nem gyógyítja meg a PBC-t.
Valószínűleg UDCA-val kell kezelni minden PBC-ben szenvedő beteget, akinek a májvizsgálati eredményei kórosak, függetlenül a májbiopszia stádiumától vagy a betegség természetes progressziójának szakaszától. Az adag általában napi 13 és 15 mg/ttkg között kell, hogy legyen. A betegek az UDCA-t egyetlen adagban vagy osztott dózisban is bevehetik anélkül, hogy a klinikai előnyei befolyásolnák. Az UDCA nagyon biztonságos hosszú távú használatra. Az elsődleges mellékhatás a hasmenés, ami annak az oka, hogy nem veszi fel az összes UDCA-t a bélből. Azok a betegek, akiknél hasmenés tapasztalható, kisebb adagokat is bevehetnek gyakrabban, és megpróbálják fenntartani az ajánlott teljes napi adagot. Másrészt, a hasmenéses betegek megpróbálhatják adagonként nagyobb mennyiséget bevenni, azzal a céllal, hogy lefekvés előtt csak egy adagot vegyenek be (ismét az ajánlott teljes adagot).
A kolhicint, a gyulladást és a hegesedést csökkentő gyógyszert elsősorban köszvény okozta ízületi gyulladás kezelésére használták. Három randomizált, kontrollált PBC-vizsgálat kimutatta, hogy a kolhicin a placebóval összehasonlítva mérsékelten lassította a kóros vérvizsgálati eredmények előrehaladását, de nem csökkentette a tüneteket és nem akadályozta meg a májpatológia (szöveti rendellenességek a biopszián) progresszióját. Az egyik kísérlet valójában azt sugallta, hogy a kolhicin javította a túlélést. A kolhicinnel való jobb túlélésről szóló benyomást azonban nem igazolták. Valójában úgy tűnik, hogy a látszólag javult túlélés a váratlanul magas halálozási aránynak (mortalitásnak) tudható be a vizsgálatban az inaktív gyógyszert kapó betegek körében. A kolhicin előnyei olyan csekélyek, hogy ritkán ajánlják.
Az immunszuppresszív gyógyszerek, például a kortikoszteroidok, az azatioprin, ciklosporin (Sandimmune, Neoral, Gengraf) és a metotrexát (Rheumatrex, Trexall) elnyomják az immunreakciókat. Ezek a gyógyszerek elméletileg vonzó szerek a PBC kezelésére, azon az elven alapulva, hogy ez egy autoimmun betegség. Számos randomizált, kontrollált vizsgálatban tesztelték az immunszuppresszív gyógyszereket PBC-ben. Azonban ezen vizsgálatok egyike sem igazolta a betegek elhúzódó túlélését.
A kortikoszteroidok, például a prednizon, a prednizolon és a budezonid (Entocort) gátolják az immunreakciók megindulását, beleértve azokat a kezdeti válaszokat is, amelyek az fenntartásához szükségesek. autoimmun reakciók. Véletlenszerű (véletlen kezelésű) kontrollos vizsgálatot végeztek, amelyben a placebót egy alacsony dózisú prednizolonnal hasonlították össze 3 éven keresztül. Ez a tanulmány kimutatta, hogy a prednizolon javította a májműködést, és nem növelte jelentősen a csontritkulás vagy a demineralizáció sebességét. (Az oszteoporózis a szteroidok lehetséges mellékhatása). Egy másik randomizált vizsgálatban az UDCA-t és a placebót UDCA-val és prednizolonnal hasonlították össze a PBC korai stádiumában szenvedő betegeknél. Bár a májfunkció javulása mindkét csoportban hasonló volt, csak az UDCA és a prednizolon kombinációja eredményezett jelentősen javuló májbiopsziát.
Figyelemre méltó, hogy a kortikoszteroidok fő előnyei a korai betegeknél jelentkeztek. a betegség stádiumai a májbiopszián. Ezek a kezelések azonban nem eredményeztek teljes remissziót vagy gyógyulást. Ráadásul ezeknek a vizsgálatoknak sem a mérete, sem az időtartama nem volt elegendő a májátültetés nélküli túlélésre gyakorolt hatás meghatározásához. Ennek megfelelően több adatra van szükség a szteroidok önmagában vagy UDCA-val kombinált PBC-ben való előnyeinek és biztonságosságának megerősítéséhez. Mindazonáltal ezek a vizsgálatok megcáfolták azt a korábbi elképzelést, hogy a kortikoszteroidok a csontritkulás gyors progresszióját okozzák PBC-ben szenvedő betegeknél.
A budezonid egy szteroid, amely gyorsabban feldolgozódik (metabolizálódik) a májban, és ezért feltehetően kevésbé károsítja a csontokat, mint más szteroidok. Ezt a gyógyszert kiválasztott PBC-ben szenvedő betegeken tanulmányozták, akiknél szuboptimális (kevésbé kedvező) válasz volt az UDCA-ra. Sajnos a budezonid ebben a csoportban nem volt hatékony. Valójában jelentősen rontotta a csontritkulást, és nem akadályozta meg a PBC progresszióját. Ezzel szemben egy randomizált vizsgálat, amelyben az UDCA-t és a placebót a budezonid és UDCA kombinációjával hasonlították össze, a kombináció hatékonyabbnak bizonyult, míg a csontritkulás (ásványi sűrűség csökkenése) összehasonlítható volt a két csoportban. De itt is több adatra van szükség a kombináció előnyeinek és biztonságának megerősítéséhez.
Az Imuran megakadályozza az új limfociták (az immunválaszban részt vevő fehérvérsejtek) képződését azáltal, hogy gátolja a limfociták sejtosztódását (reprodukcióját). Ennek az intézkedésnek a következménye, hogy csökken a gyulladás helyére belépő új gyulladásos sejtek száma. Egy nagy vizsgálat azonban, amelyben az azatioprin hatását egy inaktív gyógyszerrel (placebóval) hasonlították össze 248 PBC-ben szenvedő betegen, nem mutatott előnyt. Következésképpen ez a gyógyszer jelenleg nem javasolt PBC-betegeknél a kutatási protokollokon kívül.
A ciklosporin erős immunszuppresszív gyógyszer, a ciklosporint (Sandimmune, Neoral, Gengraf) elsősorban az átültetett szervek kilökődésének megelőzésére használják. A gyógyszer megakadályozza a limfociták osztódásához (reprodukciójához) és gyulladás kialakulásához szükséges fontos jel képződését. Egy 349 PBC-beteg bevonásával végzett nagy tanulmány, amelyben a ciklosporint egy inaktív gyógyszerrel hasonlították össze, kimutatta a ciklosporin előnyeit. A magas vérnyomás és a csökkent veseműködés mellékhatásainak gyakorisága azonban elfogadhatatlanná teszi ezt a gyógyszert a hosszú távú használat során.
A metotrexát elnyomja az immunrendszert és megakadályozza a sejtek osztódását. Ezt a gyógyszert sikeresen alkalmazták súlyos reumás ízületi gyulladásban és a pikkelysömör nevű immunológiai bőrbetegségben. A PBC-ben szenvedő betegekkel végzett kezdeti korlátozott vizsgálatok nem mutattak előnyt, és a súlyos mellékhatások közé tartozott a szájfekély, a hajhullás és a tüdőgyulladás. Ezenkívül a PBC metotrexátos kezelésének randomizált, ellenőrzött vizsgálatairól szóló előzetes jelentések Európában a vártnál magasabb arányt mutattak ki a tüdőt hegeket okozó tüdőgyulladás egyik formájával. Ezenkívül egy nemrégiben közzétett, randomizált, kontrollált vizsgálat kis dózisú metotrexáttal PBC-ben súlyos toxicitást mutatott ki hat éven át. Jelenleg az Egyesült Államokban folyik egy nagy kísérlet, amelyben az UDCA-t önmagában hasonlítják össze az UDCA és a metotrexát kombinációjával. Jelenleg még korai lenne javasolni a metotrexát alkalmazását a PBC kezelésére a klinikai vizsgálatokon kívül.
Az Ocaliva-t 2016 májusában hagyta jóvá az FDA a PBC kezelésére ursodeoxycholic savval (UDCA) kombinálva olyan felnőtteknél, akiknél nem reagálnak megfelelően vagy akik intoleranciát mutatnak az UDCA-ra, vagy egyetlen terápiaként olyan felnőtteknél, akik nem tolerálják az UDCA-t. Az ilyen betegeknél közel 50%-uk mutatott javulást a májtesztekben. A leggyakoribb mellékhatás a viszketés, amelyet a betegek több mint 50%-ánál figyeltek meg. A leggyakoribb mellékhatások közé tartozik a fáradtság, hasi fájdalom és kellemetlen érzés, ízületi fájdalom, fájdalom a torok középső részén, szédülés, székrekedés és viszketés.
A kolesztiramin orálisan bevehető gyógyszer, amely nem szívódik fel a bélben. A gyógyszer a bélben lévő anyagokhoz kötődik (kötődik), beleértve az epéből származó anyagokat is, majd eltávolítja azokat a szervezetből a bélmozgásba. Feltehetően a kolesztiramin hasznos, mert megköti mind az epesavakat, mind az azonosítatlan anyagokat, amelyek viszketést okoznak, miután felszívódnak a bélből a véráramba. A kolesztiramin a leghatékonyabb terápia a legtöbb kolesztatikus viszketésben szenvedő beteg számára. Az optimális hatás érdekében a kolesztiramin étkezés közben kell bevenni, amikor a legnagyobb az epe áramlása a bélbe. Az epehólyagban szenvedő betegeknél valamivel nagyobb adag reggelivel ajánlott, mivel az epehólyagban egy éjszakán át raktározott epe ekkor szabadul fel.
Fontos megjegyezni, hogy a kolesztiramin a gyógyszerekhez is kötődhet. Ezért fontos, hogy más gyógyszereket egy órával a kolesztiramin bevétele előtt vagy két órával azt követően vegye be. A szokásos adag 8 gramm reggelivel, 4 gramm ebéddel és 4 gramm vacsorával. A kolesztiramin nem oldódik jól folyadékokban, és lenyeléskor gyakran kavicsosnak tűnik. A szénsavas italokhoz keverve azonban csökkentheti ezt a problémát.
A kolesztiramin fő mellékhatása a székrekedés. A székrekedés azért fordul elő, mert a gyógyszer megköti az epesavakat, amelyek egyébként több vizet bocsátanának rendelkezésre a vastagbélben a széklet lágyítására. A ciklosporin mellékhatásai a következők:
Egy másik epesavmegkötő gyógyszer, amellyel a viszketés enyhíthető, a kolesztipol (Colestid).
Egy antibiotikum, a rifampin (Rifidin) eredetileg véletlenül javítja a viszketést a kolesztázis miatt. Ezután egy PBC-ben szenvedő betegek vizsgálata, amely a rifampin és egy inaktív vegyület (placebo) közötti keresztezést tartalmazta, azt mutatta, hogy a rifampin csökkentette a viszketést napi kétszer vagy háromszor bevett 150 mg-os dózisban. Ez a gyógyszer akár egy hónapig is eltarthat, amíg hatásos lesz, de nem tarthat tovább. Ezért, ha a gyógyszer egy hónap elteltével nem hatásos, abba kell hagyni. Nem minden PBC-s beteg részesül ebből a gyógyszerből.
A rifampin működési módja kevéssé ismert. Olyan biokémiai utakat indukálhat a hepatocitákban, amelyek elméletileg megváltoztathatják az epesavas környezetet ezekben a sejtekben. A rifampin mellékhatásai közé tartozik a bilirubinszint emelkedése, a sötét vizelet, a hepatitis (ritkábban), a vérlemezkék számának csökkenése (olyan apró elemek, amelyek segítenek megállítani a vérzést a vágott felületről), valamint vesekárosodás.
Az a tény, hogy egyes betegeknél, akik opiát kábítószert (például morfiumot) kapnak, viszketés alakul ki, ahhoz a hipotézishez vezetett, hogy a cholestasis okozta viszketést a szervezet természetes opiátok, az úgynevezett endorfinok okozhatják. Ennek a hipotézisnek a tesztelésére a viszkető PBC-ben szenvedő betegeket orális nalmefén gyógyszerrel kezelték, amely az opiátok antagonistája (a hatás ellen hat vagy blokkolja a hatást). A viszketés 9 hónap alatt javult. Egyes opiátantagonistával kezelt betegeknél azonban az opiát megvonási nagyon kellemetlen tünetei jelentkeztek amikor természetes endorfinjaikat gátolták. Ezért ez a gyógyszer nem alkalmas hosszú távú használatra PBC-ben. Egy ellenőrzött vizsgálat, amelyben a naloxon (Narcan) nevű intravénás opiát antagonistát hasonlították össze inaktív intravénás folyadékokkal, kimutatta, hogy a naloxon javította a viszketést PBC-s betegekben. Mivel intravénásan kell beadni, a naloxon szintén nem megfelelő hosszú távú használatra.
A közelmúltban az orális opiát antagonistát, a naltrexont (Revia) egy kis, randomizált, kontrollos vizsgálatban tesztelték viszkető PBC-betegeken. A betegek 50%-ánál javította a viszketést, és nem okozott opiát elvonási tüneteket. A naltrexon a fáradtság és a depresszió tüneteit is javította, valószínűleg azáltal, hogy helyreállította az éjszakai alvás képességét, amikor a viszketés a legsúlyosabb. Jövőbeli vizsgálatokra van azonban szükség annak felmérésére, hogy biztonságos, mennyi ideig adható, és hogy a betegek végül nem reagálnak-e (refrakterek) a hatásaira.
Nem kontrollált vizsgálatokban a PBC-ben szenvedő betegek, akiknél súlyos viszketés jelentkezett, plazmaferézisnek nevezett eljáráson estek át. (A nem kontrollált vizsgálatok olyan vizsgálatok, amelyekben a kezelést nem hasonlították össze más kezelésekkel vagy placebóval.) Ebben az eljárásban a vért eltávolítják a szervezetből, és a vér folyékony fázisát (úgynevezett plazmát) elválasztják a vérsejtektől és a vérlemezkéktől. A plazmát ezután aktív szenet tartalmazó oszlopon perkoláljuk. Végül a plazmát újra összekeverik a vérsejtekkel, és intravénásan visszajuttatják a betegbe. Az ötlet az, hogy a szén eltávolítana néhány (még ismeretlen) vegyületet vagy vegyületeket a plazmából, amelyek a viszketést okozták. Anekdoták szerint sok betegnél napoktól hónapokig enyhült a viszketés. Ellenőrzött vizsgálatokat azonban (más kezelésekkel vagy placebóval összehasonlítva) nem végeztek. Ezért ez az eljárás még mindig kísérleti jellegű, és nem gyakran használják.
Még nem világos, hogy a csontritkulás kezelésére általában ajánlott terápiák kielégítően kezelhetik-e vagy megelőzhetik-e a csontritkulást PBC-ben szenvedő betegeknél. Érdemes azonban megfelelő mennyiségű kalciumot és D-vitamint biztosítani az étrendben. A D-vitamin szükséges a kalcium bélből történő felszívódásához. Megfelelő mennyiségű kalciumot lehet bevinni tejtermékek, például tej vagy joghurt fogyasztásával, vagy az étrend kiegészítésével 1000-1500 mg kalcium-karbonáttal. A porított osztrigahéjból előállított kalcium-karbonát vény nélkül megvásárolható. Általában a napi multivitaminban lévő extra D-vitamin elegendő a napi szükséglet kielégítéséhez. A bőr napfénynek való kitettsége szintén fokozza a D-vitamin termelődését a szervezetben.
PBC-ben szenvedő posztmenopauzás nőknél az ösztrogén hormonpótló terápia csökkentheti a csontritkulás kockázatát. Az ösztrogén, amely orális formában vagy tapasz formájában kapható, amely lehetővé teszi az ösztrogén bőrön keresztüli felszívódását, biztonságos a PBC-ben szenvedő nők számára. Ne feledje azonban, hogy ellentmondások vannak az ösztrogénpótló terápia alkalmazásáról olyan posztmenopauzás nőknél, akiknek mellrákja volt, mivel fennáll a rák kiújulásának kockázata. There is also concern about prolonged use of estrogens with progestin in increasing the risk of coronary heart diseases, strokes, and pulmonary embolism in healthy menopausal women. Therefore, whether to use estrogen or not should be individualized after consulting one's doctor. Another alternative to estrogen to protect bone density in patients with PBC is the bisphosphonates, which are FDA-approved drugs for the prevention of osteoporosis. Too few studies have been performed using other drugs (for example, fluoride or calcitonin) for osteoporosis to recommend their use in PBC.
Elevated levels of cholesterol in the blood are common in patients with PBC, and xanthomas (fatty deposits that appear as yellowish firm nodules in the skin) occur in about 25% of those patients with elevated cholesterol. Diets with low cholesterol content do not consistently lower serum cholesterol in these patients, because production of cholesterol by the liver is stimulated in patients with PBC. Cholestyramine, the oral medication that is often used to treat itching, can, at the same time, reduce the levels of serum cholesterol to a modest degree.
Clofibrate (Atromid) should not be used for treating elevated serum cholesterol in PBC because it elevates (rather than lowers) the cholesterol levels in these patients. Moreover, this drug may worsen xanthomas and cause formation of gallstones containing cholesterol. Two studies indicate that UDCA therapy significantly reduces serum levels of cholesterol and is recommended for use in patients with xanthomas. A new class of drugs called statins inhibits formation of cholesterol and, to a lesser degree, triglycerides. The safety and effectiveness of the statins, however, have not been adequately studied in PBC. One of the common side effects of statins is liver injury. Thus, their use in a person with liver disease requires careful monitoring by a physician.
Reduction of dietary fat is the treatment of choice for fat malabsorption (poor absorption of fat in the gut). The idea is that if the dietary intake of fat is decreased, more of this fat will be absorbed. The goal of the low-fat diet would be to alleviate the diarrhea caused by the fat malabsorption, while still providing enough fat for adequate nutrition. If this diet does not help, a supplement of special fats called medium-chain triglycerides (MCT) can be ingested. MCT can replace as much as 60% of the calories provided by ordinary dietary fat, which is mostly long-chain triglycerides. MCT is a special type of fat preparation that does not require bile acids for its absorption and is actually absorbed more easily than the usual dietary fat. As noted earlier, PBC patients with malabsorption of fat should also be tested for celiac sprue.
It is recommended that patients with PBC take a multivitamin supplement without minerals to increase the dietary intake of fat-soluble vitamins. If the quantities of bile acids flowing through the bile ducts to the gut are marginal, intestinal absorption of the fat-soluble vitamins may not be adequate, even with supplements. Two strategies exist for this situation. First, patients can take Liqui-E with meals. Liqui-E is an over-the-counter liquid preparation of vitamin E that also increases the absorption of other fat-soluble vitamins in the diet or in multivitamin preparations. Second, the fat-soluble vitamins A and K can be given by injection into the muscle once a month. Remember, however, that women who might become pregnant, should not receive injections of vitamin A, because it can cause birth defects.
Retention of salt and water can lead to swelling of the ankles and legs (edema) or abdomen (ascites) in patients with cirrhosis. Diuretics are medications that work in the kidneys to combat retention of fluid by eliminating salt and water into the urine. A combination of the diuretics spironolactone (Aldactone) and furosemide (Lasix) can reduce or eliminate the swelling in most people. During treatment with diuretics, it is important to monitor kidney function by measuring serum levels of blood urea nitrogen (BUN) and creatinine to determine if the doses of the diuretics are safe. Sometimes, when the diuretics do not work, a long needle is used to draw out the fluid directly from the abdomen (a procedure called paracentesis).
If large varices (distended veins) develop in the esophagus or upper stomach or any episodes of bleeding from varices have occurred, physicians should consider specific therapy for the varices. Treatment with propranolol (Inderal), a drug in a class called beta-blockers, is effective in preventing initial bleeding or rebleeding from varices in patients with cirrhosis. This drug, however, has not been proven to prevent bleeding in patients with portal hypertension who do not have cirrhosis.
Other methods are available to prevent or treat varices. These methods include:
PBC patients with an abnormal sleep cycle, impaired thinking, odd behavior, or other signs of hepatic encephalopathy usually should be treated with a low protein diet and oral lactulose. Dietary protein is restricted because it is a source of the toxic compounds present in hepatic encephalopathy. The lactulose, which is a liquid medication, traps the toxic compounds in the colon. Consequently, they cannot be absorbed into the bloodstream and cause the symptoms of encephalopathy. To be sure that adequate lactulose is present in the colon at all times, the patient should adjust the dose to produce 2 to 3 semiformed bowel movements a day. If symptoms of encephalopathy persist, the oral antibiotics, such as rifaximin, can be added to the treatment regimen.
The blood filtration function of an enlarged spleen usually results in only mild reductions of red blood cells (anemia), white blood cells (leukopenia) and platelets (thrombocytopenia) that do not require treatment. Severe anemia, however, may require blood transfusions or treatment with erythropoietin or epoetin alfa (Epogen, Procrit), a hormone that stimulates production of red blood cells. If the numbers of white blood cells are severely reduced, another hormonal drug, called granulocyte-colony stimulating factor (G-CSF) is available to increase the white blood cells. An example of an available G-CSF drug is filgrastim (Neupogen).
No FDA-approved medication is available yet to increase the number of platelets. As a necessary precaution, patients with low platelets should not use aspirin or other non-steroidal anti-inflammatory drugs (NSAIDS) since these drugs can hinder the function of platelets. If a low number of platelets is associated with significant bleeding, transfusions of platelets usually should be given. Surgical removal of the spleen (called splenectomy) should be avoided, if possible, because of the risk of excessive bleeding during the operation and the risk of anesthesia in advanced liver disease.
Dry eyes: For chronically dry eyes, use artificial tears containing methylcellulose without preservatives. These artificial tears can prevent the complications of dry eyes, such as ulcers of the cornea.
Dry mouth: Patients with dry mouth have a reduced amount of watery saliva but maintain production of thick saliva. Chewing gum or sucking on a small object can stimulate more watery saliva. Others may need to moisten the mouth with fluids. It is imperative that all patients with dry mouth take adequate amounts of fluids to help with swallowing during meals or when taking oral medications. It is also recommended that these patients have frequent dental appointments to check for cavities.
Dry vagina: Lubricating jelly is suggested to prevent painful sexual intercourse. If a woman is postmenopausal, estrogen creams are also recommended to improve the function of the cells lining the vagina.
PBC patients with Raynaud's phenomenon should restrict exposure to the cold. They can wear warm clothing, gloves, and shoes when they must be in cold environments. Some patients find that using gloves also helps avoid problems when they handle ice-cold articles, for example frozen food packages and cold cans of soda. All patients with Raynaud's phenomenon should stop smoking cigarettes because smoking causes reduced blood flow in the blood vessels of the hands and feet. Drugs called calcium channel blockers help the symptoms in the hands and feet of some patients. At the same time, unfortunately, however, these drugs may worsen swallowing difficulties associated with scleroderma.
Skin tightening, calcification, or telangiectasia: There is no known therapy to prevent or reverse skin tightening, calcium deposits, or telangiectasias in patients with scleroderma.
Swallowing problems and heartburn: As previously mentioned, patients with scleroderma may experience heartburn or difficulty swallowing. It is recommended that patients with these symptoms or other evidence of scleroderma or the CREST syndrome:
Cholesterol gallstones may be prevented by the UDCA used for the long-term treatment of the PBC itself. (UDCA taken orally can actually dissolve cholesterol gallstones in a minority of patients.) No treatment is necessary for patients who have gallstones that are not causing symptoms. These patients should usually just be observed because they will probably never develop symptoms from their gallstones.
An operation (cholecystectomy) to remove the gallbladder and its gallstones should be considered if the gallstones have been causing symptoms. These symptoms ordinarily are bouts of rather characteristic abdominal pain. This surgery usually should not be done, however, if a patient has advanced cirrhosis because of the increased risk of complications from both the surgery and the PBC. In this situation, less risky procedures can be considered or, if the gallstones are the cholesterol type, UDCA (if not already being used to treat the PBC) can be given reasonably safely to try to dissolve the gallstones.
Most often, people will contact their primary care health-care professional with questions about the color of their stool. These includes health-care professionals who care for infants and children and adults. Depending upon the cause of the stool color change, certain specialists may need to be involved. For example, for red or black stool due to bleeding, a gastroenterologist may be needed to perform endoscopy, to look for a bleeding source in the stomach or intestine. Patients with PBC are generally treated by gastroenterologists and/or hepatologists. Development of complications may require the need for other specialists. For example, an endocrinologist may be needed for the treatment of metabolic bone disease (osteoporosis). Patients who develop hepatocellular carcinoma may need the help of several specialists including an oncologist, interventional radiologist, and a liver surgeon. Patients with advanced liver disease including cirrhosis of the liver should be referred to a transplant center as they may need a liver transplant at some stage in the future.
Liver transplantation is a life-saving operation for those patients with PBC who are at risk of premature death due to liver failure or the complications of cirrhosis and portal hypertension. The Mayo Risk Score provides an accurate estimate of the future outcome (prognosis) for patients, regardless of whether they are being treated with ursodeoxycholic acid. The United Network for Organ Sharing (UNOS) permits patients with PBC to be listed for a liver transplant once their estimated survival with PBC for an additional year is 95% or less. It is recommended that physicians calculate the Mayo Risk Score at least yearly in all patients with PBC who have cirrhosis.
Most PBC candidates for transplantation have advanced cirrhosis with decompensated liver disease, which also is referred to as liver failure. Decompensated liver disease means that the patients have low levels of serum albumin and blood clotting factors made in the liver and complications of portal venous hypertension such as ascites, variceal bleeding, encephalopathy, or hypersplenism. Patients are classified as having decompensated cirrhosis whether or not the complications respond to medical therapy.
Rarely, before advanced cirrhosis develops, transplantation of the liver is warranted in a few clinically disastrous situations in PBC. Examples of such situations include recurrent fractures due to advanced osteoporosis or severe, debilitating itching unrelieved by any medical therapy, and even more rarely the hepatopulmonary syndrome (breathing difficulty in advanced cirrhosis). The regional review committees of UNOS accept applications for transplantation in these special circumstances and decide on a patient-by-patient basis if liver transplantation is indicated.
The outcome of liver transplantation in PBC is excellent. The survival of patients two or more years after transplantation is generally 80%. This impressive survival rate is greater than the survival of patients transplanted for most other types of liver diseases. The titers of AMA fall following successful liver transplantation, but they do not usually disappear. A minority of patients, however, develops recurrent PBC in the transplanted liver. Studies are being performed to see if reducing the maintenance doses of immunosuppressive drugs more slowly after transplantation can prevent recurrence of PBC. Once recurrent PBC is diagnosed, ursodeoxycholic acid therapy is started to retard progression. Patients with recurrent PBC rarely will need a second liver transplant.
The goal of ongoing and future research in PBC is to better understand the processes (mechanisms) that initiate and perpetuate the inflammation that destroys first the small caliber bile ducts and later the hepatocytes. Logically, a more complete understanding of these mechanisms will reveal new strategies for therapy, designed to block specific crucial steps in the progression of disease.
PBC is such a slowly progressive disease that it is often initially diagnosed after the development of cirrhosis. Future therapies will probably include strategies that differ for patients with early disease compared to those with advanced disease. Presumably, patients with early phases of PBC would benefit more from therapies that block immunologic mechanisms of bile duct destruction than would patients whose bile ducts have already been destroyed. Conversely, patients whose bile ducts have already been destroyed may benefit more from therapies that prevent the formation of scar tissue and the toxic consequences of cholestasis.
The key to success is support of both basic science and clinical research in PBC, which have not been adequately funded in the past. Several promising research strategies are being pursued to reveal the mechanisms involved in developing PBC. For example, studies are in progress to evaluate the genetic (hereditary) characteristics of patients with PBC who have close relatives with the disease. By studying all of these patients with PBC and comparing them with other family members without PBC, it may be possible to better understand the predispositions to this disease. In addition, a large-scale study is underway in the United States that will compare PBC patients with healthy people of the same age and gender. The points of comparison will include their life experiences, habits, diet, medical and surgical histories, childbearing history, and exposures to environmental toxins and medications. This study likewise should provide important clues regarding predispositions to PBC.
Studies also are in progress to see if PBC may be initiated (triggered) by an infection with either bacteria or viruses. For example, studies are ongoing to confirm or disprove the notion that proteins of infectious organisms stimulate AMA autoantibodies (and the autoantibodies just happen to react to antigens present in the mitochondria). Other studies are dissecting the mechanisms involved in the lymphocyte migration toward small bile ducts and the lymphocyte killing of bile duct epithelial cells. These studies involve not only patients with PBC, but also several animal models in which T-lymphocytes destroy small bile ducts in an identical manner to that seen in PBC. These studies ultimately should identify new ways to treat PBC by, for example, blocking the killing of bile ducts by T-lymphocytes.
Finally, the issue of scar tissue formation in PBC and other diseases associated with cholestasis is now being researched in the hope of finding a way to prevent the development of cirrhosis. If cirrhosis can be prevented, even if ongoing inflammation of the liver continues, many patients might not develop the complications of portal venous hypertension and the progression to liver failure.
 Egészségügyi tipp:A sérv megelőzése
Legfrissebb hírek a krónikus fájdalomról Űrvérszegénység veszélyének kitett űrhajósok A génterápia segíthet a sarlósejtes betegség gyógyításában? Az FDA jóváhagyja a virtuális valóság rendszert a hát
Egészségügyi tipp:A sérv megelőzése
Legfrissebb hírek a krónikus fájdalomról Űrvérszegénység veszélyének kitett űrhajósok A génterápia segíthet a sarlósejtes betegség gyógyításában? Az FDA jóváhagyja a virtuális valóság rendszert a hát
 A Stridor áttekintése
A Stridor arra a zajra utal, amely akkor keletkezik, amikor valaki, akinek felső légútja elzáródott, lélegezni próbál. A hangzás jellegzetes és magas. A legtöbb egészségügyi szolgáltató könnyen felism
A Stridor áttekintése
A Stridor arra a zajra utal, amely akkor keletkezik, amikor valaki, akinek felső légútja elzáródott, lélegezni próbál. A hangzás jellegzetes és magas. A legtöbb egészségügyi szolgáltató könnyen felism
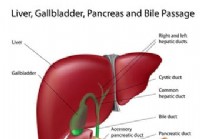 Májbetegség
A máj, a hasnyálmirigy és az epe áthaladásának diagramja. A májbetegségek tünetei és jelei a gyengeség és a fáradtság, a fogyás, az émelygés, a hányás és a bőr sárgás elszíneződése (sárgaság). Milyen
Májbetegség
A máj, a hasnyálmirigy és az epe áthaladásának diagramja. A májbetegségek tünetei és jelei a gyengeség és a fáradtság, a fogyás, az émelygés, a hányás és a bőr sárgás elszíneződése (sárgaság). Milyen