ONSDAG 1 februari (HealthDay News) - US Food and Drug Administrations godkännande för Novartis-läkemedlet Gleevec har utökats till att omfatta vuxna som har genomgått kirurgiskt avlägsnande av CD117-positiva gastrointestinala stromala tumörer (GIST), säger myndigheten i en nyhet släpp.
GIST är en sällsynt cancerform som bildas i celler som kantar väggarna i mag-tarmkanalen, inklusive magen. Sådana celler spelar en roll i matsmältningen och andra kroppsliga processer, sa FDA.
Gleevec, som först godkändes 2001 för att behandla en genetisk sjukdom som kallas Philadelphia-kromosompositiv kronisk myeloid leukemi, har sedan sanktionerats för ett antal former av GIST.
Gleevecs etikett kommer att uppdateras för att inkludera kliniska studieresultat om CD117-positiv GIST. Läkemedlet ökade patientens överlevnad avsevärt när det togs i 36 månader, jämfört med standard 12 månader, sa FDA.
Vanliga kliniska biverkningar av Gleevec var svullnad, illamående och kräkningar, muskelkramper, ben- eller muskelsmärta, diarré, utslag, trötthet och buksmärtor.
Novartis är baserat i East Hanover, N.J.
-- Scott Roberts
 Copyright © 2012 HealthDay. Alla rättigheter reserverade.
Copyright © 2012 HealthDay. Alla rättigheter reserverade.
 San Francisco Gastroenterology introducerar vår patientportal
San Francisco Gastroenterology erbjuder nu en patientportal som kommer att ge våra patienter enkel tillgång till vårt kontor och våra tjänster. Efter att ha fyllt i ett kort registreringsformulär komm
San Francisco Gastroenterology introducerar vår patientportal
San Francisco Gastroenterology erbjuder nu en patientportal som kommer att ge våra patienter enkel tillgång till vårt kontor och våra tjänster. Efter att ha fyllt i ett kort registreringsformulär komm
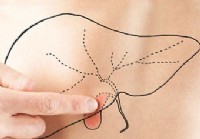 Gallsten:behandling, symtom och orsaker
En vuxen man som pekar på en leverkontur och målade en gallblåsa på buken. Gallstone definition och fakta Gallstenar är stenar som bildas i gallblåsan eller gallgångarna. De vanligaste typerna av gal
Gallsten:behandling, symtom och orsaker
En vuxen man som pekar på en leverkontur och målade en gallblåsa på buken. Gallstone definition och fakta Gallstenar är stenar som bildas i gallblåsan eller gallgångarna. De vanligaste typerna av gal
 trio av rostade grönsaker
Med Thanksgiving och julen precis runt hörnet är det dags att börja tänka på läckra rostade grönsaker som du kan para ihop med din kalkon och annat kött för den här julsäsongen. Vi har precis rätten f
trio av rostade grönsaker
Med Thanksgiving och julen precis runt hörnet är det dags att börja tänka på läckra rostade grönsaker som du kan para ihop med din kalkon och annat kött för den här julsäsongen. Vi har precis rätten f