WOENSDAG 1 februari (HealthDay News) - De goedkeuring van de Amerikaanse Food and Drug Administration voor het Novartis-medicijn Gleevec is uitgebreid met volwassenen die een chirurgische verwijdering van CD117-positieve gastro-intestinale stromale tumoren (GIST) hebben ondergaan, zei het bureau in een nieuwsbericht. vrijgeven.
GIST is een zeldzame vorm van kanker die zich vormt in cellen langs de wanden van het maagdarmkanaal, inclusief de maag. Dergelijke cellen spelen een rol bij de vertering van voedsel en andere lichamelijke processen, aldus de FDA.
Gleevec, voor het eerst goedgekeurd in 2001 voor de behandeling van een genetische ziekte die Philadelphia-chromosoom-positieve chronische myeloïde leukemie wordt genoemd, is vervolgens goedgekeurd voor een aantal vormen van GIST.
Het label van Gleevec zal worden bijgewerkt met klinische onderzoeksresultaten over CD117-positieve GIST. Het medicijn verhoogde de overleving van de patiënt aanzienlijk wanneer het gedurende 36 maanden werd ingenomen, vergeleken met de standaard 12 maanden, aldus de FDA.
Vaak voorkomende klinische bijwerkingen van Gleevec waren zwelling, misselijkheid en braken, spierkrampen, bot- of spierpijn, diarree, huiduitslag, vermoeidheid en buikpijn.
Novartis is gevestigd in East Hanover, N.J.
-- Scott Roberts
 Copyright © 2012 HealthDay. Alle rechten voorbehouden.
Copyright © 2012 HealthDay. Alle rechten voorbehouden.
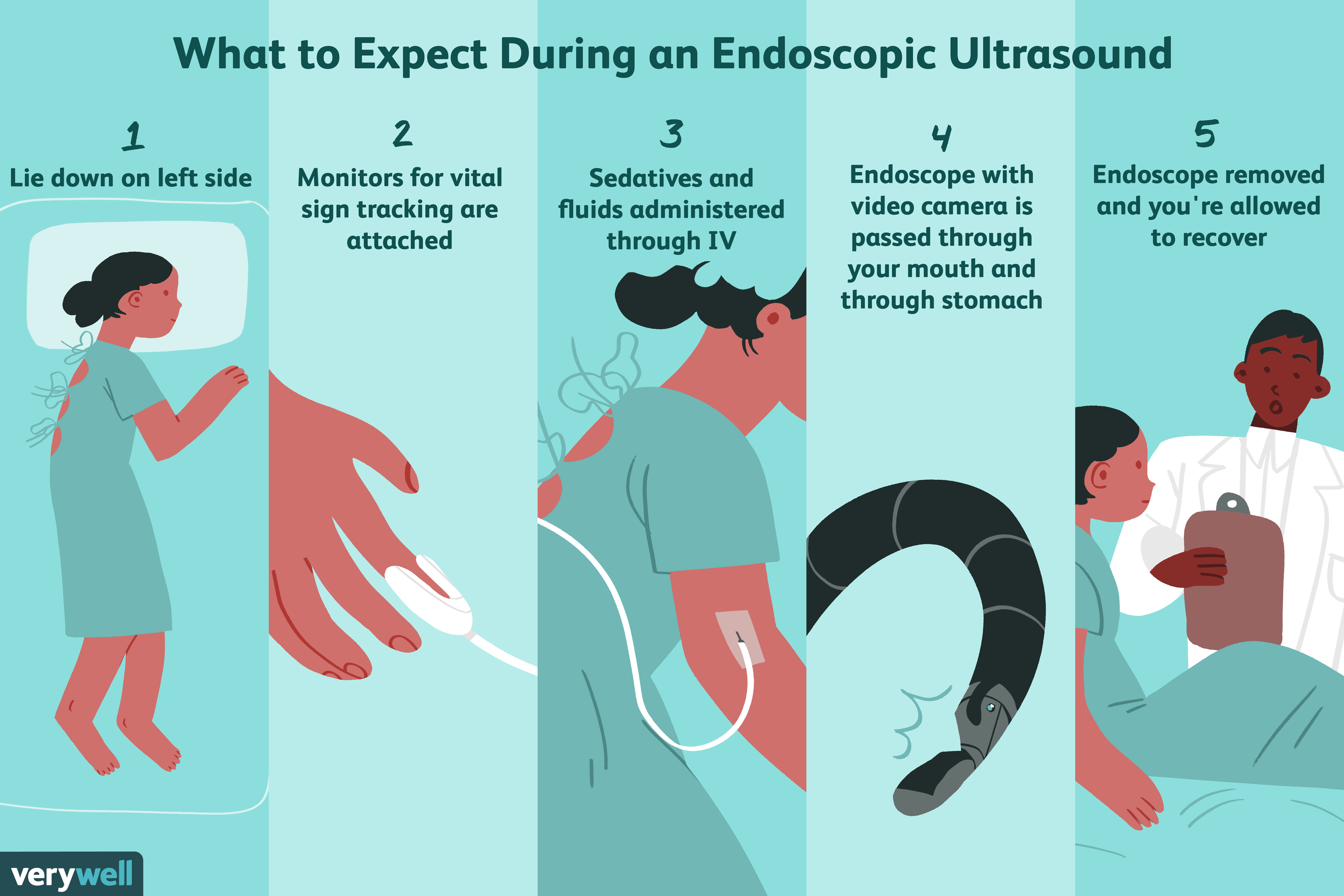 Wat is endoscopische echografie?
Wat is endoscopische echografie?
 5 eenvoudige manieren om calorieën toe te voegen aan het specifieke koolhydraatdieet
5 eenvoudige manieren om calorieën toe te voegen aan het specifieke koolhydraatdieet
 Hoe ernstig is niet-alcoholische steatohepatitis?
Hoe ernstig is niet-alcoholische steatohepatitis?
 Low Fodmap Mueslirepen
Low Fodmap Mueslirepen
 Genetisch tweaken van darmbacteriën vermindert het risico op colorectale kanker bij muizen vindt studie
Genetisch tweaken van darmbacteriën vermindert het risico op colorectale kanker bij muizen vindt studie
 Mixed-Type Prikkelbare Darm Syndroom (IBS-M)
Mixed-Type Prikkelbare Darm Syndroom (IBS-M)
 Waarvoor wordt een EGD gebruikt?
Wat is EGD? Afgebeeld is een verlichte camera, een endoscoop genaamd, die wordt gebruikt voor de diagnostische procedure van de EGD (bovenste endoscopie). EGD (esophagogastroduodenoscopie) is een pr
Waarvoor wordt een EGD gebruikt?
Wat is EGD? Afgebeeld is een verlichte camera, een endoscoop genaamd, die wordt gebruikt voor de diagnostische procedure van de EGD (bovenste endoscopie). EGD (esophagogastroduodenoscopie) is een pr
 Wat is een biopsie?
Een biopsie is een medische procedure waarbij een monster van weefsel of cellen wordt genomen voor onderzoek in een laboratorium. Het wordt gebruikt om ziekten te diagnosticeren en om de aard van een
Wat is een biopsie?
Een biopsie is een medische procedure waarbij een monster van weefsel of cellen wordt genomen voor onderzoek in een laboratorium. Het wordt gebruikt om ziekten te diagnosticeren en om de aard van een
 Hoe zich te ontdoen van aambeien:soorten, oorzaken en behandelingen
Wat zijn aambeien? Weet jij wat een aambei is? Aambeien zijn klonten van verwijde (vergrote) bloedvaten in de anus en het onderste rectum. Het rectum is het laatste deel van de dikke darm voordat he
Hoe zich te ontdoen van aambeien:soorten, oorzaken en behandelingen
Wat zijn aambeien? Weet jij wat een aambei is? Aambeien zijn klonten van verwijde (vergrote) bloedvaten in de anus en het onderste rectum. Het rectum is het laatste deel van de dikke darm voordat he