KESKIVIIKKO, 1. helmikuuta (HealthDay News) – Yhdysvaltain elintarvike- ja lääkeviraston hyväksyntä Novartis-lääkkeelle Gleevecille on laajennettu koskemaan aikuisia, joilta on poistettu CD117-positiiviset maha-suolikanavan stroomakasvaimet (GIST) kirurgisesti, virasto kertoi uutisessa. vapauttaa.
GIST on harvinainen syöpä, joka muodostuu soluihin, jotka reunustavat ruoansulatuskanavan seinämiä, mukaan lukien mahalaukku. Tällaisilla soluilla on rooli ruoansulatuksessa ja muissa kehon prosesseissa, FDA sanoi.
Gleevec, joka hyväksyttiin ensimmäisen kerran vuonna 2001 hoitamaan geneettistä sairautta nimeltä Philadelphia-kromosomipositiivinen krooninen myelooinen leukemia, on sittemmin saanut seuraamuksia useista GIST-muodoista.
Gleevecin etiketti päivitetään sisältämään kliiniset tutkimustulokset CD117-positiivisesta GIST:stä. Lääke lisäsi merkittävästi potilaiden eloonjäämistä, kun sitä otettiin 36 kuukauden ajan verrattuna tavanomaiseen 12 kuukauteen, FDA sanoi.
Gleevecin yleisiä kliinisiä sivuvaikutuksia olivat turvotus, pahoinvointi ja oksentelu, lihaskrampit, luu- tai lihaskipu, ripuli, ihottuma, väsymys ja vatsakipu.
Novartis sijaitsee East Hanoverissa, N.J.
ssa-- Scott Roberts
 Tekijänoikeus © 2012 HealthDay. Kaikki oikeudet pidätetään.
Tekijänoikeus © 2012 HealthDay. Kaikki oikeudet pidätetään.
 Potilaiden mahdollisuus parantaa suoliston terveyttä:ravitsemusterapeuttien neuvoja
Potilaiden mahdollisuus parantaa suoliston terveyttä:ravitsemusterapeuttien neuvoja
 Luonnollinen helpotus hampaiden narskutukseen
Luonnollinen helpotus hampaiden narskutukseen
 Lantionpohjan toimintahäiriön ja IBS-oireiden välinen yhteys
Lantionpohjan toimintahäiriön ja IBS-oireiden välinen yhteys
 Mahalaukun leikkaus:mitä on odotettavissa leikkauspäivänä
Mahalaukun leikkaus:mitä on odotettavissa leikkauspäivänä
 Suoliston bakteeriprofiili voi ennustaa suoliston vaurioita sädehoidon jälkeen
Suoliston bakteeriprofiili voi ennustaa suoliston vaurioita sädehoidon jälkeen
 Paksusuolen syövän ehkäisy on helpompaa kuin oletat
Paksusuolen syövän ehkäisy on helpompaa kuin oletat
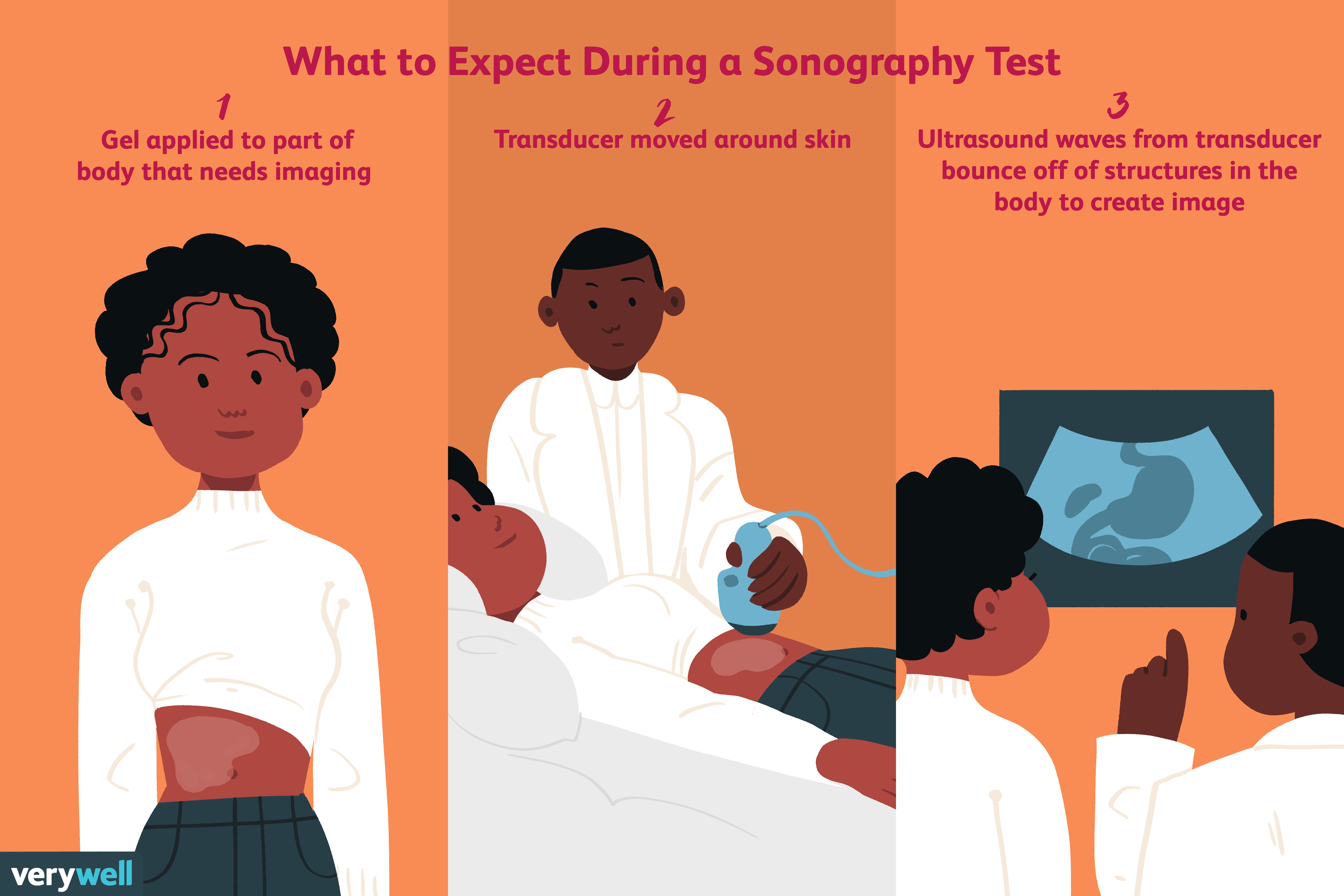 Mitä on sonografia?
Sonografia on diagnostinen lääketieteellinen testi, joka käyttää korkeataajuisia ääniaaltoja, joita kutsutaan myös ultraääniaalloiksi, pomppimaan kehon rakenteista ja luomaan kuvan. Testiä kutsutaan s
Mitä on sonografia?
Sonografia on diagnostinen lääketieteellinen testi, joka käyttää korkeataajuisia ääniaaltoja, joita kutsutaan myös ultraääniaalloiksi, pomppimaan kehon rakenteista ja luomaan kuvan. Testiä kutsutaan s
 Vähentääkö valkosipuli syöpäriskiäsi?
Valkosipulilla on muitakin etuja kuin ruoan maustaminen. Se sisältää antibakteerisia ja antioksidanttisia ominaisuuksia. Se on myös yhdistetty pienentyneeseen riskiin sairastua tiettyihin syöpiin. Vai
Vähentääkö valkosipuli syöpäriskiäsi?
Valkosipulilla on muitakin etuja kuin ruoan maustaminen. Se sisältää antibakteerisia ja antioksidanttisia ominaisuuksia. Se on myös yhdistetty pienentyneeseen riskiin sairastua tiettyihin syöpiin. Vai
 "Muokkaamalla ruokavaliotasi voit myös muokata mikrobejasi":Clara Belzerin haastattelu
Yhä useammat tieteelliset tutkimukset osoittavat, että ruokavalio voi vaikuttaa terveyteen suoliston mikrobiston kautta. Moduloimalla ruokavaliotasi voit myös muokata mikrobejasi. Mikrobit voivat myöt
"Muokkaamalla ruokavaliotasi voit myös muokata mikrobejasi":Clara Belzerin haastattelu
Yhä useammat tieteelliset tutkimukset osoittavat, että ruokavalio voi vaikuttaa terveyteen suoliston mikrobiston kautta. Moduloimalla ruokavaliotasi voit myös muokata mikrobejasi. Mikrobit voivat myöt