MIÉRCOLES, 1 de febrero (HealthDay News) -- La aprobación de la Administración de Alimentos y Medicamentos (FDA) de EE. UU. para el fármaco de Novartis Gleevec se ha ampliado para incluir a adultos que se han sometido a la extirpación quirúrgica de tumores del estroma gastrointestinal (GIST) positivos para CD117, dijo la agencia en un comunicado de prensa. liberar.
GIST es un cáncer raro que se forma en las células que recubren las paredes del tracto GI, incluido el estómago. Tales células juegan un papel en la digestión de los alimentos y otros procesos corporales, dijo la FDA.
Gleevec, aprobado por primera vez en 2001 para tratar una enfermedad genética llamada leucemia mieloide crónica con cromosoma Filadelfia positivo, ha sido sancionado posteriormente para varias formas de GIST.
La etiqueta de Gleevec se actualizará para incluir los resultados de estudios clínicos sobre GIST positivo para CD117. El medicamento aumentó significativamente la supervivencia del paciente cuando se tomó durante 36 meses, en comparación con los 12 meses estándar, dijo la FDA.
Los efectos secundarios clínicos comunes de Gleevec incluyeron hinchazón, náuseas y vómitos, calambres musculares, dolor óseo o muscular, diarrea, sarpullido, fatiga y dolor abdominal.
Novartis tiene su sede en East Hanover, Nueva Jersey.
-- Scott Roberts
 Copyright © 2012 HealthDay. Todos los derechos reservados.
Copyright © 2012 HealthDay. Todos los derechos reservados.
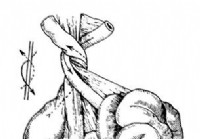 Torsión del ciego - Diagnóstico de abdomen agudo
Además de las torsiones, en este departamento de la vía intestinal aún existen otras Se observan las formas de la impracticabilidad que surgen de los excesos distintos ciego y los intestinos que ascie
Torsión del ciego - Diagnóstico de abdomen agudo
Además de las torsiones, en este departamento de la vía intestinal aún existen otras Se observan las formas de la impracticabilidad que surgen de los excesos distintos ciego y los intestinos que ascie
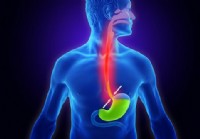 ¿Cómo te hace sentir el reflujo ácido? 10 síntomas comunes
¿Qué es el reflujo ácido? El reflujo ácido (ERGE, acidez estomacal) ocurre cuando el ácido del estómago termina regresando al esófago. Los síntomas más comunes incluyen problemas para tragar, dolor
¿Cómo te hace sentir el reflujo ácido? 10 síntomas comunes
¿Qué es el reflujo ácido? El reflujo ácido (ERGE, acidez estomacal) ocurre cuando el ácido del estómago termina regresando al esófago. Los síntomas más comunes incluyen problemas para tragar, dolor
 Evite las dietas de moda para ayudar a su intestino
Las dietas de moda han existido durante décadas y, una y otra vez, han demostrado ser solo eso:una moda pasajera. Según el diccionario, el término moda se define como “una moda, noción, modo de conduc
Evite las dietas de moda para ayudar a su intestino
Las dietas de moda han existido durante décadas y, una y otra vez, han demostrado ser solo eso:una moda pasajera. Según el diccionario, el término moda se define como “una moda, noción, modo de conduc