SZERDA, február 1. (HealthDay News) – Az Egyesült Államok Élelmiszer- és Gyógyszerügyi Hatósága a Novartis Gleevec gyógyszerre vonatkozó engedélyét kiterjesztette azokra a felnőttekre is, akiknél a CD117-pozitív gasztrointesztinális stromadaganatok (GIST) műtéti eltávolítását végezték el – áll az ügynökség hírében. kiadás.
A GIST egy ritka rák, amely a gyomor-bél traktus falát borító sejtekben alakul ki, beleértve a gyomrot is. Az ilyen sejtek szerepet játszanak az élelmiszer-emésztésben és más testi folyamatokban, mondta az FDA.
A Gleevec-et, amelyet először 2001-ben engedélyeztek a Philadelphia kromoszóma pozitív krónikus mieloid leukémia nevű genetikai betegség kezelésére, a későbbiekben a GIST számos formája miatt szankcionálták.
A Gleevec címkéjét frissíteni fogják, hogy az tartalmazza a CD117-pozitív GIST-re vonatkozó klinikai vizsgálati eredményeket. A gyógyszer szignifikánsan növelte a betegek túlélését, ha 36 hónapig szedték a szokásos 12 hónaphoz képest, mondta az FDA.
A Gleevec gyakori klinikai mellékhatásai közé tartozik a duzzanat, hányinger és hányás, izomgörcsök, csont- vagy izomfájdalom, hasmenés, bőrkiütés, fáradtság és hasi fájdalom.
A Novartis székhelye East Hannover, N.J.
-- Scott Roberts
 Szerzői jog © 2012 HealthDay. Minden jog fenntartva.
Szerzői jog © 2012 HealthDay. Minden jog fenntartva.
 A bőrön talált gyakori gomba gyulladásos bélbetegséget okozhat
A bőrön talált gyakori gomba gyulladásos bélbetegséget okozhat
 Ezen élelmiszertípusok visszaszorítása jelentősen csökkentheti a savas reflux előfordulását
Ezen élelmiszertípusok visszaszorítása jelentősen csökkentheti a savas reflux előfordulását
 A szájüregi mikrobióta diszbiózisa bél- és egészségügyi problémákat okoz
A szájüregi mikrobióta diszbiózisa bél- és egészségügyi problémákat okoz
 Csatlakozzunk a SIBO-val
Csatlakozzunk a SIBO-val
 Megnagyobbodott lép (splenomegalia) tünetei, jelei, okai és kezelése
Megnagyobbodott lép (splenomegalia) tünetei, jelei, okai és kezelése
 Fájdalom nélkül is előfordulhat IBS?
Fájdalom nélkül is előfordulhat IBS?
 Karácsonyi habcsókfa recept
Már majdnem készen vagyunk, a gyerekek elkezdenek a harisnya felakasztásán gondolkodni, a barátok és a család gyülekezni kezd, és minden becsomagolt ajándékunk és kártyalapunk hatására egyre nagyobb a
Karácsonyi habcsókfa recept
Már majdnem készen vagyunk, a gyerekek elkezdenek a harisnya felakasztásán gondolkodni, a barátok és a család gyülekezni kezd, és minden becsomagolt ajándékunk és kártyalapunk hatására egyre nagyobb a
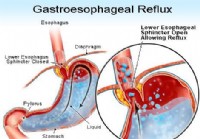 Az étkezésen túl:mi váltja ki a gyomorégést és a GERD-t?
Mi váltja ki a gyomorégést? Gastrooesophagealis reflux betegségben (GERD) a LES nem zár megfelelően, így lehetővé teszi a gyomortartalom visszaszivárgását vagy visszafolyását az ételcsőbe, és irrit
Az étkezésen túl:mi váltja ki a gyomorégést és a GERD-t?
Mi váltja ki a gyomorégést? Gastrooesophagealis reflux betegségben (GERD) a LES nem zár megfelelően, így lehetővé teszi a gyomortartalom visszaszivárgását vagy visszafolyását az ételcsőbe, és irrit
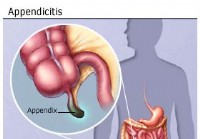 Emésztőrendszeri betegségek:Vakbélgyulladás
Mi az a vakbélgyulladás? Mi okoz vakbélgyulladást? Mik a vakbélgyulladás tünetei? Hogyan diagnosztizálják a vakbélgyulladást? Hogyan kezelik a vakbélgyulladást? Megelőzhető a vakbélgyulladás? Mi az
Emésztőrendszeri betegségek:Vakbélgyulladás
Mi az a vakbélgyulladás? Mi okoz vakbélgyulladást? Mik a vakbélgyulladás tünetei? Hogyan diagnosztizálják a vakbélgyulladást? Hogyan kezelik a vakbélgyulladást? Megelőzhető a vakbélgyulladás? Mi az