Новое исследование было проведено на группе из 32 крайне недоношенных новорожденных, которым пришлось оставаться на антибактериальной терапии в течение 21 месяца. другая группа из 9 младенцев, которые принимали антибиотики в течение недели или меньше, но также были крайне недоношенными, и контрольная группа из 17 новорожденных, рожденных доношенными или поздно недоношенными, которые не получали антибиотики (или «не принимали антибиотики»). Ученые использовали комбинацию секвенирования ДНК, культуры и компьютерные алгоритмы для понимания микробиома кишечника и типа генов устойчивости, экспрессируемых у этих недоношенных детей, которые подвергались воздействию антибиотиков как во время, так и после пребывания в больнице. Это сравнивали с микробиомом кишечника здоровых детей, которым никогда не давали антибиотики.
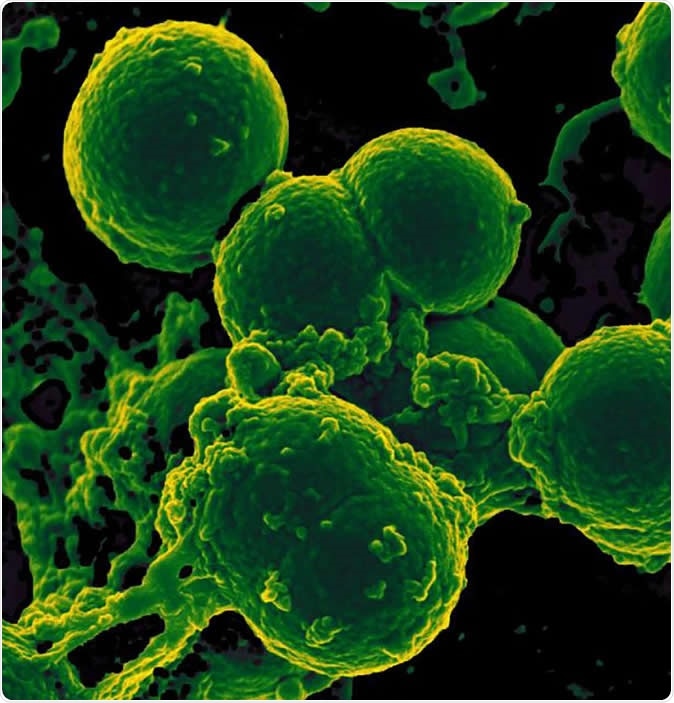 Сканирующая электронная микрофотография нейтрофилов, принимающих метициллин-устойчивые бактерии Staphylococcus aureus. Изображение предоставлено NIAID.
Сканирующая электронная микрофотография нейтрофилов, принимающих метициллин-устойчивые бактерии Staphylococcus aureus. Изображение предоставлено NIAID. Результаты показали, что количество видов бактерий у младенцев, получавших длительную антибактериальную терапию, было значительно снижено по сравнению с группой, не получавшей антибиотики. Во-вторых, количество генов кишечных бактерий, проявляющих устойчивость к антибиотикам, было намного выше в этой группе. Кроме того, некоторые из этих генов устойчивости были направлены против лекарств, которым ребенок никогда не подвергался - поскольку они обычно не используются у новорожденных, как ципрофлоксацин или хлорамфеникол. Исследователи предполагают, что эти гены, возможно, произошли от бактерий с множественной лекарственной устойчивостью. В этом случае, воздействие одного из препаратов, к которому бактерия устойчива, может привести к уничтожению других видов, оставляя устойчивый штамм размножаться. Кроме того, ребенок также будет проявлять резистентность к другим лекарствам из-за множественной резистентности, обеспечиваемой геном, независимо от того, использовались ли эти лекарства у этого пациента или нет.
Опять таки, более ранние исследования показывают связь между кожной аллергией, сахарный диабет, воспалительное заболевание кишечника, ожирение и псориаз, и использование антибиотиков в молодом возрасте. Эффект может быть незначительным, но он также может способствовать росту патогенных видов в кишечнике. одновременно подавляя рост «хороших» бактерий.
Эти изменения в геноме исследователи называют «шрамами микробиоты». Более ранние исследования показали связь между аллергическими кожными заболеваниями, такими как псориаз или кожная аллергия, диабет, ожирение и воспалительные заболевания кишечника, и лечение антибиотиками в течение первого года жизни.
Общий, у младенцев, получавших антибиотики в течение продолжительного периода времени, не развивался богатый и разнообразный микробиом кишечника, как у младенцев, ранее не принимавших антибиотики. Младенцы, подвергшиеся воздействию антибиотиков, также выделяют энтеробактерии, оппортунистический патоген, который был, в этом случае, лекарственно устойчивый. Таким образом, виды, которые поселились в кишечнике этих младенцев, были обусловлены их устойчивостью к антибиотикам. Микробиом кишечника может быть несбалансированным в пользу патогенных видов, и резистентные инфекции могут возникать у этих детей с большей легкостью из-за их более высокого резистома (общего скопления генов устойчивости к антибиотикам).
По словам исследователей, «Сопутствующий ущерб от лечения антибиотиками в раннем возрасте и госпитализации недоношенных детей является длительным. Мы настоятельно призываем разработать стратегии по уменьшению этих последствий в очень уязвимых неонатальных популяциях ».
Статья опубликована в журнале. Природная микробиология 9 сентября, 2019.
 Белок SARS-CoV N вызывает выработку IFN-β, провоцируя убиквитинирование RIG-I,
Белок SARS-CoV N вызывает выработку IFN-β, провоцируя убиквитинирование RIG-I,
 Микробиом спермы выявлен с помощью секвенирования РНК
Микробиом спермы выявлен с помощью секвенирования РНК
 Perfectus Biomed примет участие в конференции IPS в Ливерпуле
Perfectus Biomed примет участие в конференции IPS в Ливерпуле
 Чистящие средства могут повысить риск детской астмы - результаты исследования
Чистящие средства могут повысить риск детской астмы - результаты исследования
 Диабет 1 типа связан с микробиомом кишечника и генетическими факторами
Диабет 1 типа связан с микробиомом кишечника и генетическими факторами
 Антиоксиданты в рационе могут повысить риск рака кишечника.
Антиоксиданты в рационе могут повысить риск рака кишечника.
 Основные моменты и ключевые выводы Бостонской конференции по бактериям 2019 г. (BBM)
Boston Bacterial Meeting (BBM) - это ежегодная конференция, на которую собираются специалисты-бактериологи из Бостона и всего мира. Его 25 th итерация проходила с 6 июня th и 7 июня th , 2019, в
Основные моменты и ключевые выводы Бостонской конференции по бактериям 2019 г. (BBM)
Boston Bacterial Meeting (BBM) - это ежегодная конференция, на которую собираются специалисты-бактериологи из Бостона и всего мира. Его 25 th итерация проходила с 6 июня th и 7 июня th , 2019, в
 Научный симпозиум в LABVOLUTION посвящен ключевым вопросам наук о жизни
Научный симпозиум LABVOLUTION будет посвящен ключевым вопросам наук о жизни. Соответственно, ожидается высокий уровень спроса со стороны посетителей. Научный симпозиум дебютирует в LABVOL
Научный симпозиум в LABVOLUTION посвящен ключевым вопросам наук о жизни
Научный симпозиум LABVOLUTION будет посвящен ключевым вопросам наук о жизни. Соответственно, ожидается высокий уровень спроса со стороны посетителей. Научный симпозиум дебютирует в LABVOL
 Микробиом человека сокращает гликаны слизистых оболочек,
влияние на инфекцию SARS-CoV-2 Международная группа исследователей провела исследование, показывающее, что различия в микробиоме человека могут влиять на способность коронавируса 2 (SARS-CoV-2) инфици
Микробиом человека сокращает гликаны слизистых оболочек,
влияние на инфекцию SARS-CoV-2 Международная группа исследователей провела исследование, показывающее, что различия в микробиоме человека могут влиять на способность коронавируса 2 (SARS-CoV-2) инфици