Hun studie getiteld, “Thiopurines activeren een antivirale ongevouwen eiwitrespons die de ophoping van virale glycoproteïne in het celcultuurinfectiemodel blokkeert, ” werd online gepubliceerd als pre-print op de site bioRxiv* .
De onderzoekers legden uit dat virussen die zijn omhuld, zoals het coronavirus, genetisch materiaal hebben dat kan coderen voor membraaneiwitten die kunnen worden gesynthetiseerd en gemodificeerd in het endoplasmatisch reticulum (ER) voordat ze kunnen worden getransporteerd naar de assemblagegebieden van de delen van het virion.
Als de vouwcapaciteit van het ER-eiwit wordt overweldigd door te veel viriondeeltjes, er is een overbelasting van ongevouwen eiwitten in het ER. Dit veroorzaakt een ongevouwen eiwitrespons (UPR). Dit activeert de transcriptiefactor-6 (ATF6), inositol waarvoor enzym-1 (IRE1) en PKR-achtig endoplasmatisch reticulumkinase (PERK) nodig zijn. Deze kunnen voelen dat de ER onder stress staat, en er is dus een synthese van basische leucine zipper (bZIP) transcriptiefactoren.
Naarmate de UPR wordt geactiveerd, de eiwitvouwcapaciteit van het ER wordt verhoogd. Dit veroorzaakt ook de ER-geassocieerde degradatie (ERAD). Alle eiwitten die niet goed gevouwen zijn, worden uit het ER gehaald en afgebroken via het 26S-proteasoom.
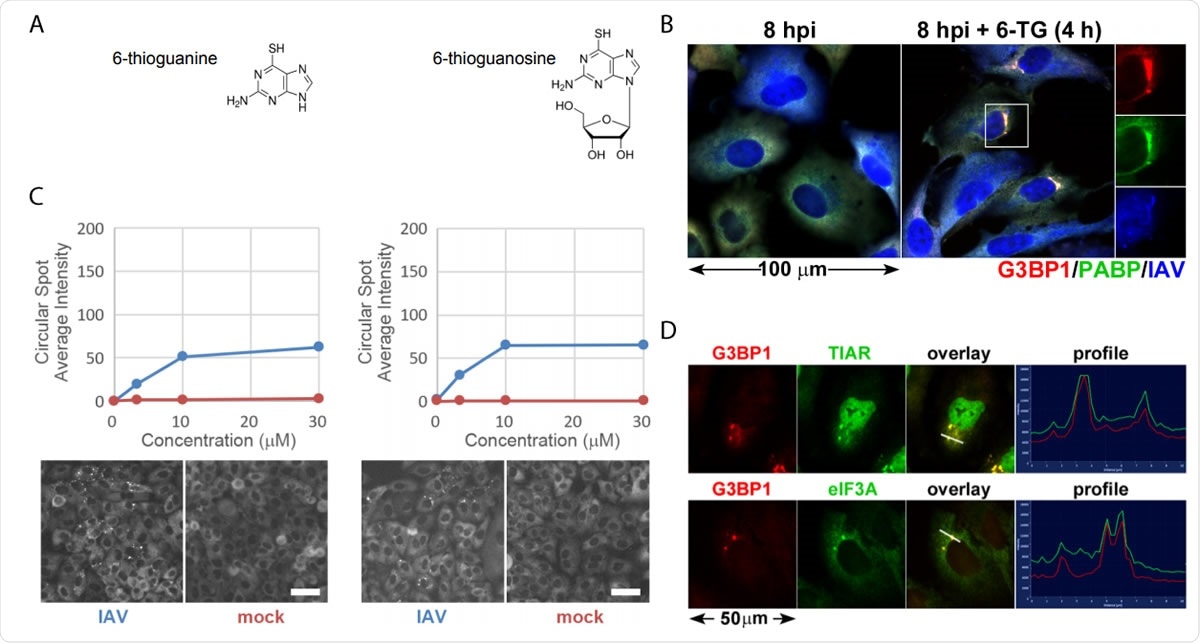 Thiopurine-analogen 6-TG en 6-TGo induceren selectief stresskorrels in met IAV geïnfecteerde cellen. (A) structurele diagrammen van kleine moleculen geïdentificeerd in het scherm. (B) Kwantificering van de vorming van EGFP-G3BP-foci in met IAV-Udorn geïnfecteerde (blauwe) of nep (rode) geïnfecteerde cellen behandeld met toenemende doses 6-TG en 6-TGo (boven) en representatieve Cellomics-beelden van EGFP-kanaal van behandelde cellen met 30 µM 6-TG en 6-TGo (onder). Bij 4 pk, cellen werden behandeld met 0, 1, Doses van 10 en 30 uM thiopurine-analogen 6-thioguanine (6-TG) of 6-thioguanosine (6-TGo). Bij 8 pk, cellen werden gefixeerd en gekleurd met Hoeschst 33342. Geautomatiseerde beeldopname werd uitgevoerd met behulp van een Cellomics Arrayscan VTI HCS-lezer. Voor elk putje werden 15 beelden vastgelegd en de gemiddelde intensiteit van de puntvormige EGFP-G3BP1 werd berekend. (C) A549-cellen werden geïnfecteerd met IAV-CA/07 bij een MOI van 1. Bij 4 hpi, cellen werden behandeld met 6-TG of schijnbehandeld. Bij 8 pk, cellen werden gefixeerd en immunologisch gekleurd met antilichamen gericht tegen stressgranule marker-eiwitten G3BP1 (rood), PABP (groen) en een polyklonaal IAV-antilichaam (blauw) dat antigenen van NP detecteert, M1, en HA, gevolgd door kleuring met Alexa-geconjugeerde secundaire antilichamen. (D) A549-cellen werden geïnfecteerd met IAV-CA/07 bij een MOI van 1. Bij 4 hpi, cellen werden behandeld met 6-TG (10 µM). Bij 8 pk, cellen werden gefixeerd en immunologisch gekleurd met antilichamen gericht tegen stressgranule marker-eiwitten G3BP1 (rood), TIAR (groen) en eIF3A (groen), gevolgd door kleuring met Alexa-geconjugeerde secundaire antilichamen. Beelden vastgelegd op een Zeiss Axioimager Z2 fluorescentiemicroscoop. Representatieve afbeeldingen getoond. Schaalbalken vertegenwoordigen 20 µm.
Thiopurine-analogen 6-TG en 6-TGo induceren selectief stresskorrels in met IAV geïnfecteerde cellen. (A) structurele diagrammen van kleine moleculen geïdentificeerd in het scherm. (B) Kwantificering van de vorming van EGFP-G3BP-foci in met IAV-Udorn geïnfecteerde (blauwe) of nep (rode) geïnfecteerde cellen behandeld met toenemende doses 6-TG en 6-TGo (boven) en representatieve Cellomics-beelden van EGFP-kanaal van behandelde cellen met 30 µM 6-TG en 6-TGo (onder). Bij 4 pk, cellen werden behandeld met 0, 1, Doses van 10 en 30 uM thiopurine-analogen 6-thioguanine (6-TG) of 6-thioguanosine (6-TGo). Bij 8 pk, cellen werden gefixeerd en gekleurd met Hoeschst 33342. Geautomatiseerde beeldopname werd uitgevoerd met behulp van een Cellomics Arrayscan VTI HCS-lezer. Voor elk putje werden 15 beelden vastgelegd en de gemiddelde intensiteit van de puntvormige EGFP-G3BP1 werd berekend. (C) A549-cellen werden geïnfecteerd met IAV-CA/07 bij een MOI van 1. Bij 4 hpi, cellen werden behandeld met 6-TG of schijnbehandeld. Bij 8 pk, cellen werden gefixeerd en immunologisch gekleurd met antilichamen gericht tegen stressgranule marker-eiwitten G3BP1 (rood), PABP (groen) en een polyklonaal IAV-antilichaam (blauw) dat antigenen van NP detecteert, M1, en HA, gevolgd door kleuring met Alexa-geconjugeerde secundaire antilichamen. (D) A549-cellen werden geïnfecteerd met IAV-CA/07 bij een MOI van 1. Bij 4 hpi, cellen werden behandeld met 6-TG (10 µM). Bij 8 pk, cellen werden gefixeerd en immunologisch gekleurd met antilichamen gericht tegen stressgranule marker-eiwitten G3BP1 (rood), TIAR (groen) en eIF3A (groen), gevolgd door kleuring met Alexa-geconjugeerde secundaire antilichamen. Beelden vastgelegd op een Zeiss Axioimager Z2 fluorescentiemicroscoop. Representatieve afbeeldingen getoond. Schaalbalken vertegenwoordigen 20 µm. Wanneer het virusdeeltje een cel binnendringt, het probeert snel te repliceren, en dit belast de ER. Het virus geeft uitbarstingen van glycoproteïnen vrij die het ER overweldigen. Het virus, echter, is in staat om de UPR te omzeilen en bevordert een efficiënte replicatie.
De IAV kan coderen voor drie integrale membraaneiwitten:hemagglutinine (HA), neuraminidase (NA), en matrixeiwit 2 (M2). Terwijl de IAV-replicatie selectieve activering van de UPR veroorzaakt, specifieke mechanismen kunnen de UPR activeren, maar deze vervolgens omzeilen om effectieve virale replicatie te bevorderen. Het team legt uit dat de effecten van NA- en M2-eiwitten op UPR niet duidelijk zijn, maar HA kan UPR bevorderen.
Verschillende coronavirussen (CoV's) kunnen UPR activeren. Dit omvat het “infectieuze bronchitisvirus (IBV), muizenhepatitisvirus (MHV), overdraagbaar gastro-enteritisvirus (TGEV), humaan coronavirus (HCoV)-OC43, en SARS-CoV-1.” Het geheel van de genetische sequentie, echter, reageert niet op dezelfde manier op de CoV-replicatie.
Het team identificeerde twee door de FDA goedgekeurde thiopurine-analogen genaamd "6-thioguanine (6-TG) en 6-thioguanosine (6-TGo)". Deze bleken IAV- en HCoV-OC43-replicatie te blokkeren wanneer hun dosis stapsgewijs werd verhoogd.
Pateamine A en Silvestrol waren eerder getest. Deze twee thiopurines, echter, bleken het proces van accumulatie van virale glycoproteïnen die de UPR zouden kunnen activeren, te verstoren. In de cellen die waren behandeld met 6-TG, de virale glycoproteïnesynthese zou gedeeltelijk kunnen worden hersteld door de chemische remming van de UPR.
CoV Spike (S)-eiwitten die tot expressie worden gebracht op het oppervlak van het virus vertoonden UPR-activering. Het S-eiwit van het nieuwe coronavirus of SARS-CoV-2 S veroorzaakte ook UPR-activering. 6-TG remde de accumulatie van S0- of furine-gesplitste S2-fusie-eiwitten van volledige lengte, merkten ze op. Het had geen invloed op het S1-ectodomein. 6-TG zou UPR kunnen induceren die ERAD-gemedieerde omzet van membraan-verankerde S0- en S2-glycoproteïnen versnelt, het team gevonden.
De onderzoekers experimenteerden en ontdekten dat een chemisch vergelijkbare verbinding thiopurine 6-mercaptopurine (6-MP) weinig effect had op UPR en geen invloed had op de replicatie van IAV HCoV-OC43.
Nadenken over het mechanisme van UPR-inductie door de thiopurineverbindingen 6-TG en 6-TGo, het team schreef dat deze effecten om verschillende redenen waarschijnlijk niet worden gemedieerd door DNA- of RNA-opname van 6-TG. De eerste reden is dat de stress die gepaard gaat met virale replicatie niet specifiek UPR induceert. De tweede reden is dat onder virale eiwitten, de accumulatie van glycoproteïnen en hun verwerking werd selectief verstoord. De derde reden was dat de boodschapper-RNA-niveaus van HA en NA in de IAV niet significant werden beïnvloed. 6 MP, anderzijds, kan worden omgezet in 6-thioguanosinetrifosfaat maar induceerde geen UPR en had geen effect op IAV-glycoproteïnen of OC43-replicatie.
Het team schreef dat hun gegevens onthullen dat "UPR-inducerende moleculen effectieve gastheergerichte antivirale middelen kunnen zijn tegen virussen die afhankelijk zijn van ER-processen om efficiënte replicatie te ondersteunen." Inductie van UPR door 6-TG en 6-TGo zou dus een nieuwe methode kunnen zijn waarmee een antiviraal mechanisme door de gastheercel zelf zou kunnen worden geactiveerd. Dit is een voorheen niet herkend uniek werkingsmechanisme, schreef het team.
Ze schreven tot slot, "... deze gegevens geven aan dat 6-TG en 6-TGo effectieve gastheergerichte antivirale middelen zijn die de UPR activeren en de accumulatie van virale glycoproteïnen verstoren."
medRxiv publiceert voorlopige wetenschappelijke rapporten die niet door vakgenoten zijn beoordeeld en, daarom, mag niet als definitief worden beschouwd, begeleiden klinische praktijk/gezondheidsgerelateerd gedrag, of behandeld als gevestigde informatie.
 Plantaardig voedsel kan antibioticaresistente superbacteriën op mensen overbrengen
Plantaardig voedsel kan antibioticaresistente superbacteriën op mensen overbrengen
 Doe Maar,
Doe Maar,
 Spijsverteringsverschijnselen komen vaak voor maar zijn mild bij gehospitaliseerde COVID-19-patiënten
Spijsverteringsverschijnselen komen vaak voor maar zijn mild bij gehospitaliseerde COVID-19-patiënten
 Darmbacteriën kunnen het risico op pulmonale hypertensie voorspellen
Darmbacteriën kunnen het risico op pulmonale hypertensie voorspellen
 Diagnose van virale infecties met behulp van technologieën op micro- en nanoschaal
Diagnose van virale infecties met behulp van technologieën op micro- en nanoschaal
 Oude microbiomen van primaten kunnen meer informatie opleveren over menselijke ontwikkeling
Oude microbiomen van primaten kunnen meer informatie opleveren over menselijke ontwikkeling
 Melkzuurbacteriën en darmbacteriën dragen bij aan de gezondheidsvoordelen van rogge,
studie toont Het eten van rogge heeft verschillende gezondheidsvoordelen. Een nieuwe studie van de Universiteit van Oost-Finland toont nu aan dat zowel melkzuurbacteriën als darmbacteriën bijdragen aa
Melkzuurbacteriën en darmbacteriën dragen bij aan de gezondheidsvoordelen van rogge,
studie toont Het eten van rogge heeft verschillende gezondheidsvoordelen. Een nieuwe studie van de Universiteit van Oost-Finland toont nu aan dat zowel melkzuurbacteriën als darmbacteriën bijdragen aa
 Darmmicrobioom kan een rol spelen bij ernstige COVID-19
De huidige wereldwijde COVID-19-pandemie wordt veroorzaakt door bèta-coronavirus ernstig acuut respiratoir syndroom coronavirus-2 (SARS-CoV-2), die meer dan 22,1 miljoen mensen heeft besmet en wereldw
Darmmicrobioom kan een rol spelen bij ernstige COVID-19
De huidige wereldwijde COVID-19-pandemie wordt veroorzaakt door bèta-coronavirus ernstig acuut respiratoir syndroom coronavirus-2 (SARS-CoV-2), die meer dan 22,1 miljoen mensen heeft besmet en wereldw
 Langdurig gebruik van antibiotica bij prematuren bevordert resistente darmbacteriën
Zeer premature babys zijn vaak ziek en hebben een antibioticabehandeling nodig om hun leven te redden. Echter, wanneer deze vorm van therapie 20 maanden of langer duurt, het kan het darmmicrobioom op
Langdurig gebruik van antibiotica bij prematuren bevordert resistente darmbacteriën
Zeer premature babys zijn vaak ziek en hebben een antibioticabehandeling nodig om hun leven te redden. Echter, wanneer deze vorm van therapie 20 maanden of langer duurt, het kan het darmmicrobioom op