Ihre Studie mit dem Titel „Thiopurine aktivieren eine antivirale ungefaltete Proteinantwort, die die Ansammlung von viralen Glykoproteinen im Zellkulturinfektionsmodell blockiert, “ wurde online als Pre-Print auf der Website veröffentlicht bioRxiv* .
Die Forscher erklärten, dass Viren, die umhüllt sind, wie das Coronavirus, verfügen über genetisches Material, das für Membranproteine kodieren kann, die im endoplasmatischen Retikulum (ER) synthetisiert und modifiziert werden können, bevor sie in die Bereiche des Zusammenbaus der Teile des Virions transportiert werden können.
Wenn die Faltungskapazität des ER-Proteins durch zu viele Virion-Partikel überfordert ist, es gibt eine Überladung von ungefalteten Proteinen im ER. Dies löst eine ungefaltete Proteinantwort (UPR) aus. Dadurch wird der Transkriptionsfaktor-6 (ATF6) aktiviert, Inositol, das Enzym-1 (IRE1) und PKR-ähnliche endoplasmatische Retikulumkinase (PERK) benötigt. Diese können spüren, dass die Notaufnahme unter Stress steht, und es gibt somit eine Synthese von basischen Leucin-Zipper (bZIP)-Transkriptionsfaktoren.
Wenn der UPR aktiviert wird, die Proteinfaltungskapazität des ER wird erhöht. Dies löst auch den ER-assoziierten Abbau (ERAD) aus. Alle nicht richtig gefalteten Proteine werden aus dem ER herausgeholt und über das 26S-Proteasom abgebaut.
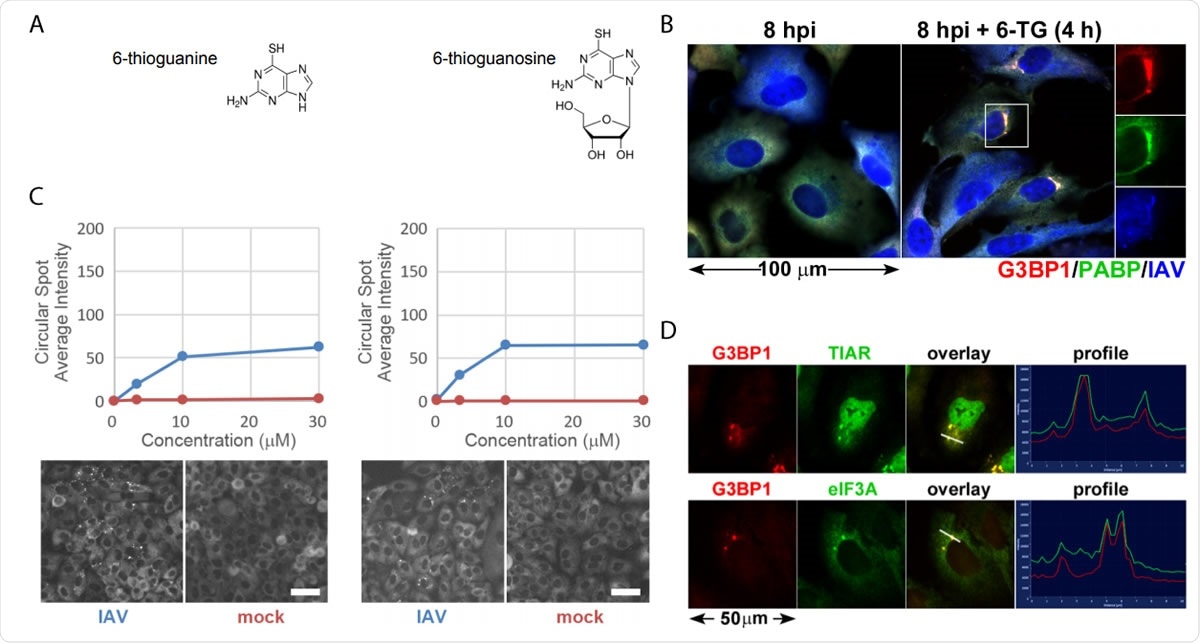 Die Thiopurin-Analoga 6-TG und 6-TGo induzieren selektiv Stress-Granula in IAV-infizierten Zellen. (A) Strukturdiagramme von kleinen Molekülen, die auf dem Bildschirm identifiziert wurden. (B) Quantifizierung der EGFP-G3BP-Foci-Bildung in IAV-Udorn-infizierten (blau) oder scheininfizierten (rot) infizierten Zellen, die mit steigenden Dosen von 6-TG und 6-TGo behandelt wurden (oben) und repräsentative Cellomics-Bilder des EGFP-Kanals von behandelten Zellen mit 30 µM 6-TG und 6-TGo (unten). Bei 4 PS, Zellen wurden mit 0 behandelt, 1, 10 und 30 uM Dosen der Thiopurin-Analoga 6-Thioguanin (6-TG) oder 6-Thioguanosin (6-TGo). Bei 8 PS, Zellen wurden fixiert und mit Hoeschst 33342 gefärbt. Die automatische Bilderfassung wurde unter Verwendung eines Cellomics Arrayscan VTI HCS-Readers durchgeführt. Für jede Vertiefung wurden 15 Bilder aufgenommen und die durchschnittliche punktförmige EGFP-G3BP1-Intensität wurde berechnet. (C) A549-Zellen wurden mit IAV-CA/07 bei einer MOI von 1 infiziert. Bei 4 hpi Zellen wurden mit 6-TG behandelt oder scheinbehandelt. Bei 8 PS, Zellen wurden fixiert und mit Antikörpern immungefärbt, die gegen die Stress-Granula-Markerproteine G3BP1 (rot) gerichtet waren, PABP (grün) und ein polyklonaler IAV-Antikörper (blau), der Antigene von NP erkennt, M1, und HA, gefolgt von einer Färbung mit Alexa-konjugierten sekundären Antikörpern. (D) A549-Zellen wurden mit IAV-CA/07 bei einer MOI von 1 infiziert. Bei 4 hpi Zellen wurden mit 6-TG (10 uM) behandelt. Bei 8 PS, Zellen wurden fixiert und mit Antikörpern immungefärbt, die gegen die Stress-Granula-Markerproteine G3BP1 (rot) gerichtet waren, TIAR (grün) und eIF3A (grün), gefolgt von einer Färbung mit Alexa-konjugierten sekundären Antikörpern. Bilder, die mit einem Zeiss Axioimager Z2 Fluoreszenzmikroskop aufgenommen wurden. Repräsentative Bilder gezeigt. Maßstabsbalken repräsentieren 20 µm.
Die Thiopurin-Analoga 6-TG und 6-TGo induzieren selektiv Stress-Granula in IAV-infizierten Zellen. (A) Strukturdiagramme von kleinen Molekülen, die auf dem Bildschirm identifiziert wurden. (B) Quantifizierung der EGFP-G3BP-Foci-Bildung in IAV-Udorn-infizierten (blau) oder scheininfizierten (rot) infizierten Zellen, die mit steigenden Dosen von 6-TG und 6-TGo behandelt wurden (oben) und repräsentative Cellomics-Bilder des EGFP-Kanals von behandelten Zellen mit 30 µM 6-TG und 6-TGo (unten). Bei 4 PS, Zellen wurden mit 0 behandelt, 1, 10 und 30 uM Dosen der Thiopurin-Analoga 6-Thioguanin (6-TG) oder 6-Thioguanosin (6-TGo). Bei 8 PS, Zellen wurden fixiert und mit Hoeschst 33342 gefärbt. Die automatische Bilderfassung wurde unter Verwendung eines Cellomics Arrayscan VTI HCS-Readers durchgeführt. Für jede Vertiefung wurden 15 Bilder aufgenommen und die durchschnittliche punktförmige EGFP-G3BP1-Intensität wurde berechnet. (C) A549-Zellen wurden mit IAV-CA/07 bei einer MOI von 1 infiziert. Bei 4 hpi Zellen wurden mit 6-TG behandelt oder scheinbehandelt. Bei 8 PS, Zellen wurden fixiert und mit Antikörpern immungefärbt, die gegen die Stress-Granula-Markerproteine G3BP1 (rot) gerichtet waren, PABP (grün) und ein polyklonaler IAV-Antikörper (blau), der Antigene von NP erkennt, M1, und HA, gefolgt von einer Färbung mit Alexa-konjugierten sekundären Antikörpern. (D) A549-Zellen wurden mit IAV-CA/07 bei einer MOI von 1 infiziert. Bei 4 hpi Zellen wurden mit 6-TG (10 uM) behandelt. Bei 8 PS, Zellen wurden fixiert und mit Antikörpern immungefärbt, die gegen die Stress-Granula-Markerproteine G3BP1 (rot) gerichtet waren, TIAR (grün) und eIF3A (grün), gefolgt von einer Färbung mit Alexa-konjugierten sekundären Antikörpern. Bilder, die mit einem Zeiss Axioimager Z2 Fluoreszenzmikroskop aufgenommen wurden. Repräsentative Bilder gezeigt. Maßstabsbalken repräsentieren 20 µm. Wenn das Viruspartikel in eine Zelle eindringt, es versucht sich schnell zu replizieren, und das belastet die ER. Das Virus setzt Ausbrüche von Glykoproteinen frei, die das ER überwältigen. Der Virus, jedoch, ist in der Lage, den UPR zu umgehen und fördert eine effiziente Replikation.
Das IAV kann drei integrale Membranproteine kodieren:Hämagglutinin (HA), Neuraminidase (NA), und Matrixprotein 2 (M2). Während die IAV-Replikation eine selektive Aktivierung des UPR bewirkt, spezifische Mechanismen können den UPR aktivieren, ihn dann aber umgehen, um eine effektive Virusreplikation zu fördern. Das Team erklärt, dass die Auswirkungen von NA- und M2-Proteinen auf UPR nicht klar sind. aber HA kann UPR fördern.
Mehrere Coronaviren (CoVs) können UPR aktivieren. Dazu gehört das „Virus der infektiösen Bronchitis (IBV), Maus-Hepatitis-Virus (MHV), übertragbares Gastroenteritis-Virus (TGEV), Humanes Coronavirus (HCoV)-OC43, und SARS-CoV-1.“ Die gesamte genetische Sequenz, jedoch, reagiert nicht ähnlich auf die CoV-Replikation.
Das Team identifizierte zwei von der FDA zugelassene Thiopurin-Analoga namens „6-Thioguanin (6-TG) und 6-Thioguanosin (6-TGo)“. Es wurde festgestellt, dass diese die Replikation von IAV und HCoV-OC43 blockieren, wenn ihre Dosis schrittweise erhöht wird.
Pateamin A und Silvestrol wurden zuvor getestet. Diese beiden Thiopurine, jedoch, Es wurde festgestellt, dass sie den Prozess der Akkumulation von viralen Glykoproteinen unterbrechen, die die UPR aktivieren könnten. In den Zellen, die mit 6-TG behandelt wurden, die virale Glykoproteinsynthese konnte durch die chemische Hemmung des UPR teilweise wiederhergestellt werden.
CoV-Spike (S)-Proteine, die auf der Oberfläche des Virus exprimiert werden, zeigten eine UPR-Aktivierung. Auch das S-Protein des neuartigen Coronavirus oder SARS-CoV-2 S verursachte eine UPR-Aktivierung. 6-TG hemmte die Akkumulation von S0-Fusionsproteinen voller Länge oder Furin-gespaltenen S2-Fusionsproteinen, sie bemerkten. Es hatte keinen Einfluss auf die S1-Ektodomäne. 6-TG könnte UPR induzieren, das den ERAD-vermittelten Umsatz von membranverankerten S0- und S2-Glykoproteinen beschleunigt, das Team gefunden.
Die Forscher experimentierten und fanden heraus, dass eine chemisch ähnliche Verbindung, Thiopurin-6-Mercaptopurin (6-MP) eine geringe Wirkung auf UPR hatte und die Replikation von IAV HCoV-OC43 nicht beeinflusste.
Nachdenken über den Mechanismus der UPR-Induktion durch die Thiopurinverbindungen 6-TG und 6-TGo, Das Team schrieb, dass diese Effekte aus verschiedenen Gründen wahrscheinlich nicht durch den DNA- oder RNA-Einbau von 6-TG vermittelt werden. Der erste Grund ist, dass der mit der Virusreplikation verbundene Stress nicht spezifisch UPR induziert. Der zweite Grund ist, dass unter den viralen Proteinen die Akkumulation von Glykoproteinen und deren Prozessierung wurde selektiv gestört. Der dritte Grund war, dass die Messenger-RNA-Spiegel von HA und NA im IAV nicht signifikant beeinflusst wurden. 6-MP, auf der anderen Seite, kann in 6-Thioguanosintriphosphat umgewandelt werden, induzierte jedoch keine UPR und hatte keine Auswirkungen auf die IAV-Glykoproteine oder die OC43-Replikation.
Das Team schrieb, dass ihre Daten zeigen, dass „UPR-induzierende Moleküle wirksame antivirale Mittel gegen den Wirt sein könnten, die auf ER-Prozesse angewiesen sind, um eine effiziente Replikation zu unterstützen“. Die Induktion von UPR durch 6-TG und 6-TGo könnte somit eine neue Methode sein, durch die ein antiviraler Mechanismus durch die Wirtszelle selbst ausgelöst werden könnte. Dies war ein bisher unbekannter einzigartiger Wirkmechanismus, schrieb das Team.
Sie schrieben abschließend, „...diese Daten zeigen, dass 6-TG und 6-TGo wirksame antivirale Wirkstoffe sind, die auf den Wirt abzielen, die UPR auslösen und die Ansammlung viraler Glykoproteine unterbrechen.“
medRxiv veröffentlicht vorläufige wissenschaftliche Berichte ohne Peer-Review und deshalb, sollte nicht als schlüssig angesehen werden, die klinische Praxis/das gesundheitsbezogene Verhalten anleiten, oder als etablierte Information behandelt.
 Starkes Mikrobiom im frühen Leben in Verbindung mit weniger Atemwegsinfektionen
Starkes Mikrobiom im frühen Leben in Verbindung mit weniger Atemwegsinfektionen
 Studie gibt Aufschluss über die Ursachen von schwächenden Darmschmerzen
Studie gibt Aufschluss über die Ursachen von schwächenden Darmschmerzen
 Die Hälfte der verwendeten Medikamente schädigt die Darmbakterien,
Die Hälfte der verwendeten Medikamente schädigt die Darmbakterien,
 Perfectus Biomed stellt auf der IPS-Konferenz in Liverpool aus
Perfectus Biomed stellt auf der IPS-Konferenz in Liverpool aus
 Neue Studie zeigt verbessertes Überleben von Patienten mit fortgeschrittenem kolorektalem BRAF-mutiertem Krebs
Neue Studie zeigt verbessertes Überleben von Patienten mit fortgeschrittenem kolorektalem BRAF-mutiertem Krebs
 Wenn Sie über 50 sind,
Wenn Sie über 50 sind,
 Spinnengiftpeptid könnte helfen, Schmerzen beim Reizdarmsyndrom zu stoppen
Forscher der University of Queensland haben herausgefunden, dass ein spezifisches Peptid, das im Spinnengift gefunden wird, Eigenschaften haben könnte, die es bei der Linderung von Schmerzen bei Patie
Spinnengiftpeptid könnte helfen, Schmerzen beim Reizdarmsyndrom zu stoppen
Forscher der University of Queensland haben herausgefunden, dass ein spezifisches Peptid, das im Spinnengift gefunden wird, Eigenschaften haben könnte, die es bei der Linderung von Schmerzen bei Patie
 Forscher identifizieren in vitro ein Bakterium mit Anti-SARS-CoV-2-Aktivität:Dolosigranulum pigrum
Das schwere akute respiratorische Syndrom Coronavirus 2 (SARS-CoV-2) hat weltweit über 173,3 Millionen Menschen infiziert. Von diesen, eine bedeutende Minderheit war schwerwiegend oder kritisch, weltw
Forscher identifizieren in vitro ein Bakterium mit Anti-SARS-CoV-2-Aktivität:Dolosigranulum pigrum
Das schwere akute respiratorische Syndrom Coronavirus 2 (SARS-CoV-2) hat weltweit über 173,3 Millionen Menschen infiziert. Von diesen, eine bedeutende Minderheit war schwerwiegend oder kritisch, weltw
 Sind DNA-basierte Diäten und personalisierte medizinische Lebensmittel die Zukunft für die Gewichtsabnahme?
Die meisten Menschen wissen, dass Gene von den Eltern geerbt werden und dass die DNA dieser Eltern kombiniert wird, um die einzigartige genetische Ausstattung eines Individuums zu schaffen. Dies besti
Sind DNA-basierte Diäten und personalisierte medizinische Lebensmittel die Zukunft für die Gewichtsabnahme?
Die meisten Menschen wissen, dass Gene von den Eltern geerbt werden und dass die DNA dieser Eltern kombiniert wird, um die einzigartige genetische Ausstattung eines Individuums zu schaffen. Dies besti