Leur étude intitulée, « Les thiopurines activent une réponse protéique antivirale dépliée qui bloque l'accumulation de glycoprotéines virales dans le modèle d'infection en culture cellulaire, ” a été publié en ligne en tant que pré-impression sur le site bioRxiv* .
Les chercheurs ont expliqué que les virus enveloppés, comme le coronavirus, possèdent du matériel génétique pouvant coder pour des protéines membranaires pouvant être synthétisées et modifiées dans le réticulum endoplasmique (RE) avant de pouvoir être transportées vers les zones d'assemblage des parties du virion.
Si la capacité de repliement de la protéine ER est dépassée par un trop grand nombre de particules de virion, il y a une surcharge de protéines dépliées dans le RE. Cela déclenche une réponse protéique dépliée (UPR). Cela active le facteur de transcription-6 (ATF6), l'inositol nécessitant l'enzyme-1 (IRE1) et la kinase du réticulum endoplasmique de type PKR (PERK). Ceux-ci peuvent sentir que le service d'urgence est stressé, et il y a donc une synthèse de facteurs de transcription basiques à glissière à leucine (bZIP).
Lorsque l'UPR est activé, la capacité de repliement des protéines du RE est augmentée. Cela déclenche également la dégradation associée au RE (ERAD). Toutes les protéines qui ne sont pas correctement repliées sont extraites du RE et dégradées via le protéasome 26S.
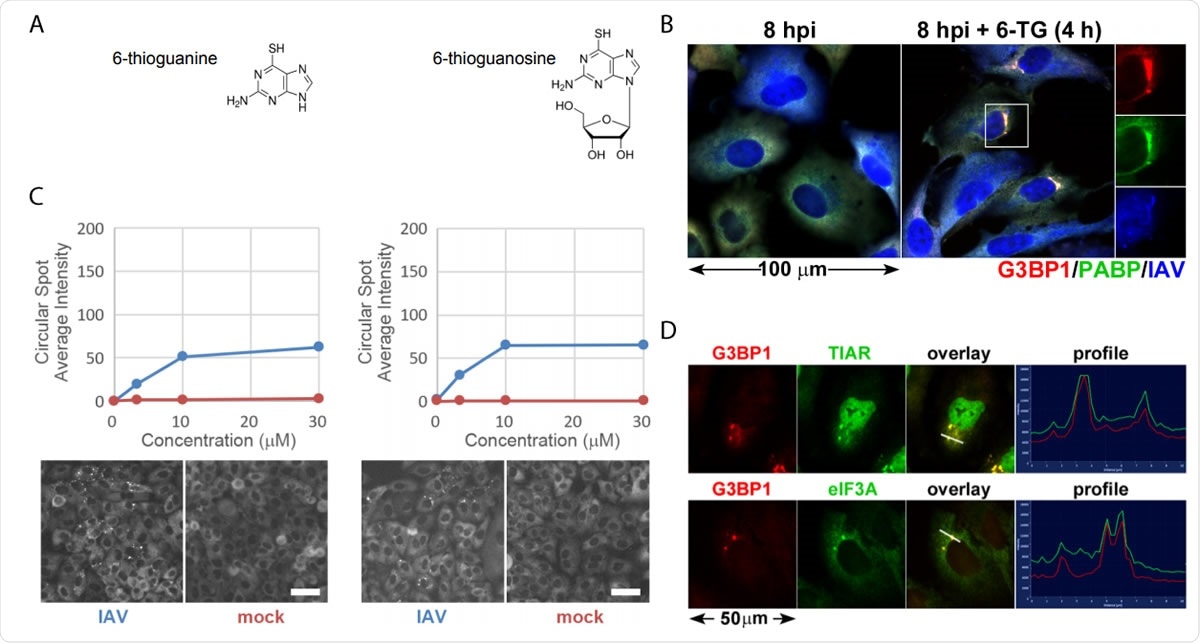 Les analogues de thiopurine 6-TG et 6-TGo induisent sélectivement des granules de stress dans les cellules infectées par IAV. (A) Diagrammes structurels de petites molécules identifiées dans l'écran. (B) Quantification de la formation de foyers EGFP-G3BP dans des cellules infectées par IAV-Udorn (bleu) ou simulées (rouge) traitées avec des doses croissantes de 6-TG et de 6-TGo (en haut) et des images Cellomics représentatives du canal EGFP des cellules traitées avec 30 µM de 6-TG et 6-TGo (en bas). A 4 hpi, les cellules ont été traitées avec 0, 1, Doses de 10 et 30 uM d'analogues de la thiopurine 6-thioguanine (6-TG) ou 6-thioguanosine (6-TGo). A 8 hpi, les cellules ont été fixées et colorées avec Hoeschst 33342. La capture d'image automatisée a été réalisée à l'aide d'un lecteur Cellomics Arrayscan VTI HCS. 15 images ont été capturées pour chaque puits et l'intensité moyenne ponctuée d'EGFP-G3BP1 a été calculée. (C) Les cellules A549 ont été infectées avec IAV-CA/07 à un MOI de 1. À 4 hpi, les cellules ont été traitées avec de la 6-TG ou traitées de manière fictive. A 8 hpi, les cellules ont été fixées et immunocolorées avec des anticorps dirigés contre les protéines marqueurs des granules de stress G3BP1 (rouge), PABP (vert) et un anticorps polyclonal IAV (bleu) qui détecte les antigènes de NP, M1, et HA, suivi d'une coloration avec des anticorps secondaires conjugués à Alexa. (D) Les cellules A549 ont été infectées avec IAV-CA/07 à un MOI de 1. À 4 hpi, les cellules ont été traitées avec de la 6-TG (10 uM). A 8 hpi, les cellules ont été fixées et immunocolorées avec des anticorps dirigés contre les protéines marqueurs des granules de stress G3BP1 (rouge), TIAR (vert) et eIF3A (vert), suivi d'une coloration avec des anticorps secondaires conjugués à Alexa. Images capturées sur un microscope à fluorescence Zeiss Axioimager Z2. Images représentatives montrées. Les barres d'échelle représentent 20 µm.
Les analogues de thiopurine 6-TG et 6-TGo induisent sélectivement des granules de stress dans les cellules infectées par IAV. (A) Diagrammes structurels de petites molécules identifiées dans l'écran. (B) Quantification de la formation de foyers EGFP-G3BP dans des cellules infectées par IAV-Udorn (bleu) ou simulées (rouge) traitées avec des doses croissantes de 6-TG et de 6-TGo (en haut) et des images Cellomics représentatives du canal EGFP des cellules traitées avec 30 µM de 6-TG et 6-TGo (en bas). A 4 hpi, les cellules ont été traitées avec 0, 1, Doses de 10 et 30 uM d'analogues de la thiopurine 6-thioguanine (6-TG) ou 6-thioguanosine (6-TGo). A 8 hpi, les cellules ont été fixées et colorées avec Hoeschst 33342. La capture d'image automatisée a été réalisée à l'aide d'un lecteur Cellomics Arrayscan VTI HCS. 15 images ont été capturées pour chaque puits et l'intensité moyenne ponctuée d'EGFP-G3BP1 a été calculée. (C) Les cellules A549 ont été infectées avec IAV-CA/07 à un MOI de 1. À 4 hpi, les cellules ont été traitées avec de la 6-TG ou traitées de manière fictive. A 8 hpi, les cellules ont été fixées et immunocolorées avec des anticorps dirigés contre les protéines marqueurs des granules de stress G3BP1 (rouge), PABP (vert) et un anticorps polyclonal IAV (bleu) qui détecte les antigènes de NP, M1, et HA, suivi d'une coloration avec des anticorps secondaires conjugués à Alexa. (D) Les cellules A549 ont été infectées avec IAV-CA/07 à un MOI de 1. À 4 hpi, les cellules ont été traitées avec de la 6-TG (10 uM). A 8 hpi, les cellules ont été fixées et immunocolorées avec des anticorps dirigés contre les protéines marqueurs des granules de stress G3BP1 (rouge), TIAR (vert) et eIF3A (vert), suivi d'une coloration avec des anticorps secondaires conjugués à Alexa. Images capturées sur un microscope à fluorescence Zeiss Axioimager Z2. Images représentatives montrées. Les barres d'échelle représentent 20 µm. Lorsque la particule virale envahit une cellule, il essaie de se répliquer rapidement, et cela pèse sur l'ER. Le virus libère des salves de glycoprotéines qui submergent le RE. Le virus, cependant, est capable de contourner l'UPR et favorise une réplication efficace.
L'IAV peut coder trois protéines membranaires intégrales :l'hémagglutinine (HA), neuraminidase (NA), et la protéine matricielle 2 (M2). Alors que la réplication IAV provoque une activation sélective de l'UPR, des mécanismes spécifiques peuvent activer l'UPR mais ensuite le contourner pour favoriser une réplication virale efficace. L'équipe explique que les effets des protéines NA et M2 sur l'UPR ne sont pas clairs, mais HA peut promouvoir l'UPR.
Plusieurs coronavirus (CoV) peuvent activer l'UPR. Cela inclut le «virus de la bronchite infectieuse (IBV), virus de l'hépatite de la souris (MHV), le virus de la gastro-entérite transmissible (VGET), coronavirus humain (HCoV)-OC43, et SARS-CoV-1. L'ensemble de la séquence génétique, cependant, ne réagit pas de la même manière à la réplication du CoV.
L'équipe a identifié deux analogues de la thiopurine approuvés par la FDA appelés « 6-thioguanine (6-TG) et 6-thioguanosine (6-TGo) ». Ceux-ci se sont avérés bloquer la réplication de l'IAV et du HCoV-OC43 lorsque leur dose a été augmentée de manière graduelle.
Pateamine A et Silvestrol avaient été testés précédemment. Ces deux thiopurines, cependant, ont été trouvés pour perturber le processus d'accumulation de glycoprotéines virales qui pourraient activer l'UPR. Dans les cellules qui avaient été traitées avec la 6-TG, la synthèse des glycoprotéines virales pourrait être partiellement restaurée par l'inhibition chimique de l'UPR.
Les protéines CoV Spike (S) qui sont exprimées à la surface du virus ont montré une activation UPR. La protéine S du nouveau coronavirus ou SARS-CoV-2 S a également provoqué l'activation de l'UPR. La 6-TG a inhibé l'accumulation de protéines de fusion S0 complètes ou S2 clivées par la furine, ils ont noté. Cela n'a pas affecté l'ectodomaine S1. La 6-TG pourrait induire une UPR qui accélère le renouvellement médié par ERAD des glycoprotéines S0 et S2 ancrées dans la membrane, l'équipe a trouvé.
Les chercheurs ont expérimenté et découvert qu'un composé chimiquement similaire, la thiopurine 6-mercaptopurine (6-MP), avait peu d'effet sur l'UPR et n'affectait pas la réplication de l'IAV HCoV-OC43.
S'interroger sur le mécanisme d'induction de l'UPR par les composés thiopuriques 6-TG et 6-TGo, l'équipe a écrit que ces effets ne sont pas susceptibles d'être médiés par l'incorporation d'ADN ou d'ARN de 6-TG pour plusieurs raisons. La première raison est que le stress associé à la réplication virale n'induit pas spécifiquement l'UPR. La deuxième raison est que parmi les protéines virales, l'accumulation de glycoprotéines et leur transformation ont été perturbées de manière sélective. La troisième raison était que les niveaux d'ARN messager de HA et de NA dans l'IAV n'étaient pas significativement affectés. 6-MP, d'autre part, peut être converti en 6-thioguanosine triphosphate mais n'a pas induit d'UPR et n'a eu aucun effet sur les glycoprotéines de l'IAV ou la réplication d'OC43.
L'équipe a écrit que leurs données révèlent que "les molécules induisant l'UPR pourraient être des antiviraux efficaces ciblés sur l'hôte contre les virus qui dépendent des processus ER pour soutenir une réplication efficace". L'induction de l'UPR par la 6-TG et la 6-TGo pourrait donc être une nouvelle méthode par laquelle un mécanisme antiviral pourrait être déclenché par la cellule hôte elle-même. Il s'agit d'un mécanisme d'action unique jusqu'alors non reconnu, l'équipe a écrit.
Ils ont écrit en conclusion, « ... ces données indiquent que la 6-TG et la 6-TGo sont des antiviraux efficaces ciblés sur l'hôte qui déclenchent l'UPR et perturbent l'accumulation de glycoprotéines virales. »
medRxiv publie des rapports scientifiques préliminaires qui ne sont pas évalués par des pairs et, donc, ne doit pas être considéré comme concluant, guider la pratique clinique/le comportement lié à la santé, ou traités comme des informations établies.
 Le profil bactérien intestinal peut prédire les lésions intestinales après une radiothérapie
Le profil bactérien intestinal peut prédire les lésions intestinales après une radiothérapie
 Un nouvel outil enregistre et suit la croissance du microbiome
Un nouvel outil enregistre et suit la croissance du microbiome
 Les régimes à base de plantes améliorent la santé cardiaque via le microbiome intestinal
Les régimes à base de plantes améliorent la santé cardiaque via le microbiome intestinal
 Les bactéries intestinales les plus saines avec un régime à base de plantes ou méditerranéen
Les bactéries intestinales les plus saines avec un régime à base de plantes ou méditerranéen
 Vas-y,
Vas-y,
 L'alcool endommage le microbiome de la bouche
L'alcool endommage le microbiome de la bouche
 Des chercheurs utilisent la phagothérapie pour traiter avec succès la maladie alcoolique du foie
Pour la première fois, les chercheurs ont utilisé avec succès la thérapie bactériophage (phage) pour éliminer les maladies du foie liées à lalcool dans un modèle animal. Crédit dimage :Chri
Des chercheurs utilisent la phagothérapie pour traiter avec succès la maladie alcoolique du foie
Pour la première fois, les chercheurs ont utilisé avec succès la thérapie bactériophage (phage) pour éliminer les maladies du foie liées à lalcool dans un modèle animal. Crédit dimage :Chri
 Humains contre virus - Pouvons-nous éviter l'extinction dans un avenir proche ?
Lexpert soutient que les changements causés par lhomme à lenvironnement peuvent conduire à lémergence dagents pathogènes, non seulement de lextérieur mais aussi de notre propre microbiome, qui peut ou
Humains contre virus - Pouvons-nous éviter l'extinction dans un avenir proche ?
Lexpert soutient que les changements causés par lhomme à lenvironnement peuvent conduire à lémergence dagents pathogènes, non seulement de lextérieur mais aussi de notre propre microbiome, qui peut ou
 Les microbiomes intestinaux et oraux prédisent la gravité du COVID-19
Une question qui reste sans réponse pendant la pandémie en cours de la maladie à coronavirus 2019 (COVID-19) est de savoir pourquoi existe-t-il un schéma de hasard distinctif en ce qui concerne les ma
Les microbiomes intestinaux et oraux prédisent la gravité du COVID-19
Une question qui reste sans réponse pendant la pandémie en cours de la maladie à coronavirus 2019 (COVID-19) est de savoir pourquoi existe-t-il un schéma de hasard distinctif en ce qui concerne les ma