Heidän tutkimuksensa, "Tiopuriinit aktivoivat virusvastaista taittumatonta proteiinivastetta, joka estää viruksen glykoproteiinien kertymisen soluviljelmän infektiomallissa, ”Julkaistiin verkossa esipainettuna sivustolla bioRxiv* .
Tutkijat selittivät, että vaipalliset virukset, kuten koronavirus, niillä on geneettistä materiaalia, joka voi koodata kalvoproteiineja, jotka voidaan syntetisoida ja muokata endoplasmisessa verkkokalvossa (ER), ennen kuin ne voidaan kuljettaa virionin osien kokoonpanoalueille.
Jos ER -proteiinin taittokapasiteetti ylittyy liikaa virionihiukkasia, ER:ssä on ylikuormitus laskostumattomia proteiineja. Tämä laukaisee avaamattoman proteiinivaste (UPR). Tämä aktivoi transkriptiotekijän-6 (ATF6), inositoli, joka vaatii entsyymi-1:tä (IRE1) ja PKR:n kaltaista endoplasmista retikulukinaasia (PERK). Ne voivat tuntea, että päivystys on stressaantunut, ja näin ollen on synteesi perusleusiinivetoketjun (bZIP) transkriptiotekijöistä.
Kun UPR aktivoituu, ER:n proteiinin taittokapasiteetti kasvaa. Tämä laukaisee myös ER:hen liittyvän hajoamisen (ERAD). Kaikki proteiinit, joita ei ole taitettu oikein, tuodaan ulos ER:stä ja hajoavat 26S -proteasomin kautta.
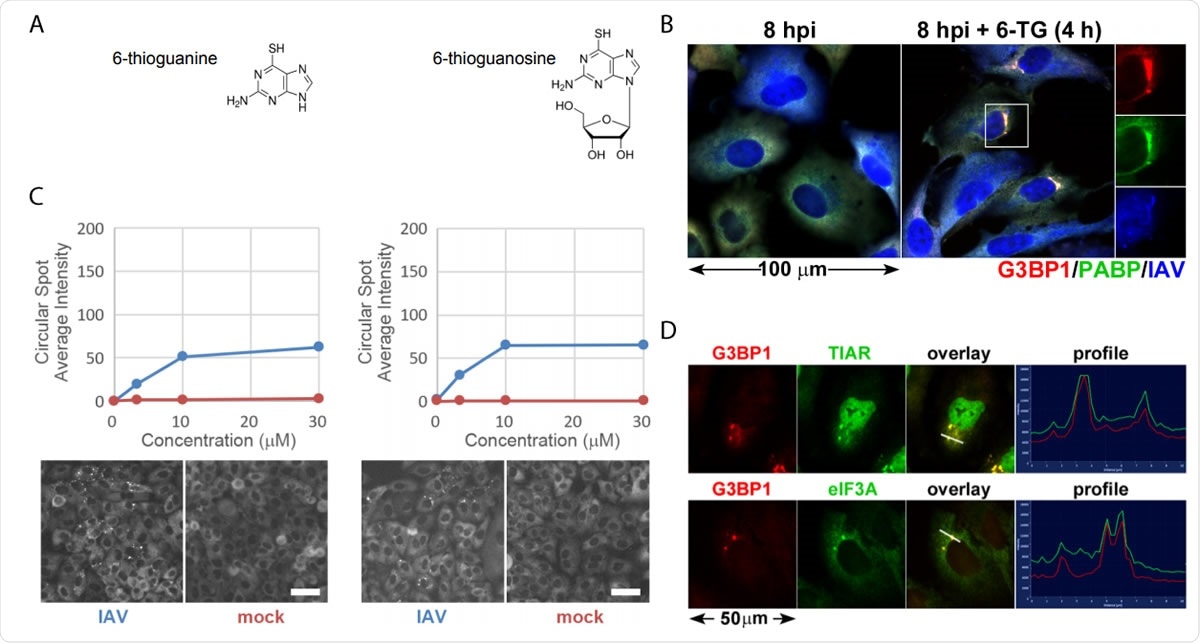 Tiopuriinianalogit 6-TG ja 6-TGo indusoivat selektiivisesti stressirakeita IAV-infektoiduissa soluissa. (A) Rakenteelliset kaaviot näytössä tunnistetuista pienistä molekyyleistä. (B) EGFP-G3BP-polttimien muodostumisen kvantifiointi IAV-Udorn-tartunnan saaneilla (sinisillä) tai pilkatuilla (punaisilla) infektoiduilla soluilla, joita on käsitelty kasvavilla 6-TG- ja 6-TGo-annoksilla (ylhäällä), ja edustavat Cellomics-kuvat EGFP-kanavasta käsitellyistä soluista 30 µM 6-TG:llä ja 6-TGo:lla (alhaalla). 4 hpi:n nopeudella, soluja käsiteltiin 0, 1, 10 ja 30 uM tiopuriinianalogien annoksia 6-tioguaniini (6-TG) tai 6-tioguanosiini (6-TGo). 8 hpi, solut kiinnitettiin ja värjättiin Hoeschst 33342:llä. Automaattinen kuvanotto suoritettiin käyttäen Cellomics Arrayscan VTI HCS -lukijaa. Jokaista kuoppaa otettiin 15 kuvaa ja keskimääräinen täsmällinen EGFP-G3BP1-intensiteetti laskettiin. (C) A549-solut infektoitiin IAV-CA/07:llä MOI:lla 1. 4 hpi, soluja käsiteltiin 6-TG:llä tai pilkataan. 8 hpi, solut kiinnitettiin ja immunovärjättiin vasta -aineilla, jotka oli suunnattu stressirakeiden markkeriproteiineille G3BP1 (punainen), PABP (vihreä) ja polyklonaalinen IAV -vasta -aine (sininen), joka havaitsee NP:n antigeenit, M1, ja HA, jota seurasi värjäys Alexa-konjugoiduilla toissijaisilla vasta-aineilla. (D) A549-solut infektoitiin IAV-CA/07:llä MOI:lla 1. 4 hpi, soluja käsiteltiin 6-TG:llä (10 uM). 8 hpi, solut kiinnitettiin ja immunovärjättiin vasta -aineilla, jotka oli suunnattu stressirakeiden markkeriproteiineille G3BP1 (punainen), TIAR (vihreä) ja eIF3A (vihreä), jota seurasi värjäys Alexa-konjugoiduilla toissijaisilla vasta-aineilla. Kuvat otettu Zeiss Axioimager Z2 -loisteputkimikroskoopilla. Edustavat kuvat esillä. Asteikko palkit edustavat 20 µm.
Tiopuriinianalogit 6-TG ja 6-TGo indusoivat selektiivisesti stressirakeita IAV-infektoiduissa soluissa. (A) Rakenteelliset kaaviot näytössä tunnistetuista pienistä molekyyleistä. (B) EGFP-G3BP-polttimien muodostumisen kvantifiointi IAV-Udorn-tartunnan saaneilla (sinisillä) tai pilkatuilla (punaisilla) infektoiduilla soluilla, joita on käsitelty kasvavilla 6-TG- ja 6-TGo-annoksilla (ylhäällä), ja edustavat Cellomics-kuvat EGFP-kanavasta käsitellyistä soluista 30 µM 6-TG:llä ja 6-TGo:lla (alhaalla). 4 hpi:n nopeudella, soluja käsiteltiin 0, 1, 10 ja 30 uM tiopuriinianalogien annoksia 6-tioguaniini (6-TG) tai 6-tioguanosiini (6-TGo). 8 hpi, solut kiinnitettiin ja värjättiin Hoeschst 33342:llä. Automaattinen kuvanotto suoritettiin käyttäen Cellomics Arrayscan VTI HCS -lukijaa. Jokaista kuoppaa otettiin 15 kuvaa ja keskimääräinen täsmällinen EGFP-G3BP1-intensiteetti laskettiin. (C) A549-solut infektoitiin IAV-CA/07:llä MOI:lla 1. 4 hpi, soluja käsiteltiin 6-TG:llä tai pilkataan. 8 hpi, solut kiinnitettiin ja immunovärjättiin vasta -aineilla, jotka oli suunnattu stressirakeiden markkeriproteiineille G3BP1 (punainen), PABP (vihreä) ja polyklonaalinen IAV -vasta -aine (sininen), joka havaitsee NP:n antigeenit, M1, ja HA, jota seurasi värjäys Alexa-konjugoiduilla toissijaisilla vasta-aineilla. (D) A549-solut infektoitiin IAV-CA/07:llä MOI:lla 1. 4 hpi, soluja käsiteltiin 6-TG:llä (10 uM). 8 hpi, solut kiinnitettiin ja immunovärjättiin vasta -aineilla, jotka oli suunnattu stressirakeiden markkeriproteiineille G3BP1 (punainen), TIAR (vihreä) ja eIF3A (vihreä), jota seurasi värjäys Alexa-konjugoiduilla toissijaisilla vasta-aineilla. Kuvat otettu Zeiss Axioimager Z2 -loisteputkimikroskoopilla. Edustavat kuvat esillä. Asteikko palkit edustavat 20 µm. Kun viruspartikkelit tunkeutuvat soluun, se yrittää toistaa nopeasti, ja tämä rasittaa päivystystä. Virus vapauttaa glykoproteiinipurskeita, jotka ylittävät ER:n. Virus, kuitenkin, pystyy ohittamaan UPR:n ja edistää tehokasta replikointia.
IAV voi koodata kolme kiinteää kalvoproteiinia:hemagglutiniini (HA), neuraminidaasi (NA), ja matriisiproteiini 2 (M2). Vaikka IAV -replikointi aiheuttaa UPR:n valikoivan aktivoinnin, tietyt mekanismit voivat aktivoida UPR:n, mutta sitten ohittaa sen edistääkseen tehokasta viruksen replikaatiota. Tiimi selittää, että NA- ja M2 -proteiinien vaikutukset UPR:ään eivät ole selviä, mutta HA voi edistää UPR:ää.
Useat koronavirukset (CoV) voivat aktivoida UPR:n. Tämä sisältää "tarttuvan keuhkoputkentulehdusviruksen (IBV), hiiren hepatiittivirus (MHV), tarttuva gastroenteriittivirus (TGEV), ihmisen koronavirus (HCoV) -OC43, ja SARS-CoV-1. " Koko geneettinen sekvenssi, kuitenkin, ei reagoi samalla tavalla CoV -replikaatioon.
Ryhmä tunnisti kaksi FDA:n hyväksymää tiopuriinianalogia, nimeltään "6-tioguaniini (6-TG) ja 6-tioguanosiini (6-TGo)". Näiden havaittiin estävän IAV:n ja HCoV-OC43:n replikaation, kun niiden annosta nostettiin asteittain.
Pateamine A ja Silvestrol oli testattu aikaisemmin. Nämä kaksi tiopuriinia, kuitenkin, havaittiin häiritsevän viruksen glykoproteiinien kertymisprosessia, joka voisi aktivoida UPR:n. Soluissa, joita oli hoidettu 6-TG:llä, viruksen glykoproteiinisynteesi voitaisiin osittain palauttaa UPR:n kemiallisella estämisellä.
Viruksen pinnalla ilmentyvät CoV Spike (S) -proteiinit osoittivat UPR -aktivaatiota. Uuden koronaviruksen tai SARS-CoV-2 S:n S-proteiini aiheutti myös UPR-aktivaation. 6-TG esti täysipituisten S0- tai furiinilla pilkottujen S2-fuusioproteiinien kertymistä, he totesivat. Se ei vaikuttanut S1 -ektodomeeniin. 6-TG voi indusoida UPR:n, joka nopeuttaa ERAD-välitteistä kalvon ankkuroitujen S0- ja S2-glykoproteiinien kiertoa, joukkue löysi.
Tutkijat kokeilivat ja havaitsivat, että kemiallisesti samanlaisella yhdisteellä, tiopuriini-6-merkaptopuriinilla (6-MP), oli vähän vaikutusta UPR:ään eikä se vaikuttanut IAV HCoV-OC43:n replikaatioon.
Pohtimalla tiopuriiniyhdisteiden 6-TG ja 6-TGo aiheuttaman UPR-induktion mekanismia, ryhmä kirjoitti, että nämä vaikutukset eivät todennäköisesti välity 6-TG:n DNA:n tai RNA:n sisällyttämisen kautta useista syistä. Ensimmäinen syy on se, että viruksen replikaatioon liittyvä stressi ei aiheuta erityisesti UPR:ää. Toinen syy on se, että virusproteiinien joukossa glykoproteiinien kertyminen ja niiden käsittely häiriintyi valikoivasti. Kolmas syy oli se, että IA:n HA- ja NA -lähetteen RNA -tasot eivät vaikuttaneet merkittävästi. 6 MP, toisaalta, voidaan muuttaa 6-tioguanosiinitrifosfaatiksi, mutta ei indusoinut UPR:ää eikä sillä ollut vaikutusta IAV-glykoproteiineihin tai OC43-replikaatioon.
Tiimi kirjoitti, että heidän tietonsa paljastavat, että "UPR:tä indusoivat molekyylit voivat olla tehokkaita isäntään kohdistuvia viruslääkkeitä viruksia vastaan, jotka ovat riippuvaisia ER-prosesseista tehokkaan replikaation tukemiseksi." UPR:n indusointi 6-TG:llä ja 6-TGo:lla voi siten olla uusi menetelmä, jolla isäntäsolu itse voi laukaista viruksenvastaisen mekanismin. Tämä on ollut aiemmin tuntematon ainutlaatuinen toimintamekanismi, joukkue kirjoitti.
He kirjoittivat yhteenvetona, "... nämä tiedot osoittavat, että 6-TG ja 6-TGo ovat tehokkaita isäntään kohdistuvia viruslääkkeitä, jotka laukaisevat UPR:n ja häiritsevät viruksen glykoproteiinien kertymistä."
medRxiv julkaisee alustavia tieteellisiä raportteja, joita ei ole vertaisarvioitu, ja siksi, ei pidä pitää ratkaisevana, ohjaa kliinistä käytäntöä/terveyteen liittyvää käyttäytymistä, tai käsitellään vakiintuneina tietoina.
 Suoliston mikrobiomi liittyy käyttäytymisongelmiin lapsilla
Suoliston mikrobiomi liittyy käyttäytymisongelmiin lapsilla
 Tutkijat tunnistavat bakteerin, jolla on anti-SARS-CoV-2-aktiivisuus in vitro:Dolosigranulum pigrum
Tutkijat tunnistavat bakteerin, jolla on anti-SARS-CoV-2-aktiivisuus in vitro:Dolosigranulum pigrum
 Uusi strategia voi vahvistaa suoliston ja aivojen välistä viestintää
Uusi strategia voi vahvistaa suoliston ja aivojen välistä viestintää
 Vetyhengitys ei ole Bikini -atollilta
Vetyhengitys ei ole Bikini -atollilta
 Tutkimus yhdistää fermentoitujen vihannesten kulutuksen alhaiseen COVID-19-kuolleisuuteen
Tutkimus yhdistää fermentoitujen vihannesten kulutuksen alhaiseen COVID-19-kuolleisuuteen
 Ovatko naiset todennäköisemmin kehittyneet pitkään COVIDiin?
Ovatko naiset todennäköisemmin kehittyneet pitkään COVIDiin?
 Kapean ruokatorven avaaminen
Jos sinulla on ollut pitkäaikaisia närästysongelmia, tämä on saattanut aiheuttaa arpia ruokatorveesi. Syynä on usein mahahapon refluksi. Nyt, arpikudos on luonut kapenevan osan ruokatorvesta, mikä v
Kapean ruokatorven avaaminen
Jos sinulla on ollut pitkäaikaisia närästysongelmia, tämä on saattanut aiheuttaa arpia ruokatorveesi. Syynä on usein mahahapon refluksi. Nyt, arpikudos on luonut kapenevan osan ruokatorvesta, mikä v
 Toimenpiteet SARS-CoV-2:n leviämisen estämiseksi jäteveden kautta köyhillä alueilla
Tutkijat ympäri maailmaa pyrkivät ymmärtämään, miten koronavirustauti 2019 (COVID-19) ja sitä aiheuttava uusi patogeeni-vaikea akuutti hengitystieoireyhtymä koronavirus 2 (SARS-CoV-2)-leviää. Uusi l
Toimenpiteet SARS-CoV-2:n leviämisen estämiseksi jäteveden kautta köyhillä alueilla
Tutkijat ympäri maailmaa pyrkivät ymmärtämään, miten koronavirustauti 2019 (COVID-19) ja sitä aiheuttava uusi patogeeni-vaikea akuutti hengitystieoireyhtymä koronavirus 2 (SARS-CoV-2)-leviää. Uusi l
 Puhdistusaineet voivat nostaa lapsuuden astman löydöstutkimusta
Simon Fraserin yliopiston terveystieteellisen tiedekunnan (SFU) tutkijoiden uuden tutkimuksen mukaan altistuminen kotitalouksien puhdistusaineille vauvoina voi nostaa lapsuuden astman riskiä 3 -vuotia
Puhdistusaineet voivat nostaa lapsuuden astman löydöstutkimusta
Simon Fraserin yliopiston terveystieteellisen tiedekunnan (SFU) tutkijoiden uuden tutkimuksen mukaan altistuminen kotitalouksien puhdistusaineille vauvoina voi nostaa lapsuuden astman riskiä 3 -vuotia