Deres undersøgelse med titlen, "Thiopuriner aktiverer et antiviralt udfoldet proteinrespons, der blokerer viral glykoproteinakkumulering i cellekulturinfektionsmodel, ”Blev udgivet online som et fortryk på stedet bioRxiv* .
Forskerne forklarede, at vira, der er indhyllet, såsom coronavirus, have genetisk materiale, der kan kode for membranproteiner, der kan syntetiseres og modificeres i det endoplasmatiske retikulum (ER), før de kan transporteres til samlingerne af virionens dele.
Hvis ER -proteinets foldningskapacitet er overvældet af for mange virionpartikler, der er en overbelastning af udfoldede proteiner i ER. Dette udløser et udfoldet proteinrespons (UPR). Dette aktiverer transkriptionsfaktor-6 (ATF6), inositol, der kræver enzym-1 (IRE1) og PKR-lignende endoplasmatisk retikulumkinase (PERK). Disse kan fornemme, at ER er under stress, og der er således en syntese af basale leucin lynlås (bZIP) transkriptionsfaktorer.
Når UPR aktiveres, proteinfoldningskapaciteten i ER øges. Dette udløser også ER-associeret nedbrydning (ERAD). Alle proteiner, der ikke foldes korrekt, bringes ud af ER og nedbrydes via 26S -proteasomet.
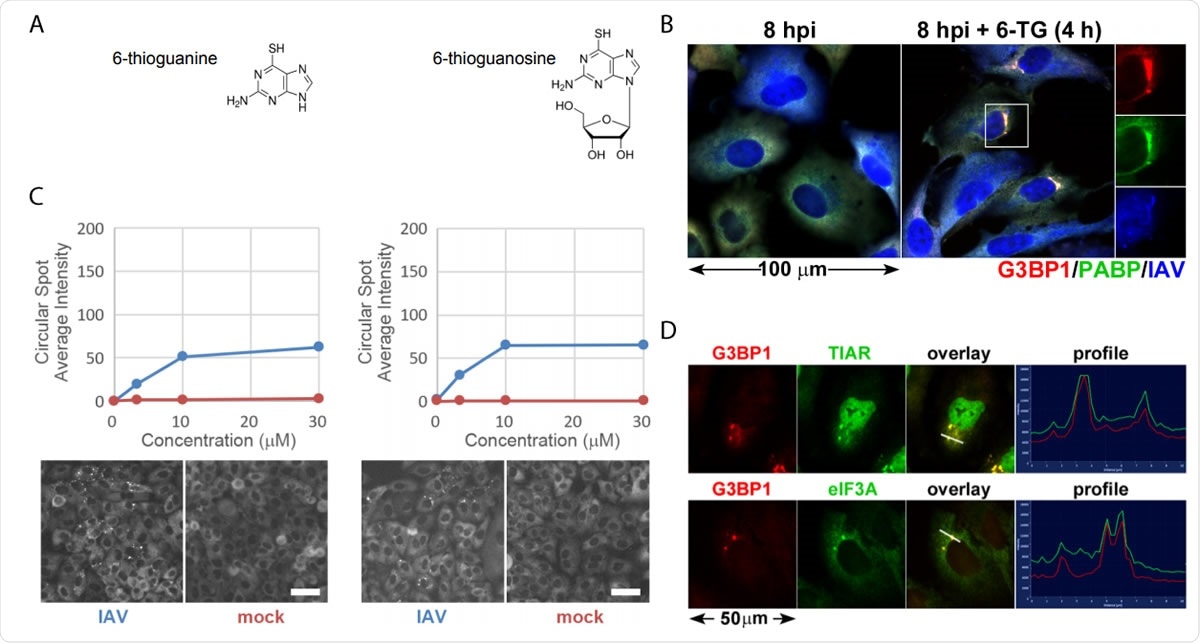 Thiopurinanaloger 6-TG og 6-TGo inducerer selektivt stressgranulat i IAV-inficerede celler. (A) Strukturelle diagrammer over små molekyler identificeret på skærmen. (B) Kvantificering af EGFP-G3BP foci dannelse i IAV-Udorn inficerede (blå) eller mock (røde) inficerede celler behandlet med stigende doser af 6-TG og 6-TGo (øverst) og repræsentative Cellomics-billeder af EGFP kanal af celler behandlet med 30 µM 6-TG og 6-TGo (bund). Ved 4 hpi, celler blev behandlet med 0, 1, 10 og 30 uM doser af thiopurinanaloger 6-thioguanin (6- TG) eller 6-thioguanosin (6-TGo). Ved 8 hpi, celler blev fikseret og farvet med Hoeschst 33342. Automatiseret billedoptagelse blev udført ved hjælp af en Cellomics Arrayscan VTI HCS -læser. 15 billeder blev taget for hver brønd, og den gennemsnitlige punkterede EGFP-G3BP1-intensitet blev beregnet. (C) A549 celler blev inficeret med IAV-CA/07 ved et MOI på 1. Ved 4 hpi, celler blev behandlet med 6-TG eller mock-behandlet. Ved 8 hpi, celler blev fikseret og immunfarvet med antistoffer rettet mod stressgranulatmarkørproteiner G3BP1 (rød), PABP (grøn) og et polyklonalt IAV -antistof (blå), der detekterer antigener fra NP, M1, og HA, efterfulgt af farvning med Alexa-konjugerede sekundære antistoffer. (D) A549-celler blev inficeret med IAV-CA/07 ved et MOI på 1. Ved 4 hpi, celler blev behandlet med 6-TG (10 uM). Ved 8 hpi, celler blev fikseret og immunfarvet med antistoffer rettet mod stressgranulatmarkørproteiner G3BP1 (rød), TIAR (grøn) og eIF3A (grøn), efterfulgt af farvning med Alexa-konjugerede sekundære antistoffer. Billeder taget med et Zeiss Axioimager Z2 fluorescerende mikroskop. Repræsentative billeder vist. Skalaer repræsenterer 20 µm.
Thiopurinanaloger 6-TG og 6-TGo inducerer selektivt stressgranulat i IAV-inficerede celler. (A) Strukturelle diagrammer over små molekyler identificeret på skærmen. (B) Kvantificering af EGFP-G3BP foci dannelse i IAV-Udorn inficerede (blå) eller mock (røde) inficerede celler behandlet med stigende doser af 6-TG og 6-TGo (øverst) og repræsentative Cellomics-billeder af EGFP kanal af celler behandlet med 30 µM 6-TG og 6-TGo (bund). Ved 4 hpi, celler blev behandlet med 0, 1, 10 og 30 uM doser af thiopurinanaloger 6-thioguanin (6- TG) eller 6-thioguanosin (6-TGo). Ved 8 hpi, celler blev fikseret og farvet med Hoeschst 33342. Automatiseret billedoptagelse blev udført ved hjælp af en Cellomics Arrayscan VTI HCS -læser. 15 billeder blev taget for hver brønd, og den gennemsnitlige punkterede EGFP-G3BP1-intensitet blev beregnet. (C) A549 celler blev inficeret med IAV-CA/07 ved et MOI på 1. Ved 4 hpi, celler blev behandlet med 6-TG eller mock-behandlet. Ved 8 hpi, celler blev fikseret og immunfarvet med antistoffer rettet mod stressgranulatmarkørproteiner G3BP1 (rød), PABP (grøn) og et polyklonalt IAV -antistof (blå), der detekterer antigener fra NP, M1, og HA, efterfulgt af farvning med Alexa-konjugerede sekundære antistoffer. (D) A549-celler blev inficeret med IAV-CA/07 ved et MOI på 1. Ved 4 hpi, celler blev behandlet med 6-TG (10 uM). Ved 8 hpi, celler blev fikseret og immunfarvet med antistoffer rettet mod stressgranulatmarkørproteiner G3BP1 (rød), TIAR (grøn) og eIF3A (grøn), efterfulgt af farvning med Alexa-konjugerede sekundære antistoffer. Billeder taget med et Zeiss Axioimager Z2 fluorescerende mikroskop. Repræsentative billeder vist. Skalaer repræsenterer 20 µm. Når viruspartiklen invaderer en celle, det forsøger at replikere hurtigt, og dette belaster ER. Virussen frigiver bursts af glykoproteiner, der overvælder ER. Virussen, imidlertid, er i stand til at omgå UPR og fremmer effektiv replikation.
IAV kan kode for tre integrerede membranproteiner:hæmagglutinin (HA), neuraminidase (NA), og matrixprotein 2 (M2). Mens IAV -replikationen forårsager selektiv aktivering af UPR, specifikke mekanismer kan aktivere UPR, men derefter omgå det for at fremme effektiv viral replikation. Teamet forklarer, at virkningerne af NA- og M2 -proteiner på UPR ikke er klare, men HA kan fremme UPR.
Flere coronavirus (CoV'er) kan aktivere UPR. Dette inkluderer "infektiøs bronkitisvirus (IBV), mus hepatitis virus (MHV), overførbar gastroenteritisvirus (TGEV), human coronavirus (HCoV) -OC43, og SARS-CoV-1. ” Hele den genetiske sekvens, imidlertid, reagerer ikke på samme måde som CoV -replikationen.
Teamet identificerede to FDA-godkendte thiopurinanaloger kaldet "6- thioguanin (6-TG) og 6-thioguanosine (6-TGo)". Disse viste sig at blokere IAV- og HCoV-OC43-replikation, når deres dosis blev øget gradueret.
Pateamine A og Silvestrol var tidligere blevet testet. Disse to thiopuriner, imidlertid, viste sig at forstyrre akkumuleringsprocessen af virale glycoproteiner, der kunne aktivere UPR. I cellerne, der var blevet behandlet med 6-TG, viral glycoproteinsyntese kunne delvist genoprettes ved den kemiske inhibering af UPR.
CoV Spike (S) -proteiner, der udtrykkes på virusets overflade, viste UPR -aktivering. S-proteinet fra det nye coronavirus eller SARS-CoV-2 S forårsagede også UPR-aktivering. 6-TG hæmmede akkumuleringen af S0 eller furin-spaltede S2-fusionsproteiner i fuld længde, bemærkede de. Det påvirkede ikke S1 ectodomain. 6-TG kan fremkalde UPR, der fremskynder ERAD-medieret omsætning af membranforankrede S0- og S2-glykoproteiner, fandt teamet.
Forskerne eksperimenterede og fandt ud af, at en kemisk lignende forbindelse thiopurin 6-mercaptopurin (6-MP) havde ringe effekt på UPR og ikke påvirkede replikationen af IAV HCoV-OC43.
Overvejer mekanismen for UPR-induktion af thiopurinforbindelserne 6-TG og 6-TGo, teamet skrev, at disse virkninger sandsynligvis ikke formidles gennem DNA eller RNA-inkorporering af 6-TG på grund af flere årsager. Den første grund er, at stress forbundet med viral replikation ikke specifikt fremkalder UPR. Den anden grund er, at blandt virale proteiner, ophobningen af glycoproteiner og deres forarbejdning blev selektivt afbrudt. Den tredje årsag var, at messenger -RNA -niveauerne af HA og NA i IAV ikke blev påvirket signifikant. 6 MP, på den anden side, kan omdannes til 6-thioguanosintrifosfat, men fremkaldte ikke UPR og havde ingen virkninger på IAV-glycoproteiner eller OC43-replikation.
Teamet skrev, at deres data afslører, at "UPR-inducerende molekyler kan være effektive host-målrettede antivirale midler mod vira, der er afhængige af ER-processer for at understøtte effektiv replikation." Induktion af UPR med 6-TG og 6-TGo kunne således være en ny metode, ved hvilken en antiviral mekanisme kunne udløses af værtscellen selv. Dette har været en tidligere ukendt unik handlingsmekanisme, skrev teamet.
De skrev til slut, "... disse data indikerer, at 6-TG og 6-TGo er effektive host-målrettede antivirale midler, der udløser UPR og forstyrrer akkumulering af virale glycoproteiner."
medRxiv offentliggør foreløbige videnskabelige rapporter, der ikke er peer-reviewed og, derfor, ikke skal betragtes som afgørende, vejlede klinisk praksis/sundhedsrelateret adfærd, eller behandles som etablerede oplysninger.
 PENTAX Medical hæver $ 125,
PENTAX Medical hæver $ 125,
 Nyt værktøj registrerer og sporer mikrobiomvækst
Nyt værktøj registrerer og sporer mikrobiomvækst
 Nanoteknologi og COVID-19 diagnose og behandling
Nanoteknologi og COVID-19 diagnose og behandling
 Forskning viser, hvordan tarmmikrober påvirker maveinfluenza
Forskning viser, hvordan tarmmikrober påvirker maveinfluenza
 Søvnkvalitet kan være indikator for senere undersøgelser af Alzheimers sygdom
Søvnkvalitet kan være indikator for senere undersøgelser af Alzheimers sygdom
 Det, du spiser, kan ændre den måde, antibiotika påvirker din tarm på
Det, du spiser, kan ændre den måde, antibiotika påvirker din tarm på
 Alkohol skader mikrobiomet i munden
En ny undersøgelse har vist, at alkohol ændrer og skader det naturlige bakteriemiljø i munden. Undersøgelsen med titlen, Drikke alkohol er forbundet med variation i det humane orale mikrobiom i en sto
Alkohol skader mikrobiomet i munden
En ny undersøgelse har vist, at alkohol ændrer og skader det naturlige bakteriemiljø i munden. Undersøgelsen med titlen, Drikke alkohol er forbundet med variation i det humane orale mikrobiom i en sto
 Hele kropsvibrationer hjælper med at reducere betændelse,
takket være tarmmikrobiomet Hele kropsvibrationer ser ud til at forbedre mange symptomer på type II diabetes mellitus, hvor glukose og destruktiv betændelse skyder op. Proceduren hjælper kroppen med a
Hele kropsvibrationer hjælper med at reducere betændelse,
takket være tarmmikrobiomet Hele kropsvibrationer ser ud til at forbedre mange symptomer på type II diabetes mellitus, hvor glukose og destruktiv betændelse skyder op. Proceduren hjælper kroppen med a
 Antibiotikaresistens fordobles på bare to årtier
Antibiotikaresistens udgør en alvorlig udfordring for mange tidligere helbredelige infektionssygdomme. På nuværende tidspunkt, antibiotikaresistens viser sig at stige meget hurtigere end udviklingen a
Antibiotikaresistens fordobles på bare to årtier
Antibiotikaresistens udgør en alvorlig udfordring for mange tidligere helbredelige infektionssygdomme. På nuværende tidspunkt, antibiotikaresistens viser sig at stige meget hurtigere end udviklingen a