Il loro studio intitolato, “Le tiopurine attivano una risposta proteica antivirale spiegata che blocca l'accumulo di glicoproteine virali nel modello di infezione della coltura cellulare, ” è stato pubblicato online come prestampa sul sito bioRxiv* .
I ricercatori hanno spiegato che i virus che sono avvolti, come il coronavirus, possiedono materiale genetico in grado di codificare proteine di membrana che possono essere sintetizzate e modificate nel reticolo endoplasmatico (RE) prima di poter essere trasportate nelle aree di assemblaggio delle parti del virione.
Se la capacità di ripiegamento della proteina ER è sopraffatta da troppe particelle virioniche, c'è un sovraccarico di proteine non ripiegate nel pronto soccorso. Questo innesca una risposta proteica spiegata (UPR). Questo attiva il fattore di trascrizione-6 (ATF6), inositolo che richiede l'enzima-1 (IRE1) e la chinasi del reticolo endoplasmatico simile alla PKR (PERK). Questi possono percepire che il pronto soccorso è sotto stress, e quindi c'è una sintesi di fattori di trascrizione basic leucina cerniera (bZIP).
Quando l'UPR viene attivato, la capacità di ripiegamento delle proteine dell'ER è aumentata. Questo innesca anche la degradazione associata all'ER (ERAD). Tutte le proteine che non sono ripiegate correttamente vengono portate fuori dal pronto soccorso e degradate tramite il proteasoma 26S.
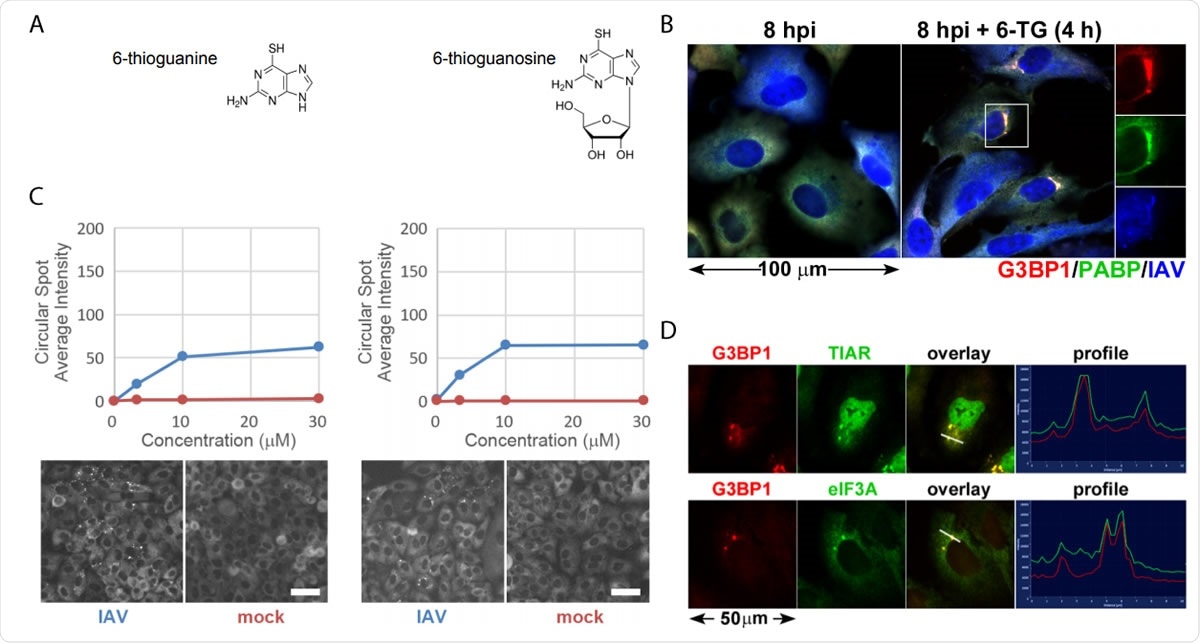 Gli analoghi della tiopurina 6-TG e 6-TGo inducono selettivamente granuli di stress nelle cellule infette da IAV. (A) Diagrammi strutturali di piccole molecole identificate sullo schermo. (B) Quantificazione della formazione di focolai EGFP-G3BP in cellule infettate da IAV-Udorn (blu) o finte (rosse) trattate con dosi crescenti di 6-TG e 6-TGo (in alto) e immagini rappresentative di Cellomics del canale EGFP delle cellule trattate con 30 µM 6-TG e 6-TGo (in basso). A 4 HP, le cellule sono state trattate con 0, 1, Dosi da 10 e 30 uM di analoghi della tiopurina 6-tioguanina (6-TG) o 6-tioguanosina (6-TGo). A 8 HP, le cellule sono state fissate e colorate con Hoeschst 33342. L'acquisizione automatica delle immagini è stata eseguita utilizzando un lettore Cellomics Arrayscan VTI HCS. Sono state acquisite 15 immagini per ciascun pozzetto ed è stata calcolata l'intensità media di EGFP-G3BP1 puntata. (C) Le cellule A549 sono state infettate con IAV-CA/07 a un MOI di 1. A 4 hpi, le cellule sono state trattate con 6-TG o trattate con mock. A 8 HP, le cellule sono state fissate e immunocolorate con anticorpi diretti alle proteine marcatori dei granuli di stress G3BP1 (rosso), PABP (verde) e un anticorpo IAV policlonale (blu) che rileva gli antigeni da NP, M1, e HA, seguita dalla colorazione con anticorpi secondari coniugati ad Alexa. (D) Le cellule A549 sono state infettate con IAV-CA/07 a un MOI di 1. A 4 hpi, le cellule sono state trattate con 6-TG (10µM). A 8 HP, le cellule sono state fissate e immunocolorate con anticorpi diretti alle proteine marcatori dei granuli di stress G3BP1 (rosso), TIAR (verde) e eIF3A (verde), seguita dalla colorazione con anticorpi secondari coniugati ad Alexa. Immagini catturate su un microscopio fluorescente Zeiss Axioimager Z2. Immagini rappresentative mostrate. Le barre della scala rappresentano 20 µm.
Gli analoghi della tiopurina 6-TG e 6-TGo inducono selettivamente granuli di stress nelle cellule infette da IAV. (A) Diagrammi strutturali di piccole molecole identificate sullo schermo. (B) Quantificazione della formazione di focolai EGFP-G3BP in cellule infettate da IAV-Udorn (blu) o finte (rosse) trattate con dosi crescenti di 6-TG e 6-TGo (in alto) e immagini rappresentative di Cellomics del canale EGFP delle cellule trattate con 30 µM 6-TG e 6-TGo (in basso). A 4 HP, le cellule sono state trattate con 0, 1, Dosi da 10 e 30 uM di analoghi della tiopurina 6-tioguanina (6-TG) o 6-tioguanosina (6-TGo). A 8 HP, le cellule sono state fissate e colorate con Hoeschst 33342. L'acquisizione automatica delle immagini è stata eseguita utilizzando un lettore Cellomics Arrayscan VTI HCS. Sono state acquisite 15 immagini per ciascun pozzetto ed è stata calcolata l'intensità media di EGFP-G3BP1 puntata. (C) Le cellule A549 sono state infettate con IAV-CA/07 a un MOI di 1. A 4 hpi, le cellule sono state trattate con 6-TG o trattate con mock. A 8 HP, le cellule sono state fissate e immunocolorate con anticorpi diretti alle proteine marcatori dei granuli di stress G3BP1 (rosso), PABP (verde) e un anticorpo IAV policlonale (blu) che rileva gli antigeni da NP, M1, e HA, seguita dalla colorazione con anticorpi secondari coniugati ad Alexa. (D) Le cellule A549 sono state infettate con IAV-CA/07 a un MOI di 1. A 4 hpi, le cellule sono state trattate con 6-TG (10µM). A 8 HP, le cellule sono state fissate e immunocolorate con anticorpi diretti alle proteine marcatori dei granuli di stress G3BP1 (rosso), TIAR (verde) e eIF3A (verde), seguita dalla colorazione con anticorpi secondari coniugati ad Alexa. Immagini catturate su un microscopio fluorescente Zeiss Axioimager Z2. Immagini rappresentative mostrate. Le barre della scala rappresentano 20 µm. Quando la particella virale invade una cellula, cerca di replicarsi velocemente, e questo grava sul Pronto Soccorso. Il virus rilascia raffiche di glicoproteine che travolgono il pronto soccorso. Il virus, però, è in grado di bypassare l'UPR e promuove una replica efficiente.
L'IAV può codificare tre proteine integrali di membrana:emoagglutinina (HA), neuraminidasi (NA), e proteina di matrice 2 (M2). Mentre la replicazione IAV provoca l'attivazione selettiva dell'UPR, meccanismi specifici possono attivare l'UPR ma poi bypassarlo per promuovere un'efficace replicazione virale. Il team spiega che gli effetti delle proteine NA e M2 sull'UPR non sono chiari, ma l'HA può promuovere l'UPR.
Diversi coronavirus (CoV) possono attivare l'UPR. Ciò include il "virus della bronchite infettiva (IBV), virus dell'epatite murina (MHV), virus della gastroenterite trasmissibile (TGEV), coronavirus umano (HCoV)-OC43, e SARS-CoV-1”. L'intera sequenza genetica, però, non reagisce in modo simile alla replicazione del CoV.
Il team ha identificato due analoghi della tiopurina approvati dalla FDA chiamati "6-tioguanina (6-TG) e 6-tioguanosina (6-TGo)". Questi sono stati trovati per bloccare la replicazione di IAV e HCoV-OC43 quando la loro dose è stata aumentata in modo graduale.
La pateamina A e il silvestrol erano stati testati in precedenza. Queste due tiopurine, però, sono stati trovati per interrompere il processo di accumulo di glicoproteine virali che potrebbero attivare l'UPR. Nelle cellule che erano state trattate con 6-TG, la sintesi della glicoproteina virale potrebbe essere parzialmente ripristinata dall'inibizione chimica dell'UPR.
Le proteine CoV Spike (S) espresse sulla superficie del virus hanno mostrato l'attivazione dell'UPR. Anche la proteina S del nuovo coronavirus o SARS-CoV-2 S ha causato l'attivazione dell'UPR. 6-TG ha inibito l'accumulo di proteine di fusione S0 a lunghezza intera o S2 scisse da furin, hanno notato. Non ha influenzato l'ectodominio S1. 6-TG potrebbe indurre UPR che accelera il turnover mediato da ERAD delle glicoproteine S0 e S2 ancorate alla membrana, la squadra ha trovato.
I ricercatori hanno sperimentato e scoperto che un composto chimicamente simile tiopurina 6-mercaptopurina (6-MP) ha avuto scarso effetto sull'UPR e non ha influenzato la replicazione di IAV HCoV-OC43.
Riflettendo sul meccanismo di induzione dell'UPR da parte dei composti tiopurici 6-TG e 6-TGo, il team ha scritto che è improbabile che questi effetti siano mediati dall'incorporazione di DNA o RNA di 6-TG a causa di diversi motivi. La prima ragione è che lo stress associato alla replicazione virale non induce specificamente l'UPR. La seconda ragione è che tra le proteine virali, l'accumulo di glicoproteine e la loro elaborazione è stata interrotta selettivamente. La terza ragione era che i livelli di RNA messaggero di HA e NA nell'IAV non erano significativamente influenzati. 6 MP, d'altra parte, può essere convertito in 6-tioguanosina trifosfato ma non ha indotto UPR e non ha avuto effetti sulle glicoproteine IAV o sulla replicazione di OC43.
Il team ha scritto che i loro dati rivelano che "le molecole che inducono l'UPR potrebbero essere efficaci antivirali mirati all'ospite contro i virus che dipendono dai processi ER per supportare una replica efficiente". L'induzione di UPR da parte di 6-TG e 6-TGo potrebbe quindi essere un nuovo metodo con cui un meccanismo antivirale potrebbe essere attivato dalla cellula ospite stessa. Questo è stato un meccanismo d'azione unico precedentemente non riconosciuto, ha scritto la squadra.
Hanno scritto in conclusione, "... questi dati indicano che 6-TG e 6-TGo sono efficaci antivirali mirati all'ospite che attivano l'UPR e interrompono l'accumulo di glicoproteine virali".
medRxiv pubblica rapporti scientifici preliminari che non sono sottoposti a revisione paritaria e, perciò, non deve essere considerato conclusivo, guidare la pratica clinica/comportamento relativo alla salute, o trattati come informazioni stabilite.
 La proteina SARS-CoV N provoca la produzione di IFN-β provocando l'ubiquitinazione di RIG-I,
La proteina SARS-CoV N provoca la produzione di IFN-β provocando l'ubiquitinazione di RIG-I,
 Che cos'è un ERCP?
Che cos'è un ERCP?
 Le zecche ora portano più malattie,
Le zecche ora portano più malattie,
 Neil Bell nominato Chief Development Officer di Avacta Life Sciences
Neil Bell nominato Chief Development Officer di Avacta Life Sciences
 La ricerca esamina gli aerobiomi,
La ricerca esamina gli aerobiomi,
 Gli scienziati estraggono il genoma umano completo da una "gomma da masticare" vecchia di migliaia di anni
Gli scienziati estraggono il genoma umano completo da una "gomma da masticare" vecchia di migliaia di anni
 Trapianto fecale da alcuni donatori meglio di altri
Il trapianto di microbiota fecale o il trapianto di feci da un donatore è utile per i pazienti infetti da recidiva mortale Clostridium difficile che porta a una grave diarrea, dolore e spesso gravi
Trapianto fecale da alcuni donatori meglio di altri
Il trapianto di microbiota fecale o il trapianto di feci da un donatore è utile per i pazienti infetti da recidiva mortale Clostridium difficile che porta a una grave diarrea, dolore e spesso gravi
 Batteri vaginali legati al parto prematuro
Un nuovo studio pubblicato sulla rivista Frontiere in microbiologia nellaprile 2020 riporta che le donne che partoriscono in anticipo hanno maggiori probabilità di avere una maggiore varietà di batt
Batteri vaginali legati al parto prematuro
Un nuovo studio pubblicato sulla rivista Frontiere in microbiologia nellaprile 2020 riporta che le donne che partoriscono in anticipo hanno maggiori probabilità di avere una maggiore varietà di batt
 Batteri nel canale del parto legati a un minor rischio di cancro ovarico
Un nuovo studio mostra che qualcosa di semplice come un tampone cervicale potrebbe avere il potenziale per aiutare centinaia di donne che sono ad altissimo rischio di cancro ovarico perché hanno una m
Batteri nel canale del parto legati a un minor rischio di cancro ovarico
Un nuovo studio mostra che qualcosa di semplice come un tampone cervicale potrebbe avere il potenziale per aiutare centinaia di donne che sono ad altissimo rischio di cancro ovarico perché hanno una m