Colorectal Carcinom opstået af tyktarms- eller rektal slimhinde (peak incidens 60-70 år). De ses normalt hos ældre patienter eller unge patienter, der sædvanligvis har colitis ulcerosa, chroniske eller genetiske dispositionsfænotyper som familiært polyposissyndrom (FAP) og Lynch-syndrom (HNPCC).
Årsager og risikofaktorer for tyktarmskræft: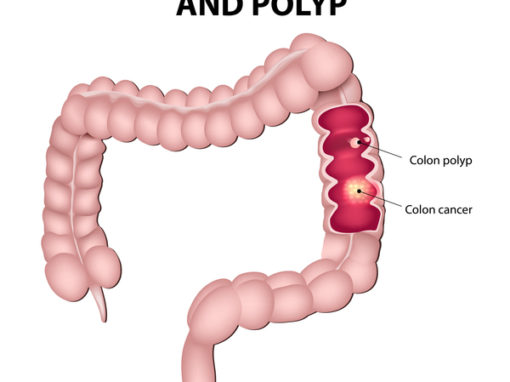
Indholdsfortegnelse
- 1 årsager og risikofaktorer for tyktarmskræft:
- 2 symptomer og klinisk præsentation
- 3 Morfologi af koloncarcinom
- 4 Diagnose af tyktarmskræft
- 5 Diagnose af tyktarmskræft
- 6 laboratorier efter behandling
- 7 Behandling af tyktarmskræft
Den mest almindelige årsag til kolorektal cancer skyldes Adenoma-carcinomsekvensen (APC, KRAS, P53 mutation) hos 90 %. Den næstvigtigste molekylære vej til at forårsage kolorektal cancer er MSI-mutation (10%), som muligvis involverer polypper.
Risikofaktorer for udvikling af tyktarmskræft omfatter:inflammatorisk tarmsygdom (IBD), rygning, kost med lavt fiberindhold og højt animalsk fedtindhold, fedme og stillesiddende livsstil.
Anden sammenhæng:Endocarditis med (Streptococcus bovis og Clostridium speticum) – derfor skal enhver patient med endocarditis af disse organismer have behov for koloskopi for at udelukke intestinal malignitet.
Symptomer og klinisk præsentation
Kokolorektal cancer er normalt asymptomatisk, indtil tumoren vokser sig større og forårsager symptomer. Da de fleste læsioner begynder med polypper, er det vigtigt at screene for polypper og fjerne dem, hvis de findes.
Højresidet læsion med træthed, svaghed og Fe-mangel på grund af blodtab (melena) fra ulceration af tumor, der er omfangsrig og bløder let. Fe
2+
Mangelanæmi fundet hos ældre er GI Malignitet, medmindre andet er bevist.
Venstresidet læsion til stede med ændrede afføringsvaner (obstruktion) og lyse røde blødninger (hæmatochezia), der nogle gange har blyantafføring.
- Adenom-karcinomsekvens
- Opstår fra APC/β-catenin: KRAS, P53/DCC mutationssekvens
- Placeringen er venstresidet (rektalsigmoid eller distal colon), venstre nedre quad (LLQ) smerte
- Tumor til stede som serviet-ring-konstriktionspolyp-type.(danner normalt adenome polypper først)
- Forårsager obstruktion af tarmen (hovedsagelig), kan også forårsage lyse blødninger.
- Genetisk disposition:Germline APC mutation (fører til FAP'er/Gardner/Turcot syndrom)
- MSI (mikrosatellit-ustabilitet) Mismatch Repair Genmutation Pathway.
- Opstår fra DNA mismatch reparation genmutationer (MSH2, MSH6, MSL1, PMS osv.)
- Placeringen er højresidet (stigende/proksimal kolon), højre nedre quad vag smerte
- Tumor til stede som exofytisk masse polyp type (kan eller ikke kan danne adenomatøse polypper.)
- Årsag blødning, derfor Fe
2+
mangelanæmi
- Genetisk disposition:Kimlinje MSH2, MSL1 kimlinjemutation (HNPCC=Lynch syndrom)
- Øget risiko for andre kræftformer:tyktarmskræft, ovariecancer, endometriecancer, mave, galdeveje, selv tyndtarm, bugspytkirtel
- Karcinom opstår denovo, ikke fra adenomatøs polyp i en meget ung alder.
Morfologi af koloncarcinom
- Sædvanligvis ensom, medmindre genetisk disponerede siger FAP'er
- Flere kræftformer (colitis ulcerosa, polyposesyndromer, HNPCC)
- Neoplastiske kirtler, der invaderer submucosa og videre à regional LN (lymfeknude), lever, lunge, knogler
- 10-15 % kan producere omfattende mucin
Diagnose af tyktarmskræft
- Retningslinjer for screening:
- Uden genetisk risiko Patient ≥ 50 år.
- Koloskopi hvert 10. år* bedste metode.
- Fækal okkult blodprøve årligt, og hvis positiv, skal du have en koloskopi (falsk negativ, hvis C-vitamin indtages, falsk positiv, hvis der bruges NSAID).
- Fleksibel Sigmoidoskopi eller dobbelt kontrast Barium hvert 5. år
- Hvis dysplastiske polypper fundet tidligere
- har brug for Colonoscoy-screening hvert 3.-5. år
- Hvis jeg selv havde tyktarmskræft
- 1 år efter resektion, derefter 3 år efterfulgt af hvert 5. år
- Hvis enkelt FHx af cancer/polypper
- 10 år før familien har tyktarmskræft/polyp ELLER 40 år gammel skærm (alt efter hvad der kommer først)
- Behov for at gentage koloskopi hvert 3.-5. år
- HNPCC (Lynch-syndrom) – MSI mutation (syndrom defineret af 3 familiemedlemmer i mindst 2 generationer har tyktarmskræft
- Start ved 25-års alderen (koloskopi hvert 1.-2. år)
- Høj forekomst af ovarie- og endometriecancer
- FAPS (Familiært adenomatøst polyposesyndrom)
- Start ved 12-års alderen (Flexi sigmoidoskopi hvert 1.-2. år)
- Polypper så tidligt som 25 år gamle og 100 % penetrans – tyktarmskræft efter 50 år.
- Hvis polypper positive (total kolektomi) skal udføres, og tilslut terminal ileum for at danne ny endetarm.
- FAP-varianter (ingen screeningsanbefaling endnu)
- Gardners syndrom:Tyktarmskræft forbundet med bløddelstumorer (lipom, osteom, fibromsarcoma) – osteom især ved mandiblen – lav koloskopi, hvis du ser nogen af de tilknyttede bløddelstumorer. Nogle anbefaler skærm som FAP.
- Turcot syndrom:Tyktarmskræft forbundet med CNS malignitet (GBM, Medulloblastoma)
- Harmatomatøst polyposesyndrom (ingen anbefaling endnu)
- Juvenil polyposesyndrom (10 % risiko for tyktarmskræft i modsætning til FAPS) – kun et par dusin i modsætning til tusindvis af FAP. Ikke-adenom (Harmatom) lavrisikokræft
- Cowden syndrom – rektal blødning som barn (også harmatom) kun en lille risiko end den slægtspopulation
- Dannayan-Ruvacalba-Riley-syndrom
- Peutz-Jegher Polyps Syndrom
- Til patient med IBD
- Især colitis ulcerosa Diagnosticeret i 8-10 år, skal du screene med koloskopi hvert 1-2 år for kolorektal cancer.
Diagnose af tyktarmskræft
- Koloskopi (kun 60 % af tyktarmskræft fanget med sigmoidoskopi)
Laboratorier efter behandling
- CEA nyttigt til at følge terapeutisk respons og detektere tilbagefald, ikke godt til screening.
- Også udført før behandling for at sammenligne
Behandling af tyktarmskræft
- Afhænger af scenen og spredningens omfang.
- Metastatisk leversygdom (én læsion) kan resekeres kirurgisk, hvis> 1 læsion =kemoterapi.
- Lokaliseret (mucosa, submucosa, muscularis mucosae) – kan resekeres for helbredelse
- Penetrerede serosa eller omgivende væv og LN – Kemoterapi
- 5FU + Leucovirin
- Xeloda =Capecitabine =5FU prodrug; Leucovirin =folinsyre
- Nye lægemidler – Avastin (Bevacizumab), som er en VEGF-hæmmer, der blokerer karvækst for at forsyne den voksende tumor.

 Brug af CT-scanning hos børn faldt over det seneste årti
Seneste nyheder om sunde børn Babys fodringsproblemer knyttet til udviklingsforsinkelser Hendes arm blev fanget i familiens løbebånd Bekymret for din teenagers brug af sociale medier? Effektiviteten
Brug af CT-scanning hos børn faldt over det seneste årti
Seneste nyheder om sunde børn Babys fodringsproblemer knyttet til udviklingsforsinkelser Hendes arm blev fanget i familiens løbebånd Bekymret for din teenagers brug af sociale medier? Effektiviteten
 Meddelelse:Måneden hvor man fikser utæt tarm
Det er en Stick Up! – Leaky Gut overtager SCD Lifestyle i de næste 2 uger... og vi er så spændte! Det er helt nyt gratis materiale, der hjælper dig og dine kære med at lære om utæt tarm, hvem der har
Meddelelse:Måneden hvor man fikser utæt tarm
Det er en Stick Up! – Leaky Gut overtager SCD Lifestyle i de næste 2 uger... og vi er så spændte! Det er helt nyt gratis materiale, der hjælper dig og dine kære med at lære om utæt tarm, hvem der har
 Virker æblecidereddike til IBS?
I betragtning af brummer om de sundhedsmæssige fordele ved æblecidereddike, spørger folk, om det er nyttigt for irritabel tyktarm. Hjemmemidler som ACV har en tendens til ikke at få forskningsmidler,
Virker æblecidereddike til IBS?
I betragtning af brummer om de sundhedsmæssige fordele ved æblecidereddike, spørger folk, om det er nyttigt for irritabel tyktarm. Hjemmemidler som ACV har en tendens til ikke at få forskningsmidler,