Os macrófagos são células de defesa imunológica, fazendo parte do sistema imunológico inato que observa infecções. Contudo, sua resposta a patógenos de qualquer tipo também pode desencadear uma inflamação crônica ou excessiva. Esse tipo de ativação anormal de macrófagos é observada na artrite reumatóide (AR) e em outras doenças autoimunes. Um dos objetivos do tratamento da AR é modular os estados de ativação dos macrófagos e reduzir a infiltração de macrófagos no tecido inflamado.
Nos pulmões, também, infecção pode causar inflamação induzida por macrófagos, o que resulta na destruição do tecido pulmonar. Também pode desencadear uma tempestade de citocinas, observada na síndrome do desconforto respiratório agudo (SDRA). A ativação de macrófagos é dependente de receptores, que por sua vez respondem a uma variedade de sinais externos. A maioria deles é mediada por citocinas e antígenos presentes nos micróbios.
Uma das moléculas ativadoras de macrófagos mais conhecidas e mais importantes é o interferon-γ (IFN-γ). Os macrófagos preparados pela exposição ao IFN-γ respondem mais poderosamente à estimulação subsequente. Outra classe de ativador semelhante contém agonistas do receptor Toll-like (TLR), que prepara os macrófagos de modo que secretam moléculas que formam o corpo inflamatório denominado inflamassoma. A ativação dos componentes do inflamassoma faz com que a célula morra por piroptose junto com a liberação de interleucina -1β (IL-1β).
Nas palavras dos pesquisadores, “ Um componente importante da resposta do macrófago a um sinal primário é a regulação positiva de um receptor superativador secundário que pode então transformar esses macrófagos preparados em um explosivo, estado inflamatório potencialmente patogênico . ”
Os pesquisadores exploraram várias condições inflamatórias, como AR, Doença de Crohn e COVID-19 grave, encontrar um novo receptor de macrófago superativador secundário denominado SLAMF7. Esse, eles dizem, é a chave para a patogênese dessas condições.
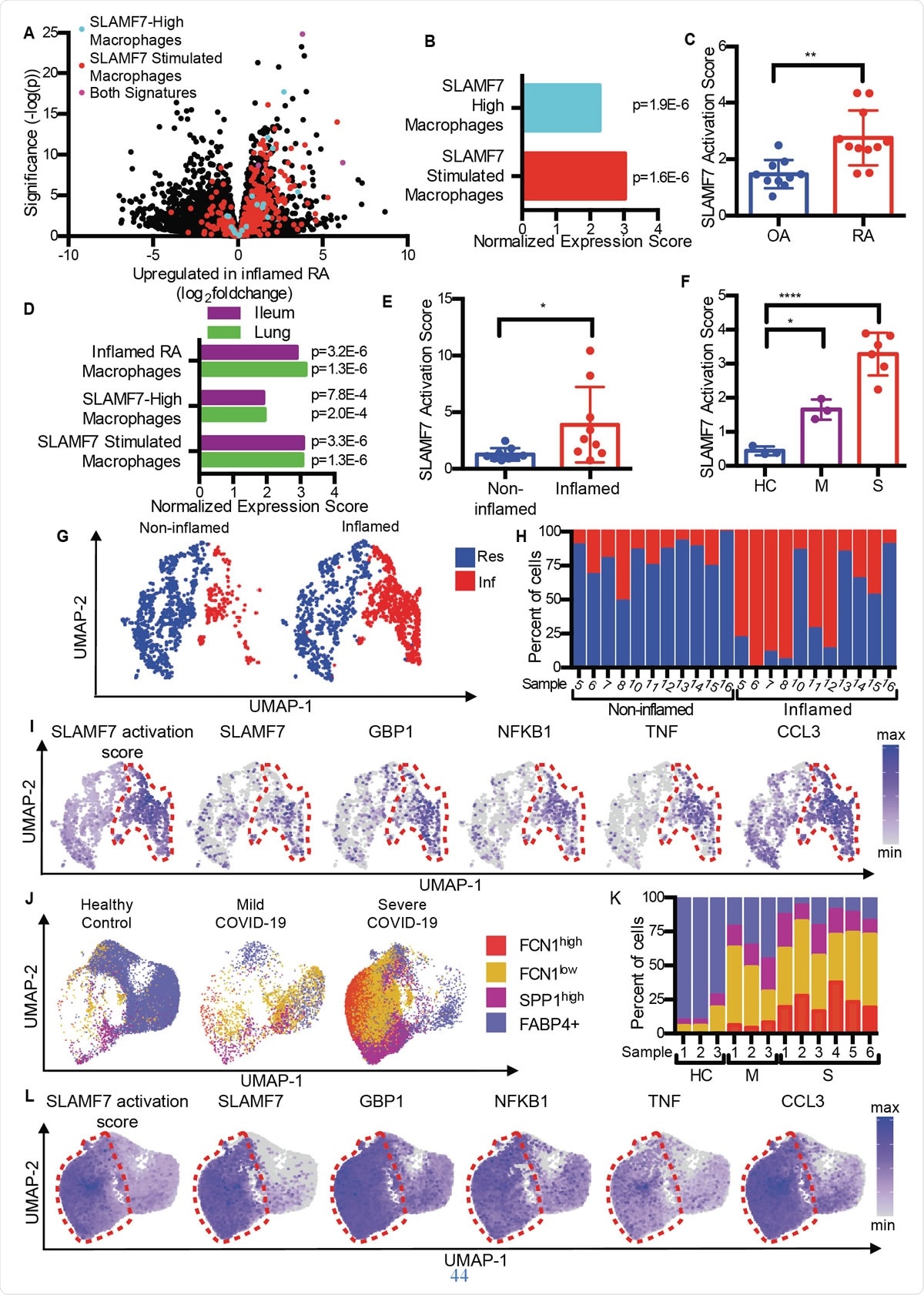 Macrófagos superativados SLAMF7 conduzem a inflamação em doenças autoimunes e infecciosas. A) Gráfico de vulcão da Fig. 1A destacando genes da "assinatura de macrófago SLAMF7-High, ”A“ Assinatura de estimulação do macrófago SLAMF7, ”E genes incluídos em ambas as assinaturas. B) Análise de enriquecimento de conjunto de genes comparando a expressão diferencial de genes em RA versus OA com a "Assinatura de macrófago de alta SLAMF7" e "Assinatura de estimulação de macrófago SLAMF7". C) pontuação de ativação SLAMF7 para dados de RNA-seq em massa em macrófagos sinoviais de pacientes com OA (n =10) ou AR (n =11). Os dados representam a média ± DP. D) Análise de enriquecimento de conjunto de genes comparando a expressão gênica de macrófagos de tecidos ileais inflamados em pacientes com doença de Crohn ou pulmões de pacientes com COVID-19 com a "Assinatura de Macrófago RA Inflamado", a “Assinatura de alto macrófago SLAMF7” e a “Assinatura de estimulação Macrófago SLAMF7”. E) Pontuação de ativação SLAMF7 para macrófagos de tecidos ileais não inflamados (n =9) e inflamados (n =9). F) pontuação de ativação SLAMF7 para macrófagos de lavagem broncoalveolar de controles saudáveis (n =3), ou indivíduos com COVID-19 leve (n =3) ou grave (n =6). Os dados em E-F representam a média ± DP. G) Gráfico UMAP de agrupamentos de macrófagos de tecidos ileais envolvidos e não envolvidos. H) Porcentagem de macrófagos de cada doador atribuído a cada cluster. I) Gráficos UMAP mostrando a expressão gênica de populações de macrófagos ileais. J) Gráfico UMAP das populações de macrófagos do lavado broncoalveolar. K) Porcentagem de macrófagos de cada doador atribuído a cada população. L) Gráficos de UMAP mostrando a expressão gênica para populações de macrófagos do lavado broncoalveolar. O teste t pareado foi usado para comparações estatísticas bidirecionais, e a ANOVA unilateral com o teste de comparações múltiplas de Dunnett foi usada para comparar COVID-19 leve e grave com controles saudáveis. *, p ≤ 0,05; **, p ≤ 0,01; ****, p <0,0001; Res, Aglomerado de macrófagos residentes; Inf, Agrupamento de macrófagos inflamatórios; HC, controle saudável; M, COVID-19 leve; S, COVID-19 grave.
Macrófagos superativados SLAMF7 conduzem a inflamação em doenças autoimunes e infecciosas. A) Gráfico de vulcão da Fig. 1A destacando genes da "assinatura de macrófago SLAMF7-High, ”A“ Assinatura de estimulação do macrófago SLAMF7, ”E genes incluídos em ambas as assinaturas. B) Análise de enriquecimento de conjunto de genes comparando a expressão diferencial de genes em RA versus OA com a "Assinatura de macrófago de alta SLAMF7" e "Assinatura de estimulação de macrófago SLAMF7". C) pontuação de ativação SLAMF7 para dados de RNA-seq em massa em macrófagos sinoviais de pacientes com OA (n =10) ou AR (n =11). Os dados representam a média ± DP. D) Análise de enriquecimento de conjunto de genes comparando a expressão gênica de macrófagos de tecidos ileais inflamados em pacientes com doença de Crohn ou pulmões de pacientes com COVID-19 com a "Assinatura de Macrófago RA Inflamado", a “Assinatura de alto macrófago SLAMF7” e a “Assinatura de estimulação Macrófago SLAMF7”. E) Pontuação de ativação SLAMF7 para macrófagos de tecidos ileais não inflamados (n =9) e inflamados (n =9). F) pontuação de ativação SLAMF7 para macrófagos de lavagem broncoalveolar de controles saudáveis (n =3), ou indivíduos com COVID-19 leve (n =3) ou grave (n =6). Os dados em E-F representam a média ± DP. G) Gráfico UMAP de agrupamentos de macrófagos de tecidos ileais envolvidos e não envolvidos. H) Porcentagem de macrófagos de cada doador atribuído a cada cluster. I) Gráficos UMAP mostrando a expressão gênica de populações de macrófagos ileais. J) Gráfico UMAP das populações de macrófagos do lavado broncoalveolar. K) Porcentagem de macrófagos de cada doador atribuído a cada população. L) Gráficos de UMAP mostrando a expressão gênica para populações de macrófagos do lavado broncoalveolar. O teste t pareado foi usado para comparações estatísticas bidirecionais, e a ANOVA unilateral com o teste de comparações múltiplas de Dunnett foi usada para comparar COVID-19 leve e grave com controles saudáveis. *, p ≤ 0,05; **, p ≤ 0,01; ****, p <0,0001; Res, Aglomerado de macrófagos residentes; Inf, Agrupamento de macrófagos inflamatórios; HC, controle saudável; M, COVID-19 leve; S, COVID-19 grave. Comparando a osteoartrite (OA) com a artrite reumatóide, os pesquisadores descobriram que o tecido de AR contém macrófagos com uma assinatura de inflamação, incluindo a regulação positiva de genes que são induzidos pelo interferon, bem como genes que codificam substâncias químicas inflamatórias no corpo. O gene com o maior aumento de expressão entre eles foi SLAMF7.
Isso foi encontrado em níveis baixos no tecido sinovial das articulações inflamadas por OA, mas em níveis elevados em pacientes com AR. Esteve presente em 55% dos macrófagos neste último, mas <6% dos pacientes com OA. Estava presente em níveis duas vezes mais altos nos macrófagos do líquido sinovial do grupo AR em comparação com o grupo OA, e em cerca de metade e um quarto dos macrófagos em cada grupo, respectivamente. Contudo, isso não era verdade para outro receptor SLAM, apontando para SLAMF7 como sendo específico para macrófagos inflamatórios na AR.
IFN-γ foi encontrado para ser o indutor primário deste receptor em macrófagos, junto com IFN-β, IL-1β e TNF-α em níveis mais baixos. Contudo, a citocina pró-inflamatória IL-6 falhou em induzir a expressão de SLAMF7. Novamente, as citocinas anteriores reduziram os níveis de outro receptor SLAM, CD84, para a metade.
Os pesquisadores também confirmaram que a via JAK desempenhou um papel importante na ativação de macrófagos mediada por SLAMF7. O inibidor de JAK ruxolitinib suprimiu-o de forma eficaz. Na verdade, este medicamento é usado para tratar a mielofibrose, Onde, novamente, macrófagos expressando SLAMF7 ativados são encontrados. Ele também dobra os níveis de CD84, o que pode significar que o IFN-γ tem efeitos opostos e recíprocos sobre esses dois receptores SLAM.
Na próxima etapa, A expressão de SLAMF7 foi induzida em níveis elevados em macrófagos, por IFN-γ. Subseqüentemente, anticorpo monoclonal de ativação ou proteína SLAMF7 recombinante foi adicionado para se ligar aos receptores. Os pesquisadores descobriram que este evento de ligação desencadeou mudanças dramáticas na expressão do gene.
Quase 600 genes foram regulados positivamente - a assinatura de estimulação Macrophage SLAMF7 - juntamente com um aumento em várias citocinas e quimiocinas inflamatórias, mesmo além do aumento causado pelo IFN-γ sozinho. Por exemplo, Os níveis de TNF-α e IL-6 aumentam de picomolares para nanomolares neste momento. Além disso, a expressão do próprio SLAMF7 aumentou ainda mais, sugerindo um ciclo de feedback positivo.
A ligação de macrófagos a SLAMF7 também define um ciclo inflamatório mieloide em movimento, além de preparar o inflamassoma para responder fortemente aos antígenos de ligação a TLR microbianos, ou para citocinas, com uma liberação massiva de IL-1β. Por outro lado, quando uma combinação de IFN-γ + LPS (uma molécula bacteriana potente) foi usada para ativar os macrófagos, o perfil de citocinas característico da ligação de SLAMF7 não foi observado. Contudo, houve uma semelhança parcial entre a resposta de citocinas e o perfil de expressão gênica que ocorreu quando o IFN-γ foi usado pela primeira vez, seguido pela exposição LPS.
Os pesquisadores disseram, “ Este programa de ativação SLAMF7 baseia-se e é uma etapa separada após a estimulação primária de macrófagos por IFN-γ ou outros fatores de diferenciação e ativação de M1 . ” A condição característica deste programa de ativação - o estado inflamatório de macrófago superativado induzido pelo engajamento de SLAMF7 (SAM7) - é uma potencialização inicial dos macrófagos por IFN-γ, em que SLAMF7 é dramaticamente regulado positivamente. Os eventos de ligação neste receptor agora completam a ativação dos macrófagos preparados para produzir um estado hiperinflamatório de ativação de macrófagos.
Este caminho parece ser sustentado e ainda mais amplificado por um ciclo de feedback autócrino, envolvendo TNF-α, que é rapidamente induzido (dentro de duas horas) após o engajamento de SLAMF7 e, em seguida, continua a aumentar ao longo do tempo. A evidência para isso inclui a redução pela metade da expressão de TNF-α por anticorpo anti-TNF, ou silenciando receptores de TNF por siRNA.
Eles descobriram que a pontuação média de ativação de SLAMF7 na AR era quase o dobro daquela de indivíduos com OA, indicando que este receptor está intimamente envolvido na inflamação em pessoas com AR.
De forma similar, perfis de genes de ativação de macrófagos sobrepostos foram gerados tanto na doença inflamatória intestinal (DII) quanto na COVID-19, em comparação com RA. Na verdade, células do fluido de lavagem broncoalveolar e células do tecido intestinal inflamado em COVID-19 e IBD mostraram as mesmas assinaturas de ativação de macrófagos. Eles também observaram uma pontuação de ativação de SLAMF7 dupla no intestino inflamado em relação ao tecido intestinal normal. E em COVID-19 grave, a pontuação foi seis vezes mais alto em comparação com COVID-19 leve. Tudo isso sugere o domínio do programa SAM7 de ativação de macrófagos em condições inflamatórias, especialmente porque o receptor SLAMF7 não é encontrado em macrófagos residentes no tecido normal.
Explorando diferentes subconjuntos de macrófagos, eles descobriram que macrófagos inflamatórios tinham pontuações de ativação extremamente altas em comparação com macrófagos residentes. Novamente, três subconjuntos distintos de macrófagos em pacientes com COVID-19 foram significativamente aumentados em proporção, com dois desses grupos mostrando expansão na doença grave. Interessantemente, estes tiveram as maiores pontuações de ativação, e macrófagos de pacientes com COVID-19 gravemente enfermos tinham níveis de expressão SLAMF7 extremamente altos, junto com níveis muito altos de muitos outros marcadores e receptores inflamatórios e indutíveis por interferon.
Resumidamente, o estado SAM7 pode ser um componente importante da resposta hiperinflamatória observada na pneumonia COVID-19, bem como em RA, e IBD. Contudo, a maneira sequencial em que tal ativação é alcançada também permite o uso de várias contramedidas terapêuticas diferentes. Estes incluem inibidores de JAK como ruxolitinibe, Inibidores de TNF-α, ou bloqueio SLAMF7 por Elotuzumab. A última categoria é especialmente útil porque pode permitir que o programa SAM7 seja inibido seletivamente, enquanto ainda permite que os macrófagos executem suas funções imunológicas essenciais normais.
bioRxiv publica relatórios científicos preliminares que não são revisados por pares e, Portanto, não deve ser considerado conclusivo, orientar a prática clínica / comportamento relacionado à saúde, ou tratadas como informações estabelecidas.
 Novo método de modelagem computacional prevê como os micróbios intestinais mudam ao longo do tempo
Novo método de modelagem computacional prevê como os micróbios intestinais mudam ao longo do tempo
 Medicamento para perda de peso Wegovy aprovado pelo FDA
Medicamento para perda de peso Wegovy aprovado pelo FDA
 O microbioma vaginal pode afetar a eficácia da terapia de prevenção do HIV
O microbioma vaginal pode afetar a eficácia da terapia de prevenção do HIV
 Humanos versus vírus - podemos evitar a extinção em um futuro próximo?
Humanos versus vírus - podemos evitar a extinção em um futuro próximo?
 Micróbios pulmonares podem ajudar a prever resultados em pessoas gravemente doentes
Micróbios pulmonares podem ajudar a prever resultados em pessoas gravemente doentes
 Probióticos como terapia adjuvante para pacientes COVID-19
Probióticos como terapia adjuvante para pacientes COVID-19
 Cientistas desenvolvem peptídeos que restauram o equilíbrio das bactérias intestinais e revertem a aterosclerose
Os pesquisadores continuam a explorar o papel das bactérias intestinais na saúde, incluindo sua ligação com a depressão, doenças autoimunes, saúde mental, e obesidade. Agora, uma equipe de cientista
Cientistas desenvolvem peptídeos que restauram o equilíbrio das bactérias intestinais e revertem a aterosclerose
Os pesquisadores continuam a explorar o papel das bactérias intestinais na saúde, incluindo sua ligação com a depressão, doenças autoimunes, saúde mental, e obesidade. Agora, uma equipe de cientista
 Diabetes tipo 1 ligado ao microbioma intestinal e fatores genéticos
Um novo estudo da Lingköping University na Suécia e da University of Florida revelou que o microbioma intestinal de crianças com alto risco genético de desenvolver diabetes tipo 1 é muito diferente de
Diabetes tipo 1 ligado ao microbioma intestinal e fatores genéticos
Um novo estudo da Lingköping University na Suécia e da University of Florida revelou que o microbioma intestinal de crianças com alto risco genético de desenvolver diabetes tipo 1 é muito diferente de
 Se você tiver mais de 50 anos,
É hora de uma colonoscopia As pessoas adiam fazer certas coisas - limpar a garagem, repintar a sala de estar, lavar as janelas ... e fazer uma colonoscopia. Mas uma colonoscopia é provavelmente a mel
Se você tiver mais de 50 anos,
É hora de uma colonoscopia As pessoas adiam fazer certas coisas - limpar a garagem, repintar a sala de estar, lavar as janelas ... e fazer uma colonoscopia. Mas uma colonoscopia é provavelmente a mel