I macrofagi sono cellule di difesa immunitaria, fanno parte del sistema immunitario innato che osserva le infezioni. Però, la loro risposta a patogeni di qualsiasi tipo può anche innescare un'infiammazione cronica o eccessiva. Questo tipo di attivazione anormale dei macrofagi si osserva nell'artrite reumatoide (RA) e in altre condizioni autoimmuni. Uno degli obiettivi del trattamento dell'AR è quello di modulare gli stati di attivazione dei macrofagi e ridurre l'infiltrazione dei macrofagi nel tessuto infiammato.
Nei polmoni, pure, l'infezione può causare infiammazione indotta dai macrofagi, che porta alla distruzione del tessuto polmonare. Può anche scatenare una tempesta di citochine, visto nella sindrome da distress respiratorio acuto (ARDS). L'attivazione dei macrofagi dipende dai recettori, che a loro volta rispondono a una varietà di segnali esterni. La maggior parte di questi sono mediati da citochine e antigeni presenti sui microbi.
Una delle molecole attivatrici dei macrofagi più note e più importanti è l'interferone-γ (IFN-γ). I macrofagi innescati dall'esposizione all'IFN-γ rispondono più potentemente alla stimolazione successiva. Un'altra classe di attivatori simile contiene agonisti del recettore Toll-like (TLR), quali macrofagi primi in modo tale da secernere molecole che formano il corpo infiammatorio chiamato inflammasoma. L'attivazione dei componenti dell'inflammasoma provoca la morte della cellula per piroptosi insieme al rilascio di interleuchina -1β (IL-1β).
Nelle parole dei ricercatori, “ Una componente importante della risposta dei macrofagi a un segnale primario è la sovraregolazione di un recettore super-attivatore secondario che può quindi trasformare questi macrofagi innescati in un esplosivo, stato infiammatorio potenzialmente patogeno .”
I ricercatori hanno esplorato diverse condizioni infiammatorie come RA, Morbo di Crohn e grave COVID-19, trovando un nuovo recettore macrofagico super-attivante secondario chiamato SLAMF7. Questo, dicono, è fondamentale per la patogenesi di queste condizioni.
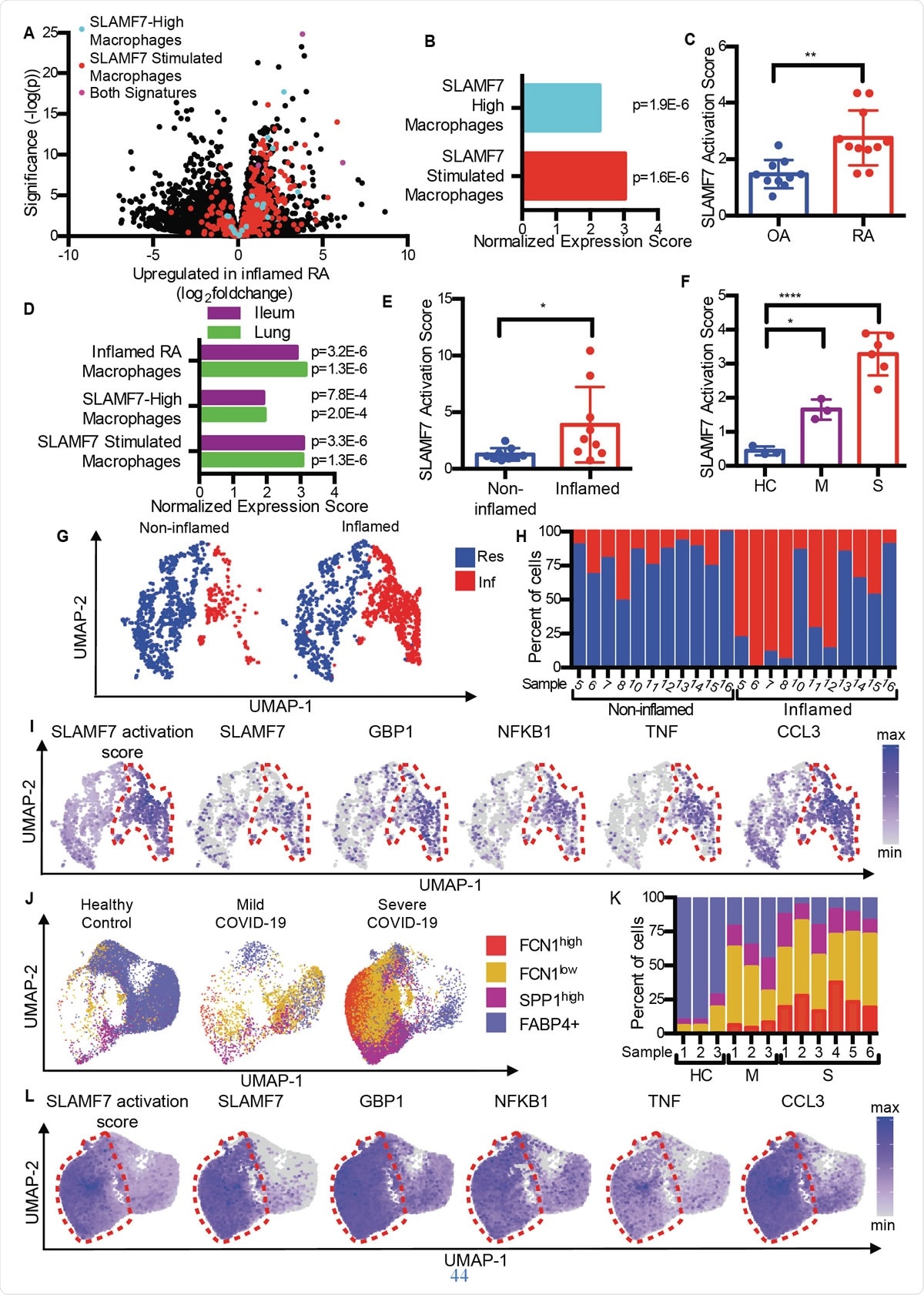 I macrofagi super-attivati SLAMF7 guidano l'infiammazione nelle malattie autoimmuni e infettive. A) Grafico del vulcano dalla Fig. 1A che evidenzia i geni del “SLAMF7-High Macrophage Signature, ” la “Firma di stimolazione del macrofago SLAMF7, ” e geni inclusi in entrambe le firme. B) Analisi dell'arricchimento del set di geni che confronta l'espressione genica differenziale in RA rispetto a OA con "SLAMF7-High Macrophage Signature" e "Macrophage SLAMF7 Stimulation Signature". C) Punteggio di attivazione SLAMF7 per dati bulk RNA-seq su macrofagi sinoviali da pazienti con OA (n=10) o AR (n=11). I dati rappresentano la media ± SD. D) Analisi dell'arricchimento del set genico che confronta l'espressione genica da macrofagi da tessuti ileali infiammati in pazienti con malattia di Crohn o polmoni di pazienti con COVID-19 con la "Firma del macrofago RA infiammato", la "Firma SLAMF7-High Macrophage Signature" e la "Firma di stimolazione Macrophage SLAMF7". E) Punteggio di attivazione SLAMF7 per macrofagi da tessuti ileali non infiammati (n=9) e infiammati (n=9). F) Punteggio di attivazione SLAMF7 per i macrofagi del lavaggio broncoalveolare da controlli sani (n=3), o individui con COVID-19 lieve (n=3) o grave (n=6). I dati in E-F rappresentano la media ± DS. G) Grafico UMAP di cluster di macrofagi da tessuti ileali coinvolti e non. H) Percentuale di macrofagi di ciascun donatore assegnata a ciascun cluster. I) Grafici UMAP che mostrano l'espressione genica di popolazioni di macrofagi ileali. J) Grafico UMAP delle popolazioni di macrofagi di lavaggio broncoalveolare. K) Percentuale di macrofagi di ciascun donatore assegnata a ciascuna popolazione. L) Grafici UMAP che mostrano l'espressione genica per popolazioni di macrofagi di lavaggio broncoalveolare. Il test t appaiato è stato utilizzato per confronti statistici a due vie, e l'ANOVA unidirezionale con il test di confronti multipli di Dunnett è stato utilizzato per confrontare COVID-19 lieve e grave con controlli sani.*, p 0,05; **, p 0,01; ****, p <0,0001; Ris, Cluster di macrofagi residenti; Inf, Cluster di macrofagi infiammatori; HC, controllo sano; M, lieve COVID-19; S, grave COVID-19.
I macrofagi super-attivati SLAMF7 guidano l'infiammazione nelle malattie autoimmuni e infettive. A) Grafico del vulcano dalla Fig. 1A che evidenzia i geni del “SLAMF7-High Macrophage Signature, ” la “Firma di stimolazione del macrofago SLAMF7, ” e geni inclusi in entrambe le firme. B) Analisi dell'arricchimento del set di geni che confronta l'espressione genica differenziale in RA rispetto a OA con "SLAMF7-High Macrophage Signature" e "Macrophage SLAMF7 Stimulation Signature". C) Punteggio di attivazione SLAMF7 per dati bulk RNA-seq su macrofagi sinoviali da pazienti con OA (n=10) o AR (n=11). I dati rappresentano la media ± SD. D) Analisi dell'arricchimento del set genico che confronta l'espressione genica da macrofagi da tessuti ileali infiammati in pazienti con malattia di Crohn o polmoni di pazienti con COVID-19 con la "Firma del macrofago RA infiammato", la "Firma SLAMF7-High Macrophage Signature" e la "Firma di stimolazione Macrophage SLAMF7". E) Punteggio di attivazione SLAMF7 per macrofagi da tessuti ileali non infiammati (n=9) e infiammati (n=9). F) Punteggio di attivazione SLAMF7 per i macrofagi del lavaggio broncoalveolare da controlli sani (n=3), o individui con COVID-19 lieve (n=3) o grave (n=6). I dati in E-F rappresentano la media ± DS. G) Grafico UMAP di cluster di macrofagi da tessuti ileali coinvolti e non. H) Percentuale di macrofagi di ciascun donatore assegnata a ciascun cluster. I) Grafici UMAP che mostrano l'espressione genica di popolazioni di macrofagi ileali. J) Grafico UMAP delle popolazioni di macrofagi di lavaggio broncoalveolare. K) Percentuale di macrofagi di ciascun donatore assegnata a ciascuna popolazione. L) Grafici UMAP che mostrano l'espressione genica per popolazioni di macrofagi di lavaggio broncoalveolare. Il test t appaiato è stato utilizzato per confronti statistici a due vie, e l'ANOVA unidirezionale con il test di confronti multipli di Dunnett è stato utilizzato per confrontare COVID-19 lieve e grave con controlli sani.*, p 0,05; **, p 0,01; ****, p <0,0001; Ris, Cluster di macrofagi residenti; Inf, Cluster di macrofagi infiammatori; HC, controllo sano; M, lieve COVID-19; S, grave COVID-19. Confrontando l'artrosi (OA) con l'artrite reumatoide, i ricercatori hanno scoperto che il tessuto RA contiene macrofagi con una firma infiammatoria, compresa la sovraregolazione dei geni indotti dall'interferone e dei geni che codificano per le sostanze chimiche infiammatorie nel corpo. Il gene con il più alto aumento di espressione tra questi era SLAMF7.
Questo è stato trovato in bassi livelli nel tessuto sinoviale articolare da articolazioni infiammate da OA, ma ad alti livelli nei pazienti con AR. Era presente nel 55% dei macrofagi in quest'ultimo, ma <6% dei pazienti con OA. Era presente a livelli due volte più elevati nei macrofagi del liquido sinoviale del gruppo RA rispetto al gruppo OA, e su circa la metà e un quarto dei macrofagi di ciascun gruppo, rispettivamente. Però, questo non era vero per un altro recettore SLAM, indicando SLAMF7 come specifico per i macrofagi infiammatori nell'AR.
Si è scoperto che l'IFN-γ è il principale induttore di questo recettore sui macrofagi, insieme a IFN-β, IL-1β e TNF-α a livelli inferiori. Però, la citochina pro-infiammatoria IL-6 non è riuscita a indurre l'espressione di SLAMF7. Ancora, le prime citochine hanno ridotto i livelli di un altro recettore SLAM, CD84, a metà.
I ricercatori hanno anche confermato che la via JAK ha svolto un ruolo importante nell'attivazione dei macrofagi mediata da SLAMF7. L'inibitore JAK ruxolitinib lo ha soppresso efficacemente. Infatti, questo farmaco è usato per trattare la mielofibrosi, dove, ancora, si trovano macrofagi attivati che esprimono SLAMF7. Raddoppia anche i livelli del CD84, il che può significare che l'IFN-γ ha effetti opposti e reciproci su questi due recettori SLAM.
Nel passaggio successivo, L'espressione di SLAMF7 è stata indotta ad alti livelli sui macrofagi, di IFN-γ. Successivamente, l'attivazione dell'anticorpo monoclonale o della proteina SLAMF7 ricombinante è stata aggiunta per legarsi ai recettori. I ricercatori hanno scoperto che questo evento vincolante ha innescato cambiamenti drammatici nell'espressione genica.
Quasi 600 geni sono stati sovraregolati – il Macrophage SLAMF7 Stimulation Signature – insieme a un aumento di diverse citochine e chemochine infiammatorie, anche oltre l'aumento causato dal solo IFN-γ. Ad esempio, I livelli di TNF-α e IL-6 aumentano da livelli picomolari a livelli nanomolari in questo momento. Inoltre, l'espressione dello stesso SLAMF7 è ulteriormente aumentata, suggerendo un ciclo di feedback positivo.
Il legame dei macrofagi a SLAMF7 mette in moto anche un ciclo infiammatorio mieloide, oltre a innescare l'inflammasoma per rispondere fortemente agli antigeni microbici TLR-binding, o alle citochine, con un massiccio rilascio di IL-1β. D'altra parte, quando una combinazione di IFN-γ + LPS (una potente molecola batterica) è stata utilizzata per attivare i macrofagi, il profilo delle citochine caratteristico del legame SLAMF7 non è stato osservato. Però, c'era una somiglianza parziale tra la risposta delle citochine e il profilo di espressione genica che si è verificata quando l'IFN-γ è stato utilizzato per la prima volta, seguito da esposizione a LPS.
I ricercatori hanno detto, “ Questo programma di attivazione SLAMF7 si basa ed è un passaggio separato dopo la stimolazione primaria dei macrofagi da parte dell'IFN-γ o altri fattori di differenziazione e attivazione M1 .” La condizione caratteristica di questo programma di attivazione - lo stato infiammatorio del macrofago superattivato indotto dall'impegno di SLAMF7 (SAM7) - è un potenziamento iniziale dei macrofagi da parte dell'IFN-γ, per cui SLAMF7 è drammaticamente sovraregolato. Gli eventi di legame a questo recettore ora completano l'attivazione dei macrofagi innescati per produrre uno stato iperinfiammatorio di attivazione dei macrofagi.
Questo percorso sembra essere sostenuto e ulteriormente amplificato da un ciclo di feedback autocrino, coinvolgendo TNF-α, che viene rapidamente indotto (entro due ore) dopo l'impegno di SLAMF7 e poi continua ad accumularsi nel tempo. La prova di ciò include il dimezzamento dell'espressione del TNF-α da parte dell'anticorpo anti-TNF, o silenziando i recettori del TNF mediante siRNA.
Hanno scoperto che il punteggio medio di attivazione di SLAMF7 nell'AR era quasi il doppio di quello degli individui con OA, indicando che questo recettore è strettamente coinvolto nell'infiammazione in quelli con AR.
Allo stesso modo, sono stati generati profili genici di attivazione dei macrofagi sovrapposti sia nella malattia infiammatoria intestinale (IBD) che nel COVID-19, rispetto a RA. Infatti, Le cellule del fluido di lavaggio broncoalveolare e le cellule del tessuto intestinale infiammato in COVID-19 e IBD hanno mostrato le stesse firme di attivazione dei macrofagi. Hanno anche notato un doppio punteggio di attivazione SLAMF7 nell'intestino infiammato rispetto al normale tessuto intestinale. E in caso di grave COVID-19, il punteggio era sei volte superiore rispetto al lieve COVID-19. Tutto ciò suggerisce il predominio del programma SAM7 di attivazione dei macrofagi in condizioni infiammatorie, soprattutto perché il recettore SLAMF7 non si trova sui macrofagi residenti nel tessuto normale.
Esplorazione di diversi sottoinsiemi di macrofagi, hanno scoperto che i macrofagi infiammatori avevano punteggi di attivazione estremamente elevati rispetto ai macrofagi residenti. Ancora, tre distinti sottogruppi di macrofagi nei pazienti COVID-19 sono stati sorprendentemente aumentati in proporzione, con due di questi gruppi che mostrano espansione nella malattia grave. interessante, questi avevano i punteggi di attivazione più alti, e i macrofagi di pazienti gravemente malati di COVID-19 avevano livelli di espressione di SLAMF7 estremamente elevati, insieme a livelli molto elevati di molti altri marcatori e recettori infiammatori e inducibili dall'interferone.
In breve, lo stato SAM7 può essere una componente importante della risposta iperinfiammatoria osservata nella polmonite COVID-19, così come in RA, e IBD. Però, il modo sequenziale in cui si realizza tale attivazione consente inoltre l'utilizzo di molteplici e differenti contromisure terapeutiche. Questi includono inibitori JAK come ruxolitinib, inibitori del TNF-α, o blocco SLAMF7 da parte di Elotuzumab. L'ultima categoria è particolarmente utile in quanto può consentire l'inibizione selettiva del programma SAM7 pur consentendo ai macrofagi di eseguire le loro normali funzioni immunitarie essenziali.
bioRxiv pubblica rapporti scientifici preliminari non sottoposti a revisione paritaria e, perciò, non deve essere considerato conclusivo, guidare la pratica clinica/comportamento relativo alla salute, o trattati come informazioni stabilite.
 Il microbioma del pene è un serbatoio per i batteri associati alla vaginosi batterica
Il microbioma del pene è un serbatoio per i batteri associati alla vaginosi batterica
 Un approccio multi-omico allo sviluppo di farmaci contro il COVID-19
Un approccio multi-omico allo sviluppo di farmaci contro il COVID-19
 Vaccinazione anti-rotavirus non collegata al rischio di diabete mellito di tipo 1
Vaccinazione anti-rotavirus non collegata al rischio di diabete mellito di tipo 1
 Una nuova ricerca identifica un legame tra il microbioma intestinale e gli ictus
Una nuova ricerca identifica un legame tra il microbioma intestinale e gli ictus
 Mappa dettagliata del microbioma della lingua umana
Mappa dettagliata del microbioma della lingua umana
 Un tipo di batteri intestinali può aumentare il rischio di cancro intestinale
Un tipo di batteri intestinali può aumentare il rischio di cancro intestinale
 Un nuovo recettore dei macrofagi super-attivante potrebbe spiegare l'iperinfiammazione nella grave COVID-19
Limmunità è una cosa curiosa. Pur essendo essenziale per proteggere il corpo dallinvasione di agenti patogeni e antigeni estranei, può anche rivoltarsi contro il corpo e innescare processi immunologic
Un nuovo recettore dei macrofagi super-attivante potrebbe spiegare l'iperinfiammazione nella grave COVID-19
Limmunità è una cosa curiosa. Pur essendo essenziale per proteggere il corpo dallinvasione di agenti patogeni e antigeni estranei, può anche rivoltarsi contro il corpo e innescare processi immunologic
 La melma di pesce potrebbe essere una potenziale fonte di antibiotici trova studio
Con lavvento di batteri multiresistenti e la mancanza di nuovi antibiotici, i ricercatori sono alla ricerca di nuove molecole in grado di combattere questi agenti patogeni. Un team di ricercatori ha o
La melma di pesce potrebbe essere una potenziale fonte di antibiotici trova studio
Con lavvento di batteri multiresistenti e la mancanza di nuovi antibiotici, i ricercatori sono alla ricerca di nuove molecole in grado di combattere questi agenti patogeni. Un team di ricercatori ha o
 Dieta e nutrizione influenzano il microbioma nella mucosa del colon
La dieta è importante per mantenere la salute umana, ma il suo meccanismo sottostante non è ancora completamente compreso. Ora, un team di ricercatori fa luce sulla connessione tra dieta e salute, e h
Dieta e nutrizione influenzano il microbioma nella mucosa del colon
La dieta è importante per mantenere la salute umana, ma il suo meccanismo sottostante non è ancora completamente compreso. Ora, un team di ricercatori fa luce sulla connessione tra dieta e salute, e h