Macrofagen zijn immuunafweercellen, maakt deel uit van het aangeboren immuunsysteem dat op infecties let. Echter, hun reactie op pathogenen van welke soort dan ook kan ook chronische of overmatige ontstekingen veroorzaken. Dit soort abnormale activering van macrofagen wordt gezien bij reumatoïde artritis (RA) en andere auto-immuunziekten. Een doel van RA-behandeling is het moduleren van de activeringstoestanden van macrofagen en het verminderen van de infiltratie van macrofagen in het ontstoken weefsel.
In de longen, te, infectie kan macrofaag-geïnduceerde ontsteking veroorzaken, wat resulteert in de vernietiging van longweefsel. Het kan ook een cytokinestorm veroorzaken, gezien bij acuut respiratoir distress syndroom (ARDS). Activering van macrofagen is afhankelijk van receptoren, die op hun beurt reageren op een verscheidenheid aan externe signalen. De meeste hiervan worden gemedieerd door cytokinen en antigenen die aanwezig zijn op microben.
Een van de bekendste en belangrijkste macrofaagactivatormoleculen is interferon-γ (IFN-γ). Macrofagen die zijn geprimed door blootstelling aan IFN-γ reageren krachtiger op daaropvolgende stimulatie. Een andere vergelijkbare activatorklasse bevat Toll-like receptor (TLR) agonisten, die macrofagen zodanig primen dat ze moleculen afscheiden die het inflammatoire lichaam vormen dat het inflammasoom wordt genoemd. Activering van inflammasoomcomponenten zorgt ervoor dat de cel sterft door pyroptose samen met de afgifte van interleukine -1β (IL-1β).
In de woorden van de onderzoekers, “ Een belangrijk onderdeel van de macrofaagrespons op een primair signaal is de opregulatie van een secundaire superactivatorreceptor die deze geprimede macrofagen vervolgens kan transformeren in een explosief, potentieel pathogene inflammatoire toestand .”
De onderzoekers onderzochten verschillende ontstekingsaandoeningen zoals RA, ziekte van Crohn en ernstige COVID-19, het vinden van een nieuwe secundaire superactiverende macrofaagreceptor genaamd SLAMF7. Dit, ze zeggen, is de sleutel tot de pathogenese van deze aandoeningen.
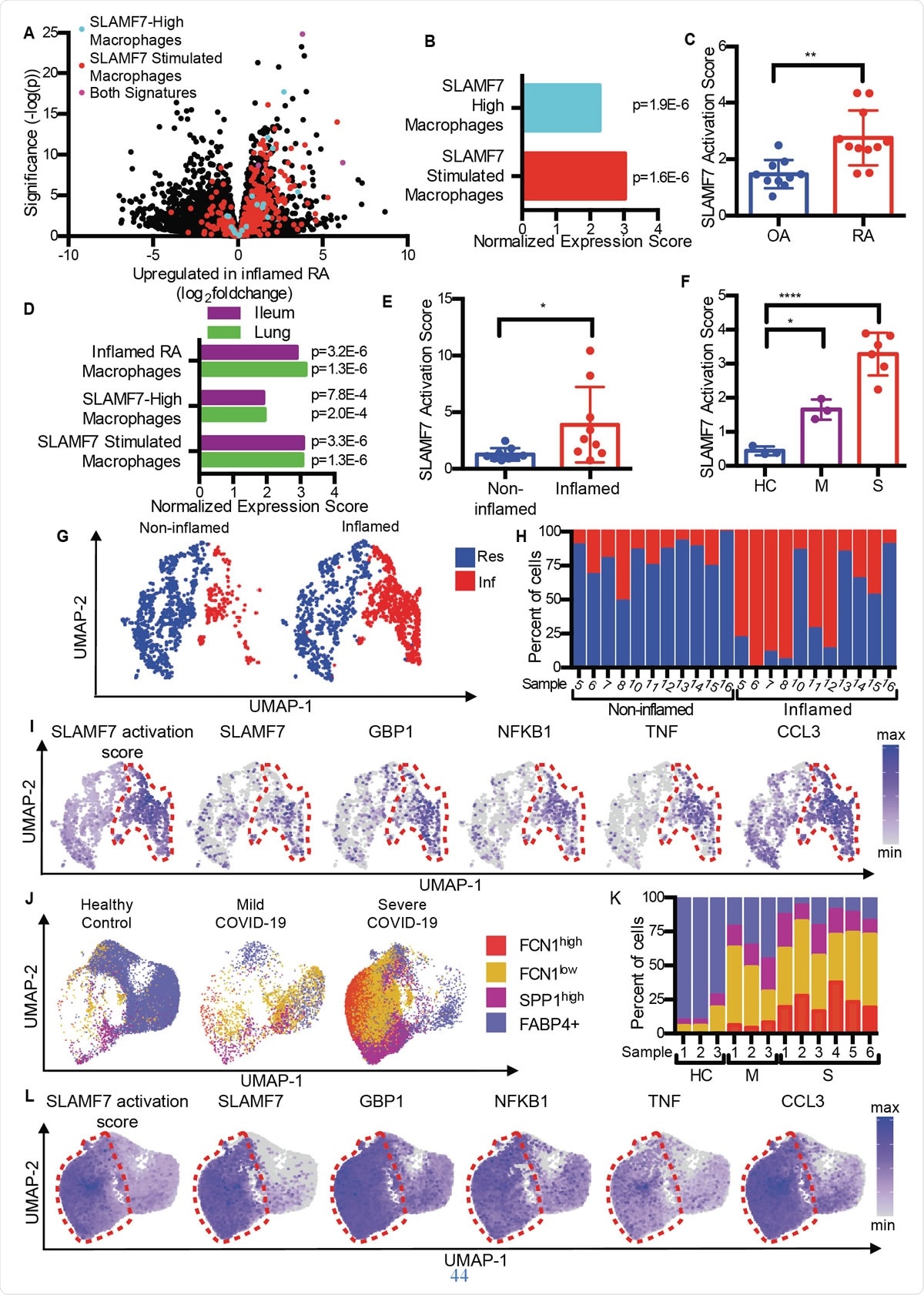 SLAMF7 supergeactiveerde macrofagen veroorzaken ontstekingen bij auto-immuunziekten en infectieziekten. A) Vulkaanplot uit Fig. 1A die genen benadrukt van de "SLAMF7-High Macrophage Signature, ” de “Macrofaag SLAMF7 Stimulatiehandtekening, ” en genen die in beide handtekeningen zijn opgenomen. B) Analyse van genensetverrijking waarbij differentiële genexpressie in RA versus OA wordt vergeleken met de "SLAMF7-High Macrophage Signature" en "Macrophage SLAMF7 Stimulation Signature". C) SLAMF7-activeringsscore voor bulk-RNA-seq-gegevens over synoviale macrofagen van patiënten met artrose (n=10) of RA (n=11). Gegevens vertegenwoordigen gemiddelde ± SD. D) Analyse van genensetverrijking waarbij genexpressie van macrofagen van ontstoken ileumweefsels wordt vergeleken bij patiënten met de ziekte van Crohn of longen van patiënten met COVID-19 met de "Inflamed RA Macrophage Signature", de "SLAMF7-High Macrophage Signature" en de "Macrophage SLAMF7 Stimulation Signature." E) SLAMF7-activeringsscore voor macrofagen van niet-ontstoken (n=9) en ontstoken ileale weefsels (n=9). F) SLAMF7-activeringsscore voor bronchoalveolaire lavage-macrofagen van gezonde controles (n=3), of personen met milde (n=3) of ernstige COVID-19 (n=6). Gegevens in E-F vertegenwoordigen gemiddelde ± SD. G) UMAP-plot van macrofaagclusters van betrokken en niet-betrokken ileale weefsels. H) Percentage macrofagen van elke donor toegewezen aan elk cluster. I) UMAP-plots die genexpressie van ileale macrofaagpopulaties tonen. J) UMAP-plot van macrofaagpopulaties van bronchoalveolaire lavage. K) Percentage macrofagen van elke donor toegewezen aan elke populatie. L) UMAP-plots die genexpressie tonen voor bronchoalveolaire lavage-macrofaagpopulaties. De gepaarde t-test werd gebruikt voor statistische vergelijkingen in twee richtingen, en de eenrichtings-ANOVA met Dunnett's meervoudige vergelijkingstest werd gebruikt om milde en ernstige COVID-19 te vergelijken met gezonde controles.*, p ≤ 0,05; **, p 0,01; ****, p <0,0001; onderzoek, Resident macrofaagcluster; Inf, Inflammatoire macrofaagcluster; HC, gezonde controle; M, milde COVID-19; S, ernstige COVID-19.
SLAMF7 supergeactiveerde macrofagen veroorzaken ontstekingen bij auto-immuunziekten en infectieziekten. A) Vulkaanplot uit Fig. 1A die genen benadrukt van de "SLAMF7-High Macrophage Signature, ” de “Macrofaag SLAMF7 Stimulatiehandtekening, ” en genen die in beide handtekeningen zijn opgenomen. B) Analyse van genensetverrijking waarbij differentiële genexpressie in RA versus OA wordt vergeleken met de "SLAMF7-High Macrophage Signature" en "Macrophage SLAMF7 Stimulation Signature". C) SLAMF7-activeringsscore voor bulk-RNA-seq-gegevens over synoviale macrofagen van patiënten met artrose (n=10) of RA (n=11). Gegevens vertegenwoordigen gemiddelde ± SD. D) Analyse van genensetverrijking waarbij genexpressie van macrofagen van ontstoken ileumweefsels wordt vergeleken bij patiënten met de ziekte van Crohn of longen van patiënten met COVID-19 met de "Inflamed RA Macrophage Signature", de "SLAMF7-High Macrophage Signature" en de "Macrophage SLAMF7 Stimulation Signature." E) SLAMF7-activeringsscore voor macrofagen van niet-ontstoken (n=9) en ontstoken ileale weefsels (n=9). F) SLAMF7-activeringsscore voor bronchoalveolaire lavage-macrofagen van gezonde controles (n=3), of personen met milde (n=3) of ernstige COVID-19 (n=6). Gegevens in E-F vertegenwoordigen gemiddelde ± SD. G) UMAP-plot van macrofaagclusters van betrokken en niet-betrokken ileale weefsels. H) Percentage macrofagen van elke donor toegewezen aan elk cluster. I) UMAP-plots die genexpressie van ileale macrofaagpopulaties tonen. J) UMAP-plot van macrofaagpopulaties van bronchoalveolaire lavage. K) Percentage macrofagen van elke donor toegewezen aan elke populatie. L) UMAP-plots die genexpressie tonen voor bronchoalveolaire lavage-macrofaagpopulaties. De gepaarde t-test werd gebruikt voor statistische vergelijkingen in twee richtingen, en de eenrichtings-ANOVA met Dunnett's meervoudige vergelijkingstest werd gebruikt om milde en ernstige COVID-19 te vergelijken met gezonde controles.*, p ≤ 0,05; **, p 0,01; ****, p <0,0001; onderzoek, Resident macrofaagcluster; Inf, Inflammatoire macrofaagcluster; HC, gezonde controle; M, milde COVID-19; S, ernstige COVID-19. Artrose (OA) vergelijken met reumatoïde artritis, de onderzoekers ontdekten dat RA-weefsel macrofagen bevat met een ontstekingssignatuur, inclusief de opregulatie van genen die worden geïnduceerd door interferon, evenals genen die coderen voor ontstekingschemicaliën in het lichaam. Het gen met de hoogste toename in expressie hiervan was SLAMF7.
Dit werd in lage concentraties gevonden in gewrichtssynoviaal weefsel van gewrichten die ontstoken waren door artrose, maar op hoge niveaus bij RA-patiënten. Het was aanwezig in 55% van de macrofagen in de laatste, maar <6% van de patiënten met artrose. Het was aanwezig in tweemaal hogere niveaus in synoviale vloeistofmacrofagen van de RA-groep in vergelijking met de OA-groep, en op ongeveer de helft en een kwart van de macrofagen in elke groep, respectievelijk. Echter, dit gold niet voor een andere SLAM-receptor, wijzend op SLAMF7 als specifiek voor inflammatoire macrofagen bij RA.
IFN-γ bleek de primaire inductor van deze receptor op macrofagen, samen met IFN-β, IL-1β en TNF-α op lagere niveaus. Echter, het pro-inflammatoire cytokine IL-6 kon SLAMF7-expressie niet induceren. Opnieuw, de voormalige cytokinen verlaagden de niveaus van een andere SLAM-receptor, CD84, tot de helft.
De onderzoekers bevestigden ook dat de JAK-route een belangrijke rol speelde bij SLAMF7-gemedieerde macrofaagactivering. De JAK-remmer ruxolitinib onderdrukte het effectief. In feite, dit medicijn wordt gebruikt om myelofibrose te behandelen, waar, opnieuw, geactiveerde SLAMF7 tot expressie brengende macrofagen worden gevonden. Het verdubbelt ook de CD84-niveaus, wat kan betekenen dat IFN-γ tegengestelde en wederzijdse effecten heeft op deze twee SLAM-receptoren.
In de volgende stap, SLAMF7-expressie werd op hoge niveaus op macrofagen geïnduceerd, door IFN-γ. Vervolgens, activerend monoklonaal antilichaam of recombinant SLAMF7-eiwit werd toegevoegd om aan de receptoren te binden. De onderzoekers ontdekten dat deze bindingsgebeurtenis dramatische veranderingen in genexpressie veroorzaakte.
Bijna 600 genen werden opgereguleerd - de Macrophage SLAMF7 Stimulation Signature - samen met een toename van verschillende inflammatoire cytokinen en chemokinen, zelfs verder dan de stijging veroorzaakt door IFN-γ alleen. Bijvoorbeeld, TNF-α- en IL-6-niveaus stijgen op dit moment van picomolaire naar nanomolaire niveaus. Bovendien, de expressie van SLAMF7 zelf nam nog verder toe, suggereert een positieve feedbackloop.
Binding van macrofagen aan SLAMF7 zet ook een myeloïde ontstekingscyclus in gang, naast het primen van het inflammasoom om sterk te reageren op microbiële TLR-bindende antigenen, of aan cytokinen, met een massale afgifte van IL-1β. Anderzijds, wanneer een combinatie van IFN-γ + LPS (een krachtig bacterieel molecuul) werd gebruikt om de macrofagen te activeren, het cytokineprofiel dat kenmerkend is voor SLAMF7-binding werd niet waargenomen. Echter, er was een gedeeltelijke overeenkomst tussen de cytokinerespons en het genexpressieprofiel dat optrad toen IFN-γ voor het eerst werd gebruikt, gevolgd door LPS-belichting.
De onderzoekers zeiden, “ Dit SLAMF7-activeringsprogramma berust op en is een afzonderlijke stap na primaire stimulatie van macrofagen door IFN-γ of andere M1-differentiatie- en activeringsfactoren .” De karakteristieke toestand van dit activeringsprogramma - de supergeactiveerde macrofaagontstekingstoestand geïnduceerd door SLAMF7-engagement (SAM7) - is een initiële versterking van de macrofagen door IFN-γ, waarbij SLAMF7 drastisch wordt opgereguleerd. Bindingsgebeurtenissen op deze receptor voltooien nu de activering van de geprimede macrofagen om een hyperinflammatoire toestand van macrofaagactivering te produceren.
Deze route lijkt te worden ondersteund en verder versterkt door een autocriene feedbacklus, waarbij TNF-α betrokken is, die snel wordt opgewekt (binnen twee uur) na het inschakelen van SLAMF7 en zich vervolgens in de loop van de tijd blijft opbouwen. Bewijs hiervoor omvat de halvering van TNF-α-expressie door anti-TNF-antilichaam, of door TNF-receptoren tot zwijgen te brengen door siRNA.
Ze ontdekten dat de gemiddelde SLAMF7-activeringsscore bij RA bijna het dubbele was van die van personen met artrose, wat aangeeft dat deze receptor nauw betrokken is bij ontstekingen bij mensen met RA.
evenzo, overlappende macrofaagactiveringsgenprofielen werden gegenereerd, zowel bij inflammatoire darmaandoeningen (IBD) als bij COVID-19, vergeleken met RA. In feite, bronchoalveolaire lavagevloeistofcellen en cellen van ontstoken darmweefsel bij COVID-19 en IBD vertoonden dezelfde macrofaagactiveringssignaturen. Ze merkten ook een tweevoudige SLAMF7-activeringsscore op in ontstoken darm in vergelijking met normaal darmweefsel. En bij ernstige COVID-19, de score was zes keer hoger vergeleken met milde COVID-19. Dit alles suggereert de dominantie van het SAM7-programma van macrofaagactivering bij inflammatoire aandoeningen, vooral omdat de SLAMF7-receptor niet wordt gevonden op residente macrofagen in normaal weefsel.
Het verkennen van verschillende subsets van macrofagen, ze ontdekten dat inflammatoire macrofagen extreem hoge activeringsscores hadden in vergelijking met residente macrofagen. Opnieuw, drie verschillende subsets van macrofagen bij COVID-19-patiënten waren opvallend verhoogd in verhouding, waarbij twee van deze groepen expansie vertoonden bij ernstige ziekte. interessant, deze hadden de hoogste activeringsscores, en macrofagen van ernstig zieke COVID-19-patiënten hadden extreem hoge SLAMF7-expressieniveaus, samen met zeer hoge niveaus van vele andere inflammatoire en interferon-induceerbare markers en receptoren.
Kortom, de SAM7-toestand kan een belangrijk onderdeel zijn van de hyperinflammatoire respons die wordt gezien bij COVID-19-pneumonie, evenals in RA, en IBD. Echter, de opeenvolgende manier waarop een dergelijke activering wordt bereikt, maakt ook het gebruik van meerdere verschillende therapeutische tegenmaatregelen mogelijk. Deze omvatten JAK-remmers zoals ruxolitinib, TNF-α-remmers, of SLAMF7-blokkade door Elotuzumab. De laatste categorie is vooral nuttig omdat het het SAM7-programma mogelijk selectief kan remmen, terwijl macrofagen nog steeds hun normale essentiële immuunfuncties kunnen uitvoeren.
bioRxiv publiceert voorlopige wetenschappelijke rapporten die niet peer-reviewed zijn en, daarom, mag niet als definitief worden beschouwd, begeleiden klinische praktijk/gezondheidsgerelateerd gedrag, of behandeld als gevestigde informatie.
 Een smalle slokdarm openen
Een smalle slokdarm openen
 Rauw voer voor huisdieren een risico voor mens en dier
Rauw voer voor huisdieren een risico voor mens en dier
 Wiskundig model onthult het risico op SARS-CoV-2-infectie na transplantatie van fecale microbiota
Wiskundig model onthult het risico op SARS-CoV-2-infectie na transplantatie van fecale microbiota
 Genetisch risico op auto-immuniteit kan verband houden met verschillen in darmmicrobioom
Genetisch risico op auto-immuniteit kan verband houden met verschillen in darmmicrobioom
 Nieuwe computationele modelleringsmethode voorspelt hoe darmmicroben in de loop van de tijd veranderen
Nieuwe computationele modelleringsmethode voorspelt hoe darmmicroben in de loop van de tijd veranderen
 Fastfood kan een hoofdschuldige zijn bij tienerdepressie
Fastfood kan een hoofdschuldige zijn bij tienerdepressie
 Orgaanchiptechnologie verbetert de studie van de darm voor gepersonaliseerde geneeskunde
Onderzoekers hebben orgaanchiptechnologie ontwikkeld met behulp van van donoren afgeleide menselijke darmcellen die voordelen biedt ten opzichte van organoïden en nieuwe mogelijkheden biedt voor geper
Orgaanchiptechnologie verbetert de studie van de darm voor gepersonaliseerde geneeskunde
Onderzoekers hebben orgaanchiptechnologie ontwikkeld met behulp van van donoren afgeleide menselijke darmcellen die voordelen biedt ten opzichte van organoïden en nieuwe mogelijkheden biedt voor geper
 Microbioom kan helpen bij het identificeren van pre-kankerrisico bij vrouwen met HPV
Een nieuwe studie gepubliceerd in het open-access tijdschrift PLOS-pathogenen in maart 2020 meldt het mogelijke gebruik van de bacterie Gardnerella gevonden in de baarmoederhals en vagina van vrou
Microbioom kan helpen bij het identificeren van pre-kankerrisico bij vrouwen met HPV
Een nieuwe studie gepubliceerd in het open-access tijdschrift PLOS-pathogenen in maart 2020 meldt het mogelijke gebruik van de bacterie Gardnerella gevonden in de baarmoederhals en vagina van vrou
 Kunststoffen die nu vaak worden aangetroffen in menselijke ontlasting
Jaarlijks komt er bijna acht miljard ton plastic in de oceanen terecht. Deze enorme hoeveelheid plastic spoelt aan of valt uiteen in kleine stukjes van minder dan 5 millimeter in diameter en worden mi
Kunststoffen die nu vaak worden aangetroffen in menselijke ontlasting
Jaarlijks komt er bijna acht miljard ton plastic in de oceanen terecht. Deze enorme hoeveelheid plastic spoelt aan of valt uiteen in kleine stukjes van minder dan 5 millimeter in diameter en worden mi