A makrofágok immunvédő sejtek, a veleszületett immunrendszer része, amely figyeli a fertőzéseket. Azonban, bármilyen kórokozóra adott válaszuk krónikus vagy túlzott gyulladást is kiválthat. Ez a fajta kóros makrofág -aktiváció reumatoid artritiszben (RA) és más autoimmun állapotokban figyelhető meg. Az RA kezelés egyik célja a makrofág aktivációs állapotok módosítása és a makrofágok beszivárgásának csökkentése a gyulladt szövetben.
A tüdőben, is, a fertőzés makrofágok okozta gyulladást okozhat, ami a tüdőszövet pusztulását eredményezi. Cytokin vihart is indíthat, akut légzési distressz szindrómában (ARDS) észlelték. A makrofágok aktiválása a receptoroktól függ, amelyek viszont különféle külső jelekre reagálnak. Ezek többségét a mikrobákon jelen lévő citokinek és antigének közvetítik.
Az egyik legismertebb és legfontosabb makrofág aktiváló molekula az interferon-γ (IFN-γ). Az IFN-γ expozícióval alapozott makrofágok erőteljesebben reagálnak a későbbi stimulációra. Egy másik hasonló aktivátorosztály Toll-like receptor (TLR) agonistákat tartalmaz, amelyek a makrofágokat úgy töltik fel, hogy molekulákat választanak ki, amelyek a gyulladásos testet alkotják. A gyulladásos komponensek aktiválása a sejt pusztulását okozza, az interleukin -1β (IL -1β) felszabadulásával együtt.
A kutatók szavaival élve „ Az elsődleges jelre adott makrofágválasz fontos összetevője egy másodlagos szuperaktivátor receptor felülszabályozása, amely aztán ezeket az alapozott makrofágokat robbanóanyaggá tudja alakítani, potenciálisan patogén gyulladásos állapot . ”
A kutatók számos gyulladásos állapotot vizsgáltak, mint például az RA, Crohn-betegség és súlyos COVID-19, új, másodlagos, szuper-aktiváló makrofág receptor megtalálása SLAMF7 néven. Ez, azt mondják, kulcsfontosságú ezen állapotok patogenezisében.
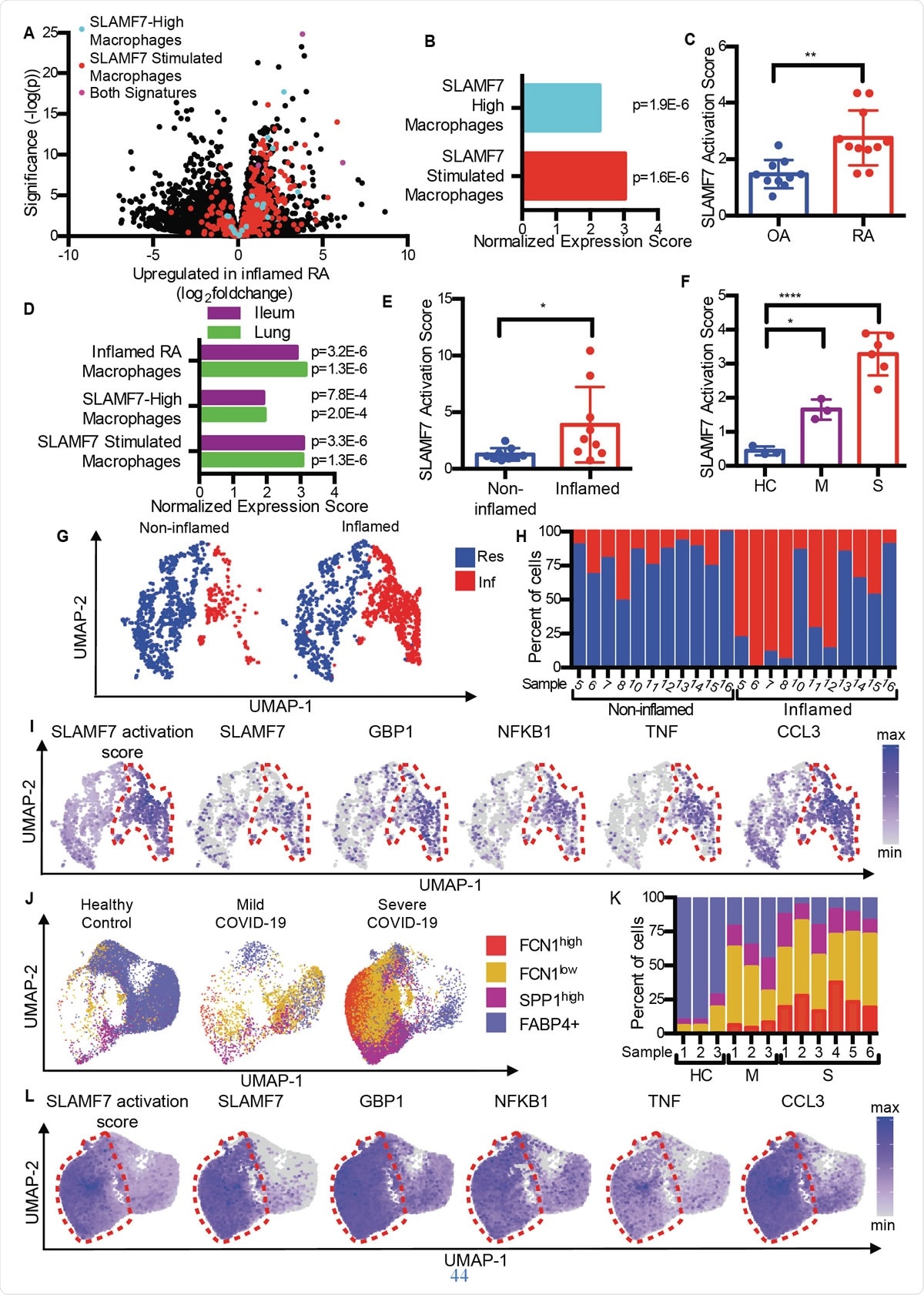 A SLAMF7 szuper-aktivált makrofágok gyulladást okoznak autoimmun és fertőző betegségekben. A) Az 1A. Ábrán látható vulkánrajz, amely kiemeli a „SLAMF7-High Macrophage Signature” génjeit, ”A„ Macrophage SLAMF7 Stimulation Signature, ”És mindkét aláírásban szereplő gének. B) Génkészlet-dúsítási elemzés, amely összehasonlítja az RA és az OA közötti különböző génexpressziót a „SLAMF7-High Macrophage Signature” és a „Macrophage SLAMF7 Stimulation Signature” modellekkel. C) SLAMF7 aktivációs pontszám az OA (n =10) vagy RA (n =11) betegek szinoviális makrofágjaira vonatkozó tömeges RNS-seq adatokhoz. Az adatok átlag ± SD. D) Génkészlet-dúsítási elemzés, amely összehasonlítja a gyulladt ileális szövetek makrofágjaiból származó génexpressziót Crohn-betegségben szenvedő betegekben vagy COVID-19-es betegek tüdőjében, „Inflamed RA Macrophage Signature”, a „SLAMF7-High Macrophage Signature” és a „Macrophage SLAMF7 Stimulation Signature”. E) SLAMF7 aktivációs pontszám nem gyulladt (n =9) és gyulladt ileális szövetek (n =9) makrofágjai esetében. F) SLAMF7 aktivációs pontszám a bronchoalveolaris mosó makrofágokhoz egészséges kontrollokból (n =3), vagy enyhe (n =3) vagy súlyos COVID-19 (n =6) betegek. Az E-F-ben szereplő adatok átlag ± SD-t képviselnek. G) Az érintett és nem érintett ileális szövetekből származó makrofág -klaszterek UMAP -diagramja. H) Az egyes klaszterekhez rendelt donorok makrofágjainak százaléka. I) Az ileális makrofág populációk génexpresszióját bemutató UMAP -diagramok. J) A bronchoalveolaris mosó makrofág populációk UMAP -diagramja. K) Az egyes donorokból származó makrofágok százalékos aránya az egyes populációkhoz. L) UMAP grafikonok, amelyek gén expressziót mutatnak a bronchoalveoláris mosó makrofág populációk számára. A párosított t-tesztet kétirányú statisztikai összehasonlításra használták, és az egyirányú ANOVA-t Dunnett többszörös összehasonlítási tesztjével az enyhe és súlyos COVID-19 és az egészséges kontrollok összehasonlítására használták.*, p <0,05; **, p <0,01; ****, p <0,0001; Res, Lakó makrofág klaszter; Inf, Gyulladásos makrofág klaszter; HC, egészséges kontroll; M, enyhe COVID-19; S, súlyos COVID-19.
A SLAMF7 szuper-aktivált makrofágok gyulladást okoznak autoimmun és fertőző betegségekben. A) Az 1A. Ábrán látható vulkánrajz, amely kiemeli a „SLAMF7-High Macrophage Signature” génjeit, ”A„ Macrophage SLAMF7 Stimulation Signature, ”És mindkét aláírásban szereplő gének. B) Génkészlet-dúsítási elemzés, amely összehasonlítja az RA és az OA közötti különböző génexpressziót a „SLAMF7-High Macrophage Signature” és a „Macrophage SLAMF7 Stimulation Signature” modellekkel. C) SLAMF7 aktivációs pontszám az OA (n =10) vagy RA (n =11) betegek szinoviális makrofágjaira vonatkozó tömeges RNS-seq adatokhoz. Az adatok átlag ± SD. D) Génkészlet-dúsítási elemzés, amely összehasonlítja a gyulladt ileális szövetek makrofágjaiból származó génexpressziót Crohn-betegségben szenvedő betegekben vagy COVID-19-es betegek tüdőjében, „Inflamed RA Macrophage Signature”, a „SLAMF7-High Macrophage Signature” és a „Macrophage SLAMF7 Stimulation Signature”. E) SLAMF7 aktivációs pontszám nem gyulladt (n =9) és gyulladt ileális szövetek (n =9) makrofágjai esetében. F) SLAMF7 aktivációs pontszám a bronchoalveolaris mosó makrofágokhoz egészséges kontrollokból (n =3), vagy enyhe (n =3) vagy súlyos COVID-19 (n =6) betegek. Az E-F-ben szereplő adatok átlag ± SD-t képviselnek. G) Az érintett és nem érintett ileális szövetekből származó makrofág -klaszterek UMAP -diagramja. H) Az egyes klaszterekhez rendelt donorok makrofágjainak százaléka. I) Az ileális makrofág populációk génexpresszióját bemutató UMAP -diagramok. J) A bronchoalveolaris mosó makrofág populációk UMAP -diagramja. K) Az egyes donorokból származó makrofágok százalékos aránya az egyes populációkhoz. L) UMAP grafikonok, amelyek gén expressziót mutatnak a bronchoalveoláris mosó makrofág populációk számára. A párosított t-tesztet kétirányú statisztikai összehasonlításra használták, és az egyirányú ANOVA-t Dunnett többszörös összehasonlítási tesztjével az enyhe és súlyos COVID-19 és az egészséges kontrollok összehasonlítására használták.*, p <0,05; **, p <0,01; ****, p <0,0001; Res, Lakó makrofág klaszter; Inf, Gyulladásos makrofág klaszter; HC, egészséges kontroll; M, enyhe COVID-19; S, súlyos COVID-19. Az osteoarthritis (OA) és a rheumatoid arthritis összehasonlítása, a kutatók azt találták, hogy az RA -szövet gyulladásos jelzésű makrofágokat tartalmaz, beleértve az interferon által indukált gének, valamint a szervezetben gyulladásos vegyi anyagokat kódoló gének felülszabályozását. A legnagyobb expressziós növekedést mutató gén a SLAMF7 volt.
Ezt az OA által gyulladt ízületek ízületi szinoviális szöveteinek alacsony szintjén találták, de magas szinten RA betegeknél. Ez utóbbi makrofágok 55% -ában volt jelen, de az OA -s betegek <6% -a. Kétszer magasabb szinten volt jelen az RA csoport szinoviális folyadék makrofágjaiban, mint az OA csoportban, és minden csoportban a makrofágok körülbelül felénél és negyedénél, illetőleg. Azonban, ez nem volt igaz egy másik SLAM receptorra, rámutatva arra, hogy a SLAMF7 specifikus az RA gyulladásos makrofágjaira.
Úgy találták, hogy az IFN-y a receptor elsődleges induktora a makrofágokon, IFN-β-val együtt, IL-1β és TNF-α alacsonyabb szinteken. Azonban, a gyulladást elősegítő IL-6 citokin nem indukálta a SLAMF7 expressziót. Újra, az előbbi citokinek csökkentették egy másik SLAM receptor szintjét, CD84, a felére.
A kutatók azt is megerősítették, hogy a JAK út fontos szerepet játszott a SLAMF7 által közvetített makrofágok aktiválásában. A JAK gátló ruxolitinib hatékonyan elnyomta. Valójában, ezt a gyógyszert myelofibrosis kezelésére használják, ahol, újra, aktivált SLAMF7-expresszáló makrofágokat találunk. Emellett megduplázza a CD84 szintet, ami azt jelentheti, hogy az IFN-γ ellentétes és kölcsönös hatással bír e két SLAM receptorra.
A következő lépésben, A SLAMF7 expressziót magas szinten indukálták a makrofágokon, IFN-γ. Később, aktiváló monoklonális antitestet vagy rekombináns SLAMF7 fehérjét adtunk a receptorokhoz való kötődéshez. A kutatók azt találták, hogy ez a kötési esemény drámai változásokat váltott ki a génexpresszióban.
Majdnem 600 gént - a Macrophage SLAMF7 Stimulation Signature - felülszabályoztak, valamint számos gyulladásos citokin és kemokin növekedését, még az IFN-γ által okozott emelkedésen túl is. Például, A TNF-α és IL-6 szintje ekkor a pikomolárisról a nanomoláris szintre emelkedik. Ráadásul, maga a SLAMF7 kifejeződése tovább nőtt, pozitív visszacsatolási ciklust sugall.
A makrofágok SLAMF7 -hez való kötődése a mieloid gyulladásos ciklust is mozgásba hozza, amellett, hogy előkészíti a gyulladást, hogy erősen reagáljon a mikrobiális TLR-kötő antigénekre, vagy citokinekkel, az IL-1β tömeges felszabadulásával. Másrészről, ha IFN-γ + LPS (erős baktériummolekula) kombinációját használták a makrofágok aktiválására, a SLAMF7 kötődésre jellemző citokinprofilt nem figyeltük meg. Azonban, részleges hasonlóság volt a citokin válasz és a génexpressziós profil között, amely az IFN-γ első használatakor történt, majd LPS expozíció.
A kutatók azt mondták, „ Ez a SLAMF7 aktiváló program a makrofágok IFN-γ vagy más M1 differenciálódási és aktivációs faktorok általi elsődleges stimulálása után nyugszik, és külön lépés. . ” Ennek az aktiválási programnak a jellemző feltétele-a SLAMF7 elköteleződés (SAM7) által kiváltott szuperaktivált makrofág gyulladásos állapot-a makrofágok IFN-γ általi első fokozódása, ezáltal a SLAMF7 drámaian felül van szabályozva. A kötődési események ezen a receptoron most fejezik be az alapozott makrofágok aktiválását, hogy a makrofágok aktivációjának hiper-gyulladásos állapotát hozzák létre.
Úgy tűnik, hogy ezt az utat fenntartja és tovább erősíti egy autokrin visszacsatolási hurok, TNF-α-val, amelyet gyorsan (két órán belül) indukálnak a SLAMF7 elköteleződése után, majd idővel tovább épülnek fel. Ennek bizonyítékai közé tartozik a TNF-α expresszió felére csökkentése az anti-TNF antitest által, vagy a TNF receptorok siRNS általi elnémításával.
Azt találták, hogy az átlagos SLAMF7 aktivációs pontszám RA -ban majdnem kétszerese az OA -val rendelkezőkénél, jelezve, hogy ez a receptor szorosan részt vesz az RA -ban szenvedők gyulladásában.
Hasonlóképpen, átfedésben lévő makrofág aktivációs génprofilokat hoztak létre gyulladásos bélbetegségben (IBD) és COVID-19-ben is, RA -hoz képest. Valójában, A bronchoalveolaris mosófolyadék sejtek és a gyulladt bélszövetből származó sejtek a COVID-19 és az IBD esetében ugyanazokat a makrofág aktiváló aláírásokat mutatták. Azt is megállapították, hogy a normális bélszövethez képest kettős SLAMF7 aktivációs pontszám van a gyulladt bélben. És súlyos COVID-19 esetén a pontszám az volt hatszor magasabb az enyhe COVID-19-hez képest. Mindez arra utal, hogy a SAM7 program dominanciája a makrofágok aktiválása gyulladásos állapotokban, különösen azért, mert a SLAMF7 receptor nem található a normál szövetben található makrofágokon.
Különféle makrofág alcsoportok feltárása, azt találták, hogy a gyulladásos makrofágok rendkívül magas aktiválási pontszámmal rendelkeznek a rezidens makrofágokhoz képest. Újra, a COVID-19 betegek makrofágjainak három különböző alcsoportja feltűnően arányosan nőtt, E csoportok közül kettő súlyos betegség esetén terjeszkedést mutat. Érdekes módon, ezeknek volt a legmagasabb aktiválási pontszáma, és a súlyosan beteg COVID-19 betegek makrofágjaiban rendkívül magas volt a SLAMF7 expressziós szintje, sok más gyulladásos és interferon-indukálható marker és receptor nagyon magas szintje mellett.
Röviden, a SAM7 állapot a COVID-19 tüdőgyulladásban észlelt hipergyulladásos válasz fő összetevője lehet, valamint RA -ban, és IBD. Azonban, az ilyen aktiválás szekvenciális módja lehetővé teszi több különböző terápiás ellenintézkedés alkalmazását is. Ide tartoznak a JAK -gátlók, például a ruksolitinib, TNF-α inhibitorok, vagy SLAMF7 blokád Elotuzumab. Az utolsó kategória különösen hasznos abban a tekintetben, hogy lehetővé teheti a SAM7 program szelektív gátlását, miközben lehetővé teszi a makrofágok számára, hogy végrehajtsák normális alapvető immunfunkcióikat.
bioRxiv előzetes tudományos jelentéseket tesz közzé, amelyeket nem vizsgálnak felül, és ezért, nem tekinthető döntőnek, irányítja a klinikai gyakorlatot/az egészséggel kapcsolatos viselkedést, vagy megállapított információként kezelik.
 A magas vérnyomás mindig súlyos COVID-19-hez vezet?
A magas vérnyomás mindig súlyos COVID-19-hez vezet?
 Erős mikrobiom a korai életben, kevesebb légúti fertőzéshez kötve
Erős mikrobiom a korai életben, kevesebb légúti fertőzéshez kötve
 A DNS -metakódolás javíthatja az emberi táplálkozás elemzését
A DNS -metakódolás javíthatja az emberi táplálkozás elemzését
 A bél mikrobiota megjósolhatja a COVID-19 súlyosságát
A bél mikrobiota megjósolhatja a COVID-19 súlyosságát
 A krónikus köhögés új gyógyszerrel enyhíthető
A krónikus köhögés új gyógyszerrel enyhíthető
 A növényi étrend meggyógyíthatja a reumás ízületi gyulladást
A növényi étrend meggyógyíthatja a reumás ízületi gyulladást
 A tudósok az A típusú vért univerzális O -típusúvá változtatják,
potenciálisan megduplázza a vérátömlesztési készleteket A British Columbia Egyetem kutatói találtak egy lehetséges módot arra, hogy az A típusú vért univerzális O típusú vérré alakítsák. olyan fejles
A tudósok az A típusú vért univerzális O -típusúvá változtatják,
potenciálisan megduplázza a vérátömlesztési készleteket A British Columbia Egyetem kutatói találtak egy lehetséges módot arra, hogy az A típusú vért univerzális O típusú vérré alakítsák. olyan fejles
 A bél mikrobioma szerepet játszhat a súlyos COVID-19 betegségben
A jelenlegi globális COVID-19 járványt a béta-koronavírus súlyos akut légzőszervi szindróma, a koronavírus-2 (SARS-CoV-2) okozza, amely több mint 22,1 milliót fertőzött meg és 780 ezer halálesetet oko
A bél mikrobioma szerepet játszhat a súlyos COVID-19 betegségben
A jelenlegi globális COVID-19 járványt a béta-koronavírus súlyos akut légzőszervi szindróma, a koronavírus-2 (SARS-CoV-2) okozza, amely több mint 22,1 milliót fertőzött meg és 780 ezer halálesetet oko
 A tudósok teljes emberi genomot vonnak ki több ezer éves „rágógumiból”
Úgy tűnik, hogy a rágógumi nem új trend! A kutatók 5 rágógumit találtak, 700 éves, és nyomokat szolgáltatott az ősi DNS -re vonatkozóan. Az eredményeket tartalmazó tanulmányt a folyóiratban tették köz
A tudósok teljes emberi genomot vonnak ki több ezer éves „rágógumiból”
Úgy tűnik, hogy a rágógumi nem új trend! A kutatók 5 rágógumit találtak, 700 éves, és nyomokat szolgáltatott az ősi DNS -re vonatkozóan. Az eredményeket tartalmazó tanulmányt a folyóiratban tették köz