Nov članek v reviji Življenje predstavlja zgodnji pregled virusnih dejavnikov, ki sodelujejo pri sprožanju in uresničevanju apoptoze v okuženih celicah.
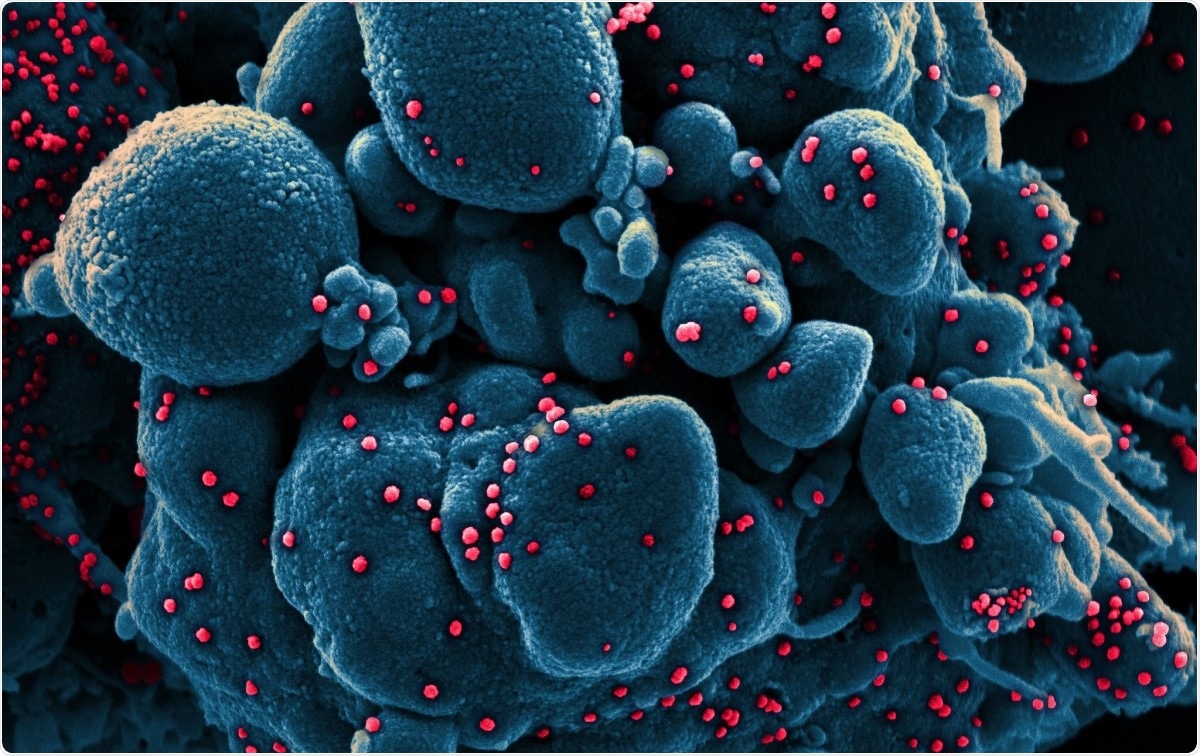 Barvna skenirana elektronska mikrofotografija apoptotične celice (modra), okužena z delci virusa SARS-COV-2 (rdeča), izolirano iz vzorca bolnika. Slika je bila posneta na NIAID Integrated Research Facility (IRF) v Fort Detricku, Maryland. Zasluge za sliko:NIAID / Flickr
Barvna skenirana elektronska mikrofotografija apoptotične celice (modra), okužena z delci virusa SARS-COV-2 (rdeča), izolirano iz vzorca bolnika. Slika je bila posneta na NIAID Integrated Research Facility (IRF) v Fort Detricku, Maryland. Zasluge za sliko:NIAID / Flickr Koronavirusi so med največjimi doslej ugotovljenimi virusi ribonukleinske kisline (RNA). Njihov genom je dolg približno 30 kb, s štirimi strukturnimi beljakovinami, ter več nestrukturnih in pomožnih beljakovin. Razvrščeni so v alfa, beta, koronavirusi gama in delta.
Doslej je bilo izoliranih več živalskih in človeških koronavirusov, ki večinoma povzročajo okužbe dihal ali prebavil. Tako kot drugi virusi, ugrabijo stroje celice gostitelja na vseh stopnjah njihovega razmnoževanja. To vključuje spreminjanje izražanja različnih genov gostitelja, vključno s tistimi, ki kodirajo obrambo gostitelja za olajšanje replikacije virusa.
Pred kratkim je študije so pokazale, da se je zgodnja okužba koronavirusi spreminjajo celični metabolizem in povečujejo hitrost celične smrti. To se zgodi, preden se sproži prilagodljiva imunost, in to bi lahko kazalo na njegovo vlogo pri produktivni virusni okužbi.
Dva najpomembnejša procesa, vključena v to modulacijo, sta apoptoza in sprememba celičnega cikla. Apoptozo sprožijo številne signalne poti. Apoptoza lahko zmanjša širjenje virusa, lahko pa se pojavi tudi nasprotni učinek - sproščanje nalezljivih novonastalih virusnih delcev med litično okužbo.
Celične poti, ki aktivirajo apoptozo, lahko sproži neposredno sama virusna okužba ali posredno prek drugih signalnih kaskad. Slednje izzove prisotnost virusa in pridobivanje imunskih celic na mestu okužbe. Končni dogodek je apoptoza, povzročajo znatno poškodbo tkiv pri litični okužbi.
Virusne komponente v celici se imenujejo molekularni vzorci, povezani s patogeni (PAMP), in jih prepoznajo receptorji za prepoznavanje vzorcev (PRR). Ti se odzovejo z aktiviranjem citokinov in drugih signalnih molekul, ki povečajo ekspresijo genov interferona.
Drugi obrambni mehanizem vključuje prepoznavanje virusne nukleinske kisline s strani gostiteljskih beljakovin, ki se povezujejo, tako kot PRR, z adapterskimi beljakovinami za aktiviranje dveh ključnih transkripcijskih faktorjev, in sicer NFKB in regulatorni faktor 3 IFN (IRF3). Ti se premestijo v jedro in povečajo izražanje interferonov tipa I (IFN).
Ti se vežejo na receptor IFN-α/β (IFNAR), po vrsti, sprožil sistem signalov, ki vključuje Janus kinazo/signalne pretvornike in aktivatorje poti transkripcije (JAK/STAT). Rezultat je regulacija več genov, stimuliranih z IFN (ISG).
Ti geni inaktivirajo proces, ki sodeluje pri sintezi celičnih beljakovin, in tako povzročijo celično smrt. Drug ISG, ki igra v tem procesu zaustavitve prevajanja, je kombinacija 2 ′, 5′-oligoadenilat sintetaza (OAS) in RNaza L.
Apoptozo uravnava več pro- in anti-apoptotičnih proteinov v celici gostitelja. Ena takšnih družin beljakovin je družina Bcl-2 (B-celični limfom-2), vključno z dejavniki, ki povzročajo pora mitohondrijske membrane in morebitno aktivacijo encimov kaspaze, sproži apoptozo. Drugi ščitijo pred apoptozo.
Druga družina so proteinske kinaze, aktivirane z mitogenom (MAPK), ki vključujejo zunajcelično regulirano kinazo 1/2 (ERK1/2), ERK5, p38, in c-Jun N-terminalne kinaze (JNK). Prvega regulirajo rastni faktorji in mitogeni, zadnji dve zaradi stresa celic. Pot JNK lahko privede do aktivacije pro-apoptotičnih genov ali pa za to sodeluje z geni Bcl-2, ali pa lahko aktivira druge transkripcijske faktorje, kot sta 53 in p73.
Opredeljeni sta dve poti apoptoze, zunanji in notranji. Prva je posredovana z aktivacijo smrtnih ligandov (FasL, TNF) o njihovi interakciji z ustreznimi receptorji smrti (DR). Kaspaza-8 je glavni povzročitelj apoptoze pri živalskih koronavirusih, ki delujejo prek DR. Ta encim, ko je aktiviran, cepi ponudbo, beljakovine Bcl2, kar vodi do sproščanja mitohondrijskega citokroma c. Slednje je ključno za nastanek apoptosoma s cepitvijo in aktivacijo kaspaze 9.
Intrinzična pot temelji na permeabilizaciji mitohondrijskih zunanjih membran in jo opazimo predvsem pri živalskih koronavirusih. Proteini Bcl2, kot sta Bax in Bak, podpirajo apoptozo in morajo sprožiti ta proces po notranji ali mitohondrijsko posredovani poti, skupaj s kaspazo-9.
Številni živalski koronavirusi povzročajo aktivacijo zunanjih in notranjih poti, prikazuje zapleteno mrežo signalnih poti, vključenih v apoptozo.
Virusni genomi pogosto kodirajo gene, ki so homologni gostitelju anti-apoptotičnih beljakovin. To jim omogoča, da odložijo apoptozo v zgodnjih fazah okužbe in tako ustvarijo primeren donos novih virionov. Drugi virusni proteini lahko preprečijo transkripcijo nekaterih apoptotičnih genov ali povzročijo spremembo njihovih proteinskih produktov, zatiranje njihove dejavnosti.
Indukcija apoptoze z virusnimi beljakovinami lahko vključuje prenehanje prevleke, odvisne od kapice, v celicah gostitelja, povzroča apoptozo, kot je razvidno iz poliovirusa. V primeru virusa hepatitisa C, virusni protein NS3 sodeluje s kaspazo-8, sprožiti celično smrt.
Trenutni pregled je osredotočen na identifikacijo pro-apoptotičnih mehanizmov, ki jih sprožijo živalski koronavirusi. Na primer, virus epidemije prašičje driske (PEDV) sproži spremembe v izražanju 14 genov, vključenih v apoptozo, neodvisno od kaspaze, da bi spodbudili njeno razmnoževanje, pa tudi proizvaja značilne lastnosti bolezni.
Drug način, na katerega je apoptoza vključena v replikacijo virusa, je aktiviranje kaspaze, ki je potrebna za cepitev proteina virusnega nukleokapsida (N) med tem procesom. To velja za virus prenosljivega gastroenteritisa (TGEV), ki aktivira družino MAPK, pa tudi apoptozo, povzročeno s FasL in mitohondriji. Ta proces vključuje tudi znižanje gostiteljske mikroRNA, ki zavira apoptotično pot mitohondrijev.
Betakoronavirusi, kot je virus hepatitisa pri miših (MHV), povzroča apoptozo. Ta virus kaže apoptozo, ki jo povzroča ovojnica (E), spet prek aktivacije kaspaze. V tem primeru, apoptoza ščiti pred proizvodnjo viriona.
Z virusom prašičjega hemaglutinirajočega encefalomijelitisa (PHEV), celično smrt posredujejo DR in mitohondrijsko posredovane poti, ki vključuje kaspazo-8 in kaspazo-9, kot pobudniki, in kaspaza-3, kot efektor apoptoze.
Podobno, gama- in delta-koronavirusi kažejo kompleksno indukcijo celičnih signalnih poti v gostiteljski celici, kar vodi do modulacije apoptoze. Tako mnogi virusni proteini modulirajo poti gostiteljskih celic za spodbujanje replikacije virusa in značilnosti bolezni.
Dejstvo, da se apoptoza pojavi po okužbi več gostiteljev z vrsto koronavirusov, vodi do zaključka, da je to skupna značilnost okužbe s koronavirusi ljudi in živali in ima namen spodbujati razmnoževanje.
S prejšnjim hudim koronavirusom akutnega respiratornega sindroma (SARS-CoV), protein 7a tvori kompleks z proteinom Bcl-XL ali drugimi faktorji preživetja, inaktiviranje in s tem omogočanje apoptoze z aktivacijo kaspaze-3. 3CL-podobna proteaza (3CLpro) prav tako aktivira kaspazo-3 in kaspazo-9, da inducira apoptozo v celični kulturi.
Tako virusi SARS-CoV kot trenutno krožeči virusi SARS-CoV-2 imajo protein ORF3a, ki sproži celično smrt z aktivacijo kaspaze na zunanji poti skozi DR.
Podobna vloga za virusne beljakovine pri okužbah s koronavirusom živali še ni bila dokazana. Vendar pa s PEDV, podenota S1 proteina spike, in nestrukturni protein 1 (NSP1), naj bi bil pobudnik in efektor celične smrti, oziroma na podlagi nedavnih poskusov.
Več študij lahko pomaga razumeti, kako te poti delujejo pri drugih koronavirusih. Trenutno znanje lahko kaže na koristnost ciljanja na to pot za obvladovanje okužb s koronavirusom.
 Velika študija ugotavlja, da je virusna obremenitev SARS-CoV-2 pri otrocih najnižja
Velika študija ugotavlja, da je virusna obremenitev SARS-CoV-2 pri otrocih najnižja
 Omejeno črevesno vnetje pri COVID-19
Omejeno črevesno vnetje pri COVID-19
 Zakaj bi morali v svojo prehrano vključiti naravne vire vlaknin
Zakaj bi morali v svojo prehrano vključiti naravne vire vlaknin
 Hrana, ki spodbuja črevesje, lahko po vsem svetu odpravi podhranjenost otrok
Hrana, ki spodbuja črevesje, lahko po vsem svetu odpravi podhranjenost otrok
 Ne bojte se kolonoskopije
Ne bojte se kolonoskopije
 Disbioza v črevesni mikrobioti lahko pri bolnikih s COVID-19 povzroči hudo sekundarno okužbo
Disbioza v črevesni mikrobioti lahko pri bolnikih s COVID-19 povzroči hudo sekundarno okužbo
 Mikrobiom semenčic, odkrit s sekvenciranjem RNA
Nova študija poroča o prvem podrobnem opisu mikrobioma človeške sperme, z uporabo novejših tehnik sekvenciranja RNA, ki lahko razlikujejo med RNA sperme in bakterijsko kontaminacijo ali kolonizacijo.
Mikrobiom semenčic, odkrit s sekvenciranjem RNA
Nova študija poroča o prvem podrobnem opisu mikrobioma človeške sperme, z uporabo novejših tehnik sekvenciranja RNA, ki lahko razlikujejo med RNA sperme in bakterijsko kontaminacijo ali kolonizacijo.
 Ustna higiena in resnost COVID-19-povezava
Britanski raziskovalci so ugotovili povezavo med slabo ustno higieno in resnostjo bolezni COVID-19, ki jo povzroča huda okužba s koronavirusom 2 (SARS-CoV-2). Študija raziskovalke Victoria Sampson, iz
Ustna higiena in resnost COVID-19-povezava
Britanski raziskovalci so ugotovili povezavo med slabo ustno higieno in resnostjo bolezni COVID-19, ki jo povzroča huda okužba s koronavirusom 2 (SARS-CoV-2). Študija raziskovalke Victoria Sampson, iz
 Omejitve COVID-19 so povzročile 86-odstotni padec okužb z norovirusi v ZDA,
najde študijo Začetek pandemije COVID-19 je privedel do uvedbe več nefarmacevtskih posegov (NPI) po vsem svetu. Medtem ko so državljani v ZDA prepirali nasvete o nošenju mask v javnosti, omejene družb
Omejitve COVID-19 so povzročile 86-odstotni padec okužb z norovirusi v ZDA,
najde študijo Začetek pandemije COVID-19 je privedel do uvedbe več nefarmacevtskih posegov (NPI) po vsem svetu. Medtem ko so državljani v ZDA prepirali nasvete o nošenju mask v javnosti, omejene družb