Új lap a folyóiratban Élet korai áttekintést nyújt azokról a vírusfaktorokról, amelyek részt vesznek az apoptózis elindításában és végrehajtásában a fertőzött sejteken belül.
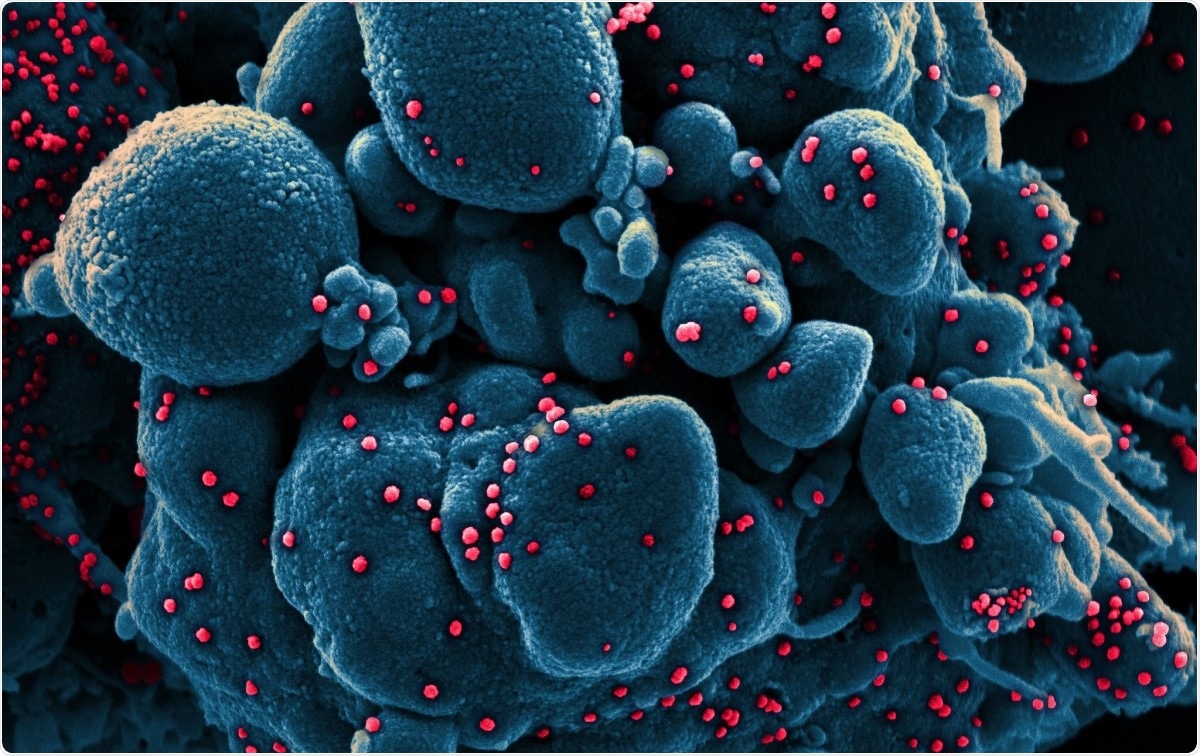 Színes, pásztázó elektronmikroszkópos felvétel SARP-COV-2 vírusrészecskékkel (piros) fertőzött apoptotikus sejtről (kék), betegmintából izolálva. A kép a Fort Detrick -i NIAID integrált kutatóintézetben (IRF) készült, Maryland. Kép jóváírása:NIAID / Flickr
Színes, pásztázó elektronmikroszkópos felvétel SARP-COV-2 vírusrészecskékkel (piros) fertőzött apoptotikus sejtről (kék), betegmintából izolálva. A kép a Fort Detrick -i NIAID integrált kutatóintézetben (IRF) készült, Maryland. Kép jóváírása:NIAID / Flickr A koronavírusok az eddig azonosított legnagyobb ribonukleinsav (RNS) vírusok közé tartoznak. Genomjuk körülbelül 30 kb hosszú, négy szerkezeti fehérjével, és számos nem strukturális és kiegészítő fehérje. Alfa -ba vannak besorolva, béta, gamma és delta koronavírusok.
Számos állati és emberi koronavírust izoláltak eddig, és többnyire légúti vagy gyomor -bélrendszeri fertőzést okoznak. Más vírusokhoz hasonlóan replikációjuk minden szakaszában eltérítik a gazdasejt gépezetét. Ez magában foglalja a különböző gazdagének expressziójának módosítását, beleértve azokat is, amelyek kódolják a gazda védelmét a vírusreplikáció megkönnyítése érdekében.
Nemrég, vizsgálatok kimutatták, hogy a fertőzés korai szakaszában, A koronavírusok megváltoztatják a sejtek anyagcseréjét és növelik a sejtpusztulás mértékét. Ez az adaptív immunitás kiváltása előtt következik be, és ez jelezheti szerepét a produktív vírusfertőzésben.
A moduláció két legfontosabb folyamata az apoptózis és a sejtciklus módosítása. Az apoptózist számos jelátviteli út váltja ki. Az apoptózis csökkentheti a vírusok terjedését, de ennek ellenkező hatása is előfordulhat - a fertőző újonnan keletkezett vírusrészecskék felszabadulása a lítikus fertőzés során.
Az apoptózist aktiváló sejtpályákat közvetlenül a vírusfertőzés, vagy közvetett más jelátviteli kaszkádok válthatják ki. Ez utóbbit a vírus jelenléte indítja el, és immunsejteket toboroz a fertőzés helyére. A végső esemény az apoptózis, jelentős károkat okozva a szövetekben a lítikus fertőzés során.
A sejten belüli víruskomponenseket kórokozó-asszociált molekuláris mintáknak (PAMP) nevezik, és mintázatfelismerő receptorok (PRR) ismerik fel. Ezek a citokinek és más jelzőmolekulák aktiválásával reagálnak, amelyek fokozzák az interferon gén expresszióját.
Egy másik védekezési mechanizmus magában foglalja a virális nukleinsavak felismerését az asszociáló gazdaproteinek által, mint a PRR -ek, adapterfehérjékkel két kulcsfontosságú transzkripciós faktor aktiválásához, ugyanis, NFĸB és IFN szabályozási 3. faktor (IRF3). Ezek a sejtmagba transzlokálódnak, és növelik az I. típusú interferonok (IFN) expresszióját.
Ezek kötődnek az IFN-α/β receptorokhoz (IFNAR), viszont, indítsa el a Janus kináz/jelátalakítókat és a transzkripció aktivátorait (JAK/STAT) tartalmazó jelrendszert. Az eredmény több IFN-stimulált gén (ISG) felülszabályozása.
Ezek a gének inaktiválják a sejtfehérjék szintézisében részt vevő folyamatot, és ezáltal sejthalált okoznak. Egy másik ISG, amely a fordítás leállításának folyamatában játszik szerepet, a 2 ′ kombinációja, 5′-oligoadenilát szintetáz (OAS) és RNáz L.
Az apoptózist számos pro- és anti-apoptotikus fehérje szabályozza a gazdasejtben. Az egyik ilyen fehérjecsalád a Bcl-2 (B-sejtes limfóma-2) család, beleértve azokat a tényezőket, amelyek a mitokondriális membrán poratúráját és a kaszpáz enzimek esetleges aktiválódását okozzák, apoptózist kezdeményez. Mások az apoptózis ellen védenek.
Egy másik család a mitogén-aktivált protein-kinázok (MAPK), amelyek tartalmaznak extracelluláris szabályozott kinázt 1/2 (ERK1/2), ERK5, 38. oldal, és c-Jun N-terminális kinázok (JNK). Az elsőt a növekedési faktorok és a mitogének szabályozzák, az utolsó kettőt sejt stressz. A JNK útvonal pro-apoptotikus gének aktiválásához vezethet, vagy kölcsönhatásba léphet a Bcl-2 génekkel, vagy más transzkripciós faktorokat is aktiválhat, például az 53 -at és a p73 -at.
Az apoptózisnak két útját azonosították, a külső és a belső. Az előbbit a halál -ligandumok (FasL, TNF) a saját halálreceptorokkal (DR) való kölcsönhatásukról. A kaszpáz-8 a DR-eken keresztül ható állati koronavírusok apoptózisának fő induktora. Ezt az enzimet, aktiváláskor, lehasítja Bidet, Bcl2 fehérje, mitokondriális citokróm c felszabadulásához vezet. Ez utóbbi kulcsfontosságú az apoptoszóma kialakulásához a kaszpáz 9 hasításával és aktiválásával.
A belső út a mitokondriális külső membránok permeabilizációján alapul, és főként állati koronavírusoknál figyelhető meg. A Bcl2 fehérjék, mint például a Bax és a Bak, elősegítik az apoptózist, és szükségesek ahhoz, hogy ezt a folyamatot a belső vagy mitokondriális mediált úton indítsák el, a kaszpáz-9-el együtt.
Sok állati koronavírus mind a külső, mind a belső utak aktiválódását okozza, bemutatja az apoptózisban részt vevő jelzőutak bonyolult hálózatát.
A vírusgenomok gyakran olyan géneket kódolnak, amelyek homológok az anti-apoptotikus fehérjék befogadójával. Ez lehetővé teszi számukra, hogy késleltessék az apoptózist a fertőzés korai szakaszában, és így megfelelő termést hozzanak létre az új virionokból. Más vírusfehérjék megakadályozhatják egyes apoptotikus gének átírását, vagy módosíthatják fehérjetermékeiket, hogy elnyomják tevékenységüket.
Az apoptózis vírusfehérjék általi kiváltása magában foglalhatja a kupakfüggő transzláció befejezését a gazdasejtekben, apoptózist vált ki, mint a poliovírus esetében. A hepatitis C vírus esetén, a vírus NS3 fehérje kölcsönhatásba lép a kaszpáz-8-al, sejtpusztulást kiváltani.
A jelenlegi felülvizsgálat az állati koronavírusok által kiváltott pro-apoptotikus mechanizmusok azonosítására összpontosít. Például, a sertés járványos hasmenés vírus (PEDV) megváltoztatja a kaszpázfüggetlen apoptózisban részt vevő 14 gén expresszióját a replikáció elősegítése érdekében, valamint előidézi a betegség jellegzetes vonásait.
Az apoptózis másik módja a vírus replikációjában a kaszpáz aktiválása, amely a vírus nukleokapszid (N) fehérje hasításához szükséges e folyamat során. Ez a helyzet a fertőző gasztroenteritis vírus (TGEV) esetében, amely aktiválja a MAPK családot, valamint a FasL- és mitokondriumok által kiváltott apoptózis. Ez a folyamat magában foglalja a mitokondriális apoptotikus útvonalat elnyomó gazda mikroRNS -ek alulszabályozását is.
Betacoronavírusok, mint például az egér hepatitis vírus (MHV), apoptózist vált ki. Ez a vírus burokfehérje (E) által indukált apoptózist mutat, ismét kaszpáz aktiválással. Ebben az esetben, Az apoptózis védőnek tűnik a virionok termelődése ellen.
Sertés hemagglutináló encephalomyelitis vírussal (PHEV), a sejthalált a DR-ek és a mitokondriális mediált útvonalak közvetítik, kaszpáz-8 és kaszpáz-9, kezdeményezőként, és kaszpáz-3, az apoptózis hatásaként.
Hasonlóképpen, a gamma- és delta-koronavírusok komplex indukcióját mutatják a sejt jelátviteli útvonalainak a gazdasejtben, ami az apoptózis modulációjához vezet. És így, sok vírusfehérje modulálja a gazdasejt útvonalait, hogy elősegítse a vírus replikációját és a betegség jellemzőit.
Az a tény, hogy az apoptózis több gazdaszervezet koronavírus -fertőzése után következik be, arra a következtetésre vezet, hogy ez az emberi és állati koronavírusok által okozott fertőzés közös jellemzője, és célja a szaporodás elősegítése.
A korábbi súlyos akut légúti szindróma koronavírus (SARS-CoV) miatt a 7a fehérje komplexet képez a Bcl-XL fehérjével vagy más túlélést elősegítő faktorokkal, inaktiválja őket, és ezáltal lehetővé teszi, hogy az apoptózis a kaszpáz-3 aktiváción keresztül haladjon. A 3CL-szerű proteáz (3CLpro) a kaszpáz-3-at és a kaszpáz-9-et is aktiválja, hogy apoptózist indukáljon a sejttenyészetben.
Mind a SARS-CoV, mind a jelenleg keringő SARS-CoV-2 vírusok tartalmazzák az ORF3a fehérjét, amely kaszpázaktiváció révén sejthalált vált ki a DR-eken keresztül.
Hasonló szerepet még nem mutattak ki a vírusfehérjék esetében az állati koronavírus -fertőzésekben. Azonban, PEDV -vel, a tüskefehérje S1 alegysége, és a nem strukturális fehérje 1 (NSP1), a sejthalál kezdeményezője és végrehajtója, illetőleg, legújabb kísérletek alapján.
További tanulmányok segíthetnek megérteni, hogyan működnek ezek az utak más koronavírusokban. A jelenlegi ismeretek azt jelzik, hogy hasznos lehet ezt az utat megcélozni a koronavírus -fertőzések kezelésében.
 A tisztítószerek növelhetik a gyermekkori asztma leletek kockázatát
A tisztítószerek növelhetik a gyermekkori asztma leletek kockázatát
 Az RNS szekvenálás új betekintést nyújt a mikrobiómába
Az RNS szekvenálás új betekintést nyújt a mikrobiómába
 A bél mikrobioma megváltozik a növényi ételek főzésével,
A bél mikrobioma megváltozik a növényi ételek főzésével,
 A kávé elősegíti a bél egészséges mikrobáinak fejlődését és segíti a bélmozgást
A kávé elősegíti a bél egészséges mikrobáinak fejlődését és segíti a bélmozgást
 Amit eszik, megváltoztathatja az antibiotikumok bélrendszeri hatását
Amit eszik, megváltoztathatja az antibiotikumok bélrendszeri hatását
 Az OTC antacidok savsemlegesítő képességének meghatározása
Az OTC antacidok savsemlegesítő képességének meghatározása
 Az ételreakciókat a bél mikrobioma szabályozza,
új tanulmányra lel A héten közzétett tanulmányból kiderül, hogy a bélben lévő baktériumok (a bél mikrobiomja) és az általunk elfogyasztott élelmiszerek kölcsönhatása jelentősen eltér az egyének között
Az ételreakciókat a bél mikrobioma szabályozza,
új tanulmányra lel A héten közzétett tanulmányból kiderül, hogy a bélben lévő baktériumok (a bél mikrobiomja) és az általunk elfogyasztott élelmiszerek kölcsönhatása jelentősen eltér az egyének között
 Kecsketejes tápszer a csecsemők bélrendszerének egészségére
Az RMIT laboratóriumának kutatói elemezték a kecsketej formulát, és megvizsgálták a benne lévő oligoszacharidokat. Úgy találták, hogy ezek az egyszerű cukrok és a kecsketej alapú csecsemőtápszerekben
Kecsketejes tápszer a csecsemők bélrendszerének egészségére
Az RMIT laboratóriumának kutatói elemezték a kecsketej formulát, és megvizsgálták a benne lévő oligoszacharidokat. Úgy találták, hogy ezek az egyszerű cukrok és a kecsketej alapú csecsemőtápszerekben
 Az anya-baba SARS-CoV-2 átvitel terhesség alatt lehetséges, de ritka,
mondja tanulmány A 2019-es koronavírus-járvány (COVID-19), amelyet a súlyos akut légzőszervi szindróma, a koronavírus 2 (SARS-CoV-2) okoz, sem férfit, sem nőt nem kímél. Több kutató arról számolt be,
Az anya-baba SARS-CoV-2 átvitel terhesség alatt lehetséges, de ritka,
mondja tanulmány A 2019-es koronavírus-járvány (COVID-19), amelyet a súlyos akut légzőszervi szindróma, a koronavírus 2 (SARS-CoV-2) okoz, sem férfit, sem nőt nem kímél. Több kutató arról számolt be,