Een nieuw artikel in het tijdschrift Leven presenteert een vroeg overzicht van de virale factoren die betrokken zijn bij het initiëren en bewerkstelligen van apoptose in geïnfecteerde cellen.
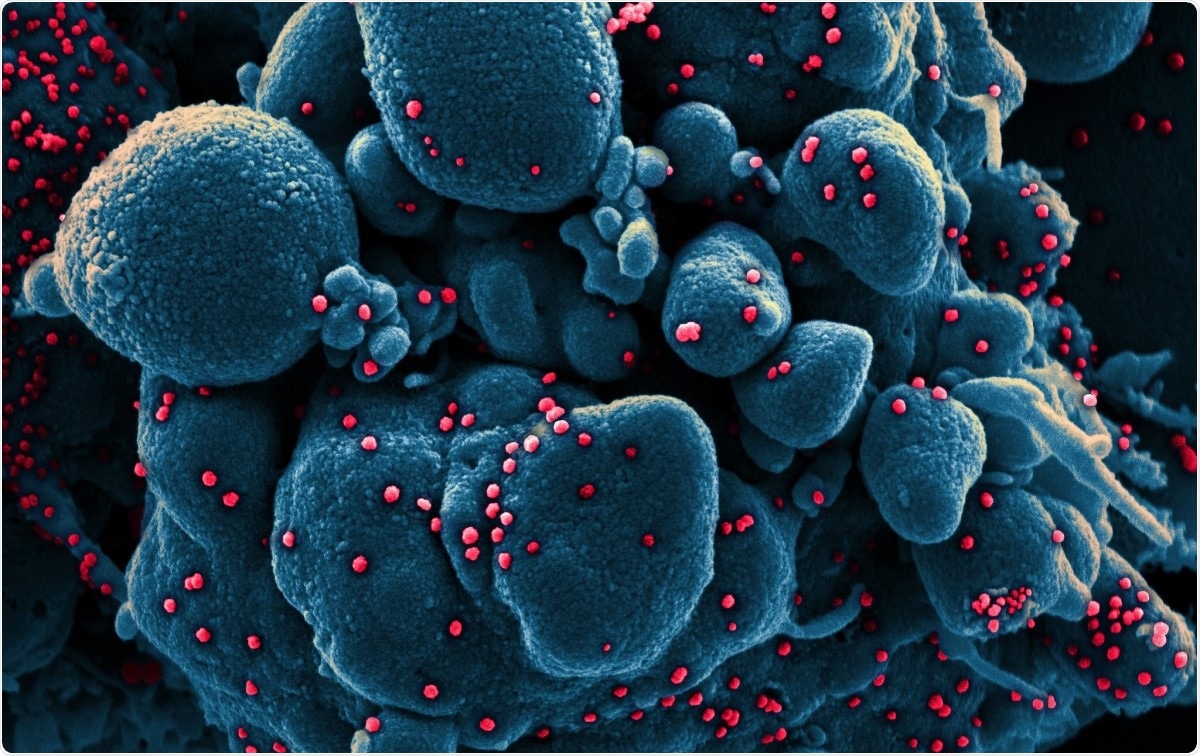 Ingekleurde scanning-elektronenmicrofoto van een apoptotische cel (blauw) geïnfecteerd met SARS-COV-2-virusdeeltjes (rood), geïsoleerd uit een patiëntenmonster. Afbeelding gemaakt bij de NIAID Integrated Research Facility (IRF) in Fort Detrick, Maryland. Afbeelding tegoed:NIAID / Flickr
Ingekleurde scanning-elektronenmicrofoto van een apoptotische cel (blauw) geïnfecteerd met SARS-COV-2-virusdeeltjes (rood), geïsoleerd uit een patiëntenmonster. Afbeelding gemaakt bij de NIAID Integrated Research Facility (IRF) in Fort Detrick, Maryland. Afbeelding tegoed:NIAID / Flickr Coronavirussen behoren tot de grootste ribonucleïnezuur (RNA)-virussen die tot nu toe zijn geïdentificeerd. Hun genoom is ongeveer 30 kb lang, met vier structurele eiwitten, en verschillende niet-structurele en accessoire eiwitten. Ze zijn ingedeeld in alfa, bèta, gamma- en delta-coronavirussen.
Tot dusver zijn verschillende dierlijke en menselijke coronavirussen geïsoleerd en veroorzaken meestal luchtweg- of gastro-intestinale infecties. Net als andere virussen, ze kapen de machinerie van de gastheercel in alle stadia van hun replicatie. Dit omvat het wijzigen van de expressie van verschillende gastheergenen, inclusief die welke coderen voor de verdediging van de gastheer om virale replicatie te vergemakkelijken.
Onlangs, studies hebben aangetoond dat in een vroeg stadium van infectie, coronavirussen veranderen het cellulaire metabolisme en verhogen de snelheid van celdood. Dit gebeurt voordat adaptieve immuniteit wordt geactiveerd, en dit zou kunnen wijzen op zijn rol bij productieve virale infectie.
Twee van de belangrijkste processen die bij deze modulatie betrokken zijn, zijn apoptose en modificatie van de celcyclus. Apoptose wordt veroorzaakt door een aantal signaalroutes. Apoptose kan de virale verspreiding verminderen, maar het tegenovergestelde effect kan ook optreden - het vrijkomen van de besmettelijke nieuw geproduceerde virale deeltjes tijdens lytische infectie.
De celroutes die apoptose activeren, kunnen direct worden geactiveerd door de virale infectie zelf of indirect via andere signaalcascades. Dit laatste wordt veroorzaakt door de aanwezigheid van het virus en rekruteert immuuncellen naar de plaats van infectie. De eindgebeurtenis is apoptose, veroorzaakt aanzienlijke schade aan de weefsels bij lytische infectie.
De virale componenten in de cel worden pathogeen-geassocieerde moleculaire patronen (PAMP's) genoemd en worden herkend door patroonherkenningsreceptoren (PRR's). Deze reageren door cytokinen en andere signaalmoleculen te activeren die de interferon-genexpressie opreguleren.
Een ander afweermechanisme omvat de herkenning van viraal nucleïnezuur door gastheereiwitten die associëren, zoals de PRR's, met adapter-eiwitten om twee belangrijke transcriptiefactoren te activeren, namelijk, NFĸB en IFN regulerende factor 3 (IRF3). Deze worden verplaatst naar de kern en verhogen de expressie van type I interferonen (IFN's).
Deze binden aan de IFN-α/β-receptor (IFNAR), beurtelings, een systeem van signalen in gang zetten waarbij de Janus-kinase/signaaltransducers en activatoren van transcriptie (JAK/STAT)-route betrokken zijn. Het resultaat is de opregulatie van meerdere IFN-gestimuleerde genen (ISG's).
Deze genen inactiveren het proces dat betrokken is bij de synthese van celeiwitten en induceren zo celdood. Een andere ISG die een speler is in dit proces van het afsluiten van vertaling is de combinatie van 2′, 5′-oligoadenylaatsynthetase (OAS) en RNase L.
Apoptose wordt gereguleerd door verschillende pro- en anti-apoptotische eiwitten in de gastheercel. Een dergelijke familie van eiwitten is de Bcl-2 (B-cellymfoom-2) familie, inclusief factoren die poratie van het mitochondriale membraan en uiteindelijke activering van caspase-enzymen veroorzaken, apoptose initiëren. Anderen beschermen tegen apoptose.
Een andere familie zijn de door mitogeen geactiveerde proteïnekinasen (MAPK's), waaronder extracellulair gereguleerd kinase 1/2 (ERK1/2), ERK5, p38, en c-Jun N-terminale kinasen (JNK). De eerste wordt opgereguleerd door groeifactoren en mitogenen, de laatste twee door celstress. De JNK-route kan leiden tot activering van pro-apoptotische genen of kan een interactie aangaan met Bcl-2-genen om dit te doen, of kan andere transcriptiefactoren zoals 53 en p73 activeren.
Er zijn twee routes van apoptose geïdentificeerd, het extrinsieke en het intrinsieke. De eerste wordt gemedieerd door de activering van doodliganden (FasL, TNF) op hun interactie met hun respectieve doodsreceptoren (DR's). Caspase-8 is een belangrijke inductor van apoptose bij dierlijke coronavirussen die werken via DR's. Dit enzym, wanneer geactiveerd, splitst bod, een Bcl2-eiwit, wat leidt tot het vrijkomen van mitochondriaal cytochroom c. Dit laatste is de sleutel tot de vorming van het apoptosoom met de splitsing en activering van caspase 9.
De intrinsieke route is gebaseerd op de permeabilisatie van mitochondriale buitenmembranen en wordt voornamelijk gezien bij dierlijke coronavirussen. Bcl2-eiwitten zoals Bax en Bak bevorderen apoptose en zijn nodig om dit proces te activeren via de intrinsieke of mitochondriaal gemedieerde route, samen met caspase-9.
Veel dierlijke coronavirussen veroorzaken activering van zowel extrinsieke als intrinsieke routes, toont het ingewikkelde netwerk van signaalroutes die betrokken zijn bij apoptose.
Virale genomen coderen vaak voor genen die homoloog zijn om anti-apoptotische eiwitten te hosten. Hierdoor kunnen ze apoptose in de vroege stadia van infectie vertragen en zo een adequate opbrengst aan nieuwe virionen genereren. Andere virale eiwitten kunnen de transcriptie van sommige apoptotische genen voorkomen of de wijziging van hun eiwitproducten veroorzaken, om hun activiteit te onderdrukken.
De inductie van apoptose door virale eiwitten kan de beëindiging van cap-afhankelijke translatie in gastheercellen inhouden, apoptose induceren, zoals gezien met het poliovirus. In het geval van het hepatitis C-virus, het virale NS3-eiwit interageert met caspase-8, celdood op gang te brengen.
De huidige beoordeling is gericht op het identificeren van pro-apoptotische mechanismen die worden veroorzaakt door dierlijke coronavirussen. Bijvoorbeeld, het Porcine Epidemic Diarree Virus (PEDV) veroorzaakt veranderingen in de expressie van 14 genen die betrokken zijn bij caspase-onafhankelijke apoptose om de replicatie ervan te bevorderen, evenals het produceren van de karakteristieke kenmerken van de ziekte.
Een andere manier waarop apoptose betrokken is bij virale replicatie is door caspase te activeren, die nodig is voor de splitsing van het virale nucleocapside (N) eiwit tijdens dit proces. Dit is het geval bij het overdraagbare gastro-enteritisvirus (TGEV), die de MAPK-familie activeert, evenals FasL- en mitochondria-geïnduceerde apoptose. Dit proces omvat ook de neerwaartse regulatie van gastheer-microRNA's die de mitochondriale apoptotische route onderdrukken.
Betacoronavirussen, zoals het muizenhepatitisvirus (MHV), apoptose induceert. Dit virus vertoont door envelopeiwit (E) geïnduceerde apoptose, opnieuw via caspase-activering. In dit geval, apoptose lijkt beschermend te zijn tegen de productie van virionen.
Met het varkens hemagglutinerende encefalomyelitisvirus (PHEV), celdood wordt gemedieerd door DR's en de mitochondriaal-gemedieerde routes, waarbij caspase-8 en caspase-9 betrokken zijn, als initiatiefnemers, en caspase-3, als effector van apoptose.
evenzo, de gamma- en delta-coronavirussen vertonen complexe inductie van cellulaire signaalroutes in de gastheercel, wat leidt tot de modulatie van apoptose. Dus, veel virale eiwitten moduleren gastheercelroutes om virale replicatie en ziektekenmerken te bevorderen.
Het feit dat apoptose optreedt na infectie van meerdere gastheren door een reeks coronavirussen, leidt tot de conclusie dat het een algemeen kenmerk is van infectie door menselijke en dierlijke coronavirussen en bedoeld is om verspreiding te bevorderen.
Met het eerdere ernstige acute respiratoire syndroom coronavirus (SARS-CoV), het 7a-eiwit vormt een complex met Bcl-XL-eiwit of andere pro-overlevingsfactoren, ze inactiveren en zo apoptose laten verlopen via caspase-3-activering. Het 3CL-achtige protease (3CLpro) activeert ook zowel caspase-3 als caspase-9 om apoptose in celkweek te induceren.
Zowel SARS-CoV als de momenteel circulerende SARS-CoV-2-virussen hebben het ORF3a-eiwit dat celdood veroorzaakt via caspase-activering in de extrinsieke route via DR's.
Een vergelijkbare rol is nog niet aangetoond voor virale eiwitten bij coronavirusinfecties bij dieren. Echter, met PEDV, de S1-subeenheid van het spike-eiwit, en het niet-structurele eiwit 1 (NSP1), is gesuggereerd dat het de initiator en effector van celdood is, respectievelijk, gebaseerd op recente experimenten.
Meer studies kunnen helpen begrijpen hoe deze routes werken bij andere coronavirussen. De huidige stand van kennis kan wijzen op het nut van het richten op deze route voor het beheersen van coronavirusinfecties.
 De ziekte van Parkinson kan worden voorkomen door darmmicroben
De ziekte van Parkinson kan worden voorkomen door darmmicroben
 Anti-coronavirusmoleculen van microben kunnen de sleutel zijn tot nieuwe behandelingen
Anti-coronavirusmoleculen van microben kunnen de sleutel zijn tot nieuwe behandelingen
 Het is veilig om rauw voedsel aan huisdieren te geven,
Het is veilig om rauw voedsel aan huisdieren te geven,
 Lichaamstrillingen helpen ontstekingen te verminderen,
Lichaamstrillingen helpen ontstekingen te verminderen,
 Goed nieuws voor IBS-patiënten, aangezien onderzoekers "darm jeuk" identificeren
Goed nieuws voor IBS-patiënten, aangezien onderzoekers "darm jeuk" identificeren
 Metformine kan een lekkende darm helpen
Metformine kan een lekkende darm helpen
 Markering van potentiële moleculaire voorspellers van respons op biologische therapieën bij colitis ulcerosa
Verschillende personen die lijden aan darmaandoeningen zoals colitis ulcerosa reageren niet op conventioneel gebruikte biologische therapieën. In dergelijke gevallen, gepersonaliseerde voorspelling va
Markering van potentiële moleculaire voorspellers van respons op biologische therapieën bij colitis ulcerosa
Verschillende personen die lijden aan darmaandoeningen zoals colitis ulcerosa reageren niet op conventioneel gebruikte biologische therapieën. In dergelijke gevallen, gepersonaliseerde voorspelling va
 Toenemende risico's voor biologische verdediging van synthetische biologie
Een onderzoek in opdracht van het Amerikaanse ministerie van Defensie heeft uitgewezen dat er verschillende genetische manipulatietools zijn die kunnen worden gebruikt om in korte tijd biologische wap
Toenemende risico's voor biologische verdediging van synthetische biologie
Een onderzoek in opdracht van het Amerikaanse ministerie van Defensie heeft uitgewezen dat er verschillende genetische manipulatietools zijn die kunnen worden gebruikt om in korte tijd biologische wap
 Dysbiose in de darmflora kan ernstige secundaire infectie veroorzaken bij COVID-19-patiënten
Een interessante studie onder leiding van wetenschappers in de VS heeft onlangs onthuld dat de microbiële gemeenschap in de darm direct wordt beïnvloed door het ernstige acute respiratoire syndroom co
Dysbiose in de darmflora kan ernstige secundaire infectie veroorzaken bij COVID-19-patiënten
Een interessante studie onder leiding van wetenschappers in de VS heeft onlangs onthuld dat de microbiële gemeenschap in de darm direct wordt beïnvloed door het ernstige acute respiratoire syndroom co