Nový článok v denníku Život predstavuje skorý prehľad vírusových faktorov zapojených do iniciácie a ovplyvnenia apoptózy v infikovaných bunkách.
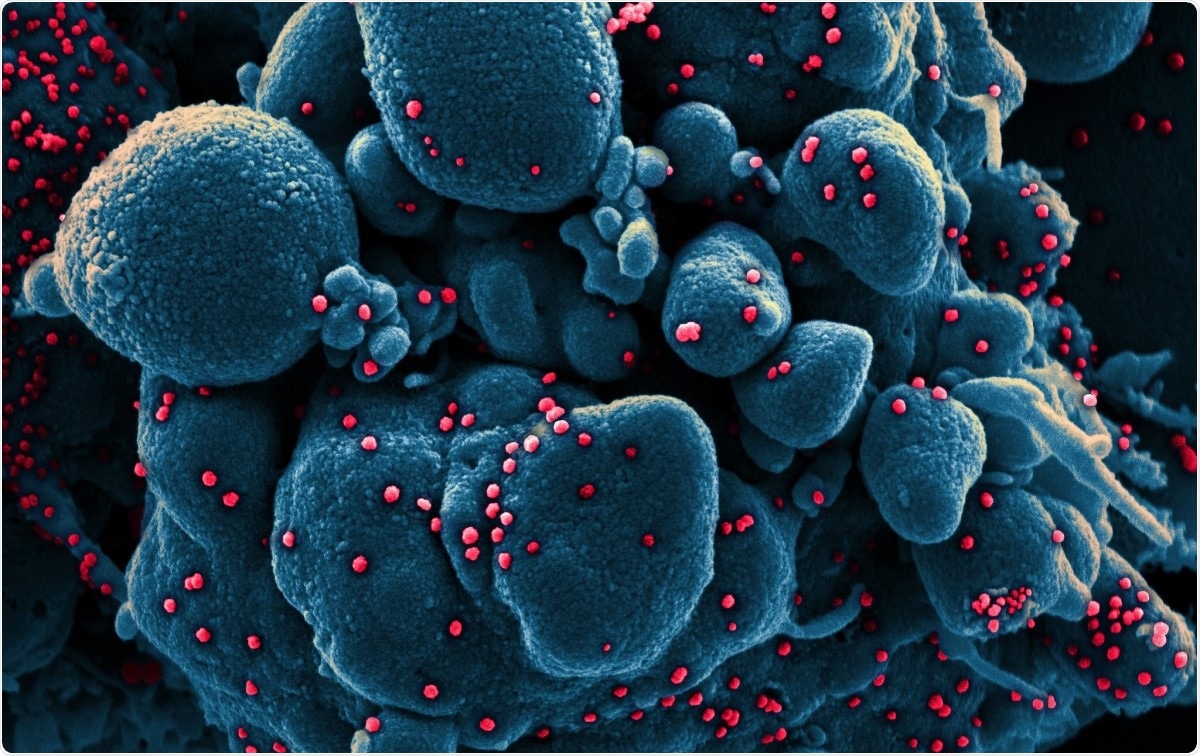 Kolorovaný skenovací elektrónový mikrograf apoptotickej bunky (modrý) infikovanej časticami vírusu SARS-COV-2 (červená), izolované zo vzorky pacienta. Snímka zachytená v Integrovanom výskumnom zariadení NIAID (IRF) vo Fort Detrick, Maryland. Obrazový kredit:NIAID / Flickr
Kolorovaný skenovací elektrónový mikrograf apoptotickej bunky (modrý) infikovanej časticami vírusu SARS-COV-2 (červená), izolované zo vzorky pacienta. Snímka zachytená v Integrovanom výskumnom zariadení NIAID (IRF) vo Fort Detrick, Maryland. Obrazový kredit:NIAID / Flickr Koronavírusy patria k doposiaľ najväčším vírusom ribonukleovej kyseliny (RNA). Ich genóm je dlhý asi 30 kb, so štyrmi štruktúrnymi proteínmi, a niekoľko neštrukturálnych a pomocných proteínov. Delia sa na alfa, beta, gama a delta koronavírusy.
Doteraz bolo izolovaných niekoľko zvieracích a ľudských koronavírusov, ktoré väčšinou spôsobujú respiračné alebo gastrointestinálne infekcie. Rovnako ako ostatné vírusy, unesú stroje hostiteľskej bunky vo všetkých fázach ich replikácie. To zahŕňa úpravu expresie rôznych hostiteľských génov, vrátane tých, ktoré kódujú obranu hostiteľa na uľahčenie replikácie vírusu.
Nedávno štúdie ukázali, že na začiatku infekcie, koronavírusy menia bunkový metabolizmus a zvyšujú rýchlosť bunkovej smrti. K tomu dochádza pred spustením adaptívnej imunity, a to by mohlo naznačovať jeho úlohu v produktívnej vírusovej infekcii.
Dva z najdôležitejších procesov zahrnutých v tejto modulácii sú apoptóza a modifikácia bunkového cyklu. Apoptózu spúšťa množstvo signálnych dráh. Apoptóza môže obmedziť šírenie vírusov, ale môže nastať aj opačný efekt - uvoľnenie infekčných novo produkovaných vírusových častíc počas lytickej infekcie.
Bunkové dráhy, ktoré aktivujú apoptózu, môžu byť spustené priamo samotnou vírusovou infekciou alebo nepriamo prostredníctvom iných signálnych kaskád. Ten je spustený prítomnosťou vírusu a verbuje imunitné bunky do miesta infekcie. Konečnou udalosťou je apoptóza, spôsobujúce značné poškodenie tkanív pri lytickej infekcii.
Vírusové zložky v bunke sa nazývajú molekulárne vzorce spojené s patogénom (PAMP) a sú rozpoznávané receptormi na rozpoznávanie vzorov (PRR). Tieto reagujú aktiváciou cytokínov a ďalších signálnych molekúl, ktoré regulujú expresiu interferónového génu.
Ďalší obranný mechanizmus zahŕňa rozpoznanie vírusovej nukleovej kyseliny hostiteľskými proteínmi, ktoré sa spájajú s ako PRR, s proteínmi adaptéra na aktiváciu dvoch kľúčových transkripčných faktorov, totiž Regulačný faktor 3 NFĸB a IFN (IRF3). Tieto sú translokované do jadra a zvyšujú expresiu interferónov typu I (IFN).
Tieto sa viažu na receptor IFN-α/β (IFNAR), zasa spustil systém signálov zahŕňajúcich Janusovu kinázu/prevodníky signálu a aktivátory transkripčnej dráhy (JAK/STAT). Výsledkom je zvýšená regulácia viacerých génov stimulovaných IFN (ISG).
Tieto gény deaktivujú proces zapojený do syntézy bunkových bielkovín a tým indukujú bunkovú smrť. Ďalším ISG, ktorý je hráčom v tomto procese ukončenia prekladu, je kombinácia 2 ′, 5'-oligoadenylát syntetáza (OAS) a RNáza L.
Apoptóza je v hostiteľskej bunke regulovaná niekoľkými pro- a anti-apoptotickými proteínmi. Jednou takouto rodinou proteínov je rodina Bcl-2 (B bunkový lymfóm-2), vrátane faktorov, ktoré spôsobujú poráciu mitochondriálnej membrány a prípadnú aktiváciu kaspázových enzýmov, spustenie apoptózy. Iní chránia pred apoptózou.
Ďalšou rodinou sú mitogénom aktivované proteínkinázy (MAPK), ktoré zahŕňajú extracelulárne regulovanú kinázu 1/2 (ERK1/2), ERK5, p38, a c-jún N-koncové kinázy (JNK). Prvý je regulovaný rastovými faktormi a mitogénmi, posledné dve bunkovým stresom. Dráha JNK môže viesť k aktivácii pro-apoptotických génov alebo môže interagovať s génmi Bcl-2, alebo môže aktivovať ďalšie transkripčné faktory, ako sú 53 a p73.
Boli identifikované dve cesty apoptózy, vonkajšie a vnútorné. Prvý je sprostredkovaný aktiváciou ligandov smrti (FasL, TNF) na ich interakcii s ich príslušnými receptormi smrti (DR). Kaspáza-8 je hlavným induktorom apoptózy u zvieracích koronavírusov, ktoré pôsobia prostredníctvom DR. Tento enzým, pri aktivácii, štiepi ponuku, proteín Bcl2, čo vedie k uvoľneniu mitochondriálneho cytochrómu c. Ten je kľúčový pre tvorbu apoptozómu štiepením a aktiváciou kaspázy 9.
Vnútorná dráha je založená na permeabilizácii mitochondriálnych vonkajších membrán a je pozorovaná hlavne u zvieracích koronavírusov. Proteíny Bcl2, ako sú Bax a Bak, uprednostňujú apoptózu a sú potrebné na spustenie tohto procesu vnútornou alebo mitochondriálnou cestou, spolu s kaspázou-9.
Mnoho zvieracích koronavírusov spôsobuje aktiváciu vonkajších aj vnútorných dráh, ukazujúci zložitú sieť signálnych dráh zapojených do apoptózy.
Vírusové genómy často kódujú gény, ktoré sú homológne s hostiteľskými anti-apoptotickými proteínmi. To im umožňuje oddialiť apoptózu v počiatočných štádiách infekcie, a tak vytvoriť adekvátny výnos nových viriónov. Iné vírusové proteíny môžu zabrániť transkripcii niektorých apoptotických génov alebo spôsobiť úpravu ich proteínových produktov, potlačiť ich aktivitu.
Indukcia apoptózy vírusovými proteínmi môže zahŕňať ukončenie translácie závislej od čiapky v hostiteľských bunkách, navodenie apoptózy, ako je vidieť na poliovírusu. V prípade vírusu hepatitídy C, vírusový proteín NS3 interaguje s kaspázou-8, na spustenie bunkovej smrti.
Súčasný prehľad je zameraný na identifikáciu pro-apoptotických mechanizmov vyvolaných koronavírusmi zvierat. Napríklad Vírus prasacej epidemickej hnačky (PEDV) spúšťa zmeny v expresii 14 génov zapojených do apoptózy nezávislej od kaspázy, aby sa podporila jej replikácia, ako aj produkovať charakteristické znaky choroby.
Ďalším spôsobom, akým sa apoptóza podieľa na replikácii vírusu, je aktivácia kaspázy, ktorý je potrebný na štiepenie vírusového nukleokapsidového (N) proteínu počas tohto procesu. To je prípad prenosného vírusu gastroenteritídy (TGEV), ktorá aktivuje rodinu MAPK, ako aj apoptózu indukovanú FasL a mitochondriami. Tento proces tiež zahŕňa downreguláciu hostiteľských mikroRNA, ktoré potláčajú mitochondriálnu apoptotickú dráhu.
Betacoronavírusy, ako je vírus myšej hepatitídy (MHV), vyvoláva apoptózu. Tento vírus vykazuje apoptózu indukovanú obalovým proteínom (E), opäť prostredníctvom aktivácie kaspázy. V tomto prípade, apoptóza sa zdá byť ochranná pred produkciou viriónu.
S vírusom prasacej hemaglutinujúcej encefalomyelitídy (PHEV) bunková smrť je sprostredkovaná DR a mitochondriálnymi dráhami, zahŕňajúce kaspázu-8 a kaspázu-9, ako iniciátori, a kaspáza-3, ako efektor apoptózy.
Podobne, gama a delta-koronavírusy vykazujú komplexnú indukciu bunkových signálnych dráh v hostiteľskej bunke, čo vedie k modulácii apoptózy. Preto mnoho vírusových proteínov moduluje dráhy hostiteľských buniek na podporu replikácie vírusu a znakov ochorenia.
Skutočnosť, že k apoptóze dochádza po infekcii viacerých hostiteľov celým radom koronavírusov, vedie k záveru, že je to bežný znak infekcie ľudskými a zvieracími koronavírusmi a jeho cieľom je podporovať šírenie.
S predchádzajúcim závažným akútnym respiračným syndrómom koronavírusom (SARS-CoV), proteín 7a tvorí komplex s proteínom Bcl-XL alebo inými faktormi prežitia, ich deaktivácia a tým umožnenie postupu apoptózy prostredníctvom aktivácie kaspázy-3. Proteáza podobná 3CL (3CLpro) tiež aktivuje kaspázu-3 aj kaspázu-9, aby indukovala apoptózu v bunkovej kultúre.
Vírusy SARS-CoV aj v súčasnosti cirkulujúce SARS-CoV-2 majú proteín ORF3a, ktorý spúšťa bunkovú smrť aktiváciou kaspázy vo vonkajšej dráhe prostredníctvom DR.
Podobná úloha ešte nebola preukázaná pre vírusové proteíny pri infekciách zvierat koronavírusom. Avšak, s PEDV, podjednotka S1 hrotového proteínu, a neštrukturálny proteín 1 (NSP1), bolo navrhnuté ako iniciátor a efektor bunkovej smrti, respektíve na základe nedávnych experimentov.
Ďalšie štúdie môžu pomôcť pochopiť, ako tieto cesty fungujú v prípade iných koronavírusov. Súčasný stav znalostí môže naznačovať užitočnosť zamerania tejto cesty na zvládnutie infekcií koronavírusom.
 Nový nástroj na dešifrovanie črevného mikrobiómu
Nový nástroj na dešifrovanie črevného mikrobiómu
 Ak máte viac ako 50 rokov,
Ak máte viac ako 50 rokov,
 Matematický model odhaľuje riziko infekcie SARS-CoV-2 po transplantácii fekálnej mikrobioty
Matematický model odhaľuje riziko infekcie SARS-CoV-2 po transplantácii fekálnej mikrobioty
 Diagnostika vírusových infekcií pomocou mikro a nanorozmerných technológií
Diagnostika vírusových infekcií pomocou mikro a nanorozmerných technológií
 PENTAX Medical zvyšuje 125 dolárov,
PENTAX Medical zvyšuje 125 dolárov,
 Výskum ukazuje, že zamorenie črevnými parazitmi znižuje závažnosť ochorenia COVID-19
Výskum ukazuje, že zamorenie črevnými parazitmi znižuje závažnosť ochorenia COVID-19
 Rastové problémy u predčasne narodených detí spojené so zmenenými črevnými baktériami
Predčasne narodené deti, ktoré nerastú podľa očakávania alebo sa im nedarí, môžu mať problémy s vývojom svojho mikrobiómu, naznačuje nová štúdia. Tím vedcov z Detskej nemocnice Ann &Robert H. Lurie
Rastové problémy u predčasne narodených detí spojené so zmenenými črevnými baktériami
Predčasne narodené deti, ktoré nerastú podľa očakávania alebo sa im nedarí, môžu mať problémy s vývojom svojho mikrobiómu, naznačuje nová štúdia. Tím vedcov z Detskej nemocnice Ann &Robert H. Lurie
 Črevné bakteriálne zmeny ovplyvňujú výsledky liečby lupusu v tehotenstve
Priebeh tehotenstva, ako v skutočnej láske, nie vždy funguje hladko, keď máte lupus, správne nazývaný systémový lupus erythematosus (SLE). Táto autoimunitná choroba je príležitostne násilná, občas utl
Črevné bakteriálne zmeny ovplyvňujú výsledky liečby lupusu v tehotenstve
Priebeh tehotenstva, ako v skutočnej láske, nie vždy funguje hladko, keď máte lupus, správne nazývaný systémový lupus erythematosus (SLE). Táto autoimunitná choroba je príležitostne násilná, občas utl
 Organické jablká majú probiotické vlastnosti
Jablko denne ... hovorí staré príslovie. Zdá sa, že všetci súhlasia, súdiac podľa pozície číslo 1, ktorú jablká držia medzi ovocím na celom svete, pričom sa každoročne vyrobí 83 miliónov jabĺk. Nová
Organické jablká majú probiotické vlastnosti
Jablko denne ... hovorí staré príslovie. Zdá sa, že všetci súhlasia, súdiac podľa pozície číslo 1, ktorú jablká držia medzi ovocím na celom svete, pričom sa každoročne vyrobí 83 miliónov jabĺk. Nová