Un nuevo artículo en la revista Vida presenta una revisión preliminar de los factores virales implicados en el inicio y efecto de la apoptosis dentro de las células infectadas.
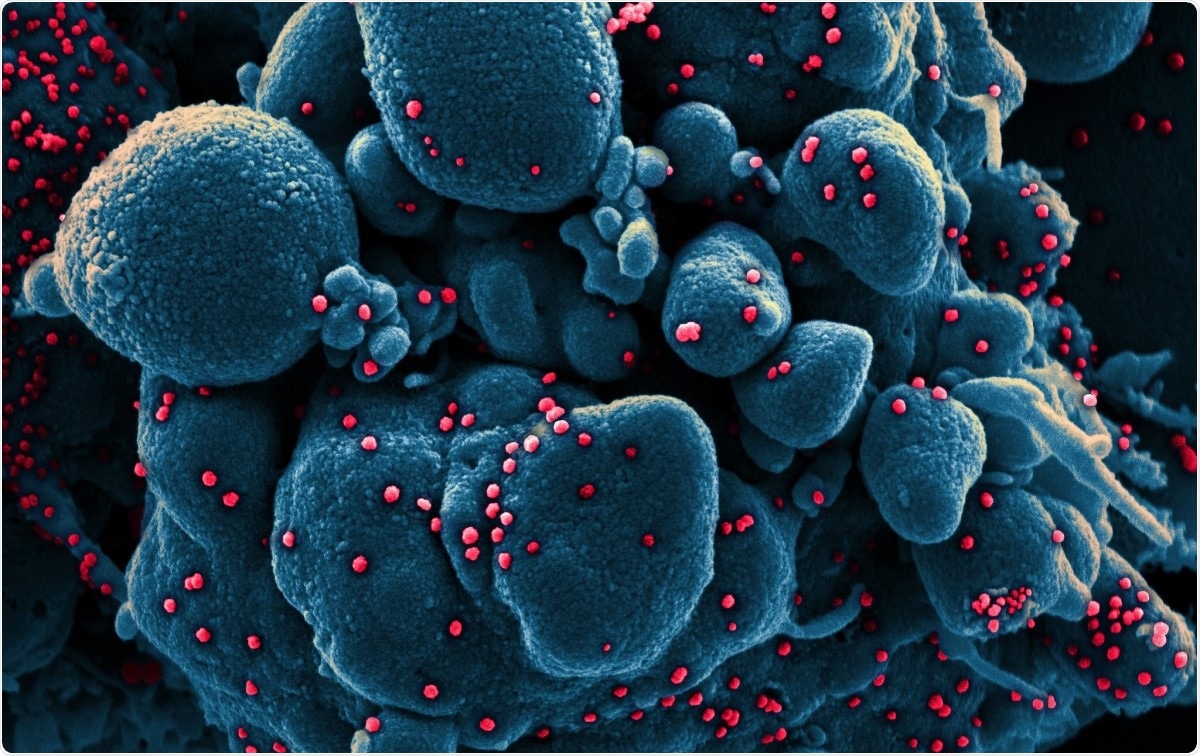 Micrografía electrónica de barrido coloreada de una célula apoptótica (azul) infectada con partículas del virus SARS-COV-2 (rojo), aislado de una muestra de un paciente. Imagen capturada en el NIAID Integrated Research Facility (IRF) en Fort Detrick, Maryland. Crédito de la imagen:NIAID / Flickr
Micrografía electrónica de barrido coloreada de una célula apoptótica (azul) infectada con partículas del virus SARS-COV-2 (rojo), aislado de una muestra de un paciente. Imagen capturada en el NIAID Integrated Research Facility (IRF) en Fort Detrick, Maryland. Crédito de la imagen:NIAID / Flickr Los coronavirus se encuentran entre los virus de ácido ribonucleico (ARN) más grandes identificados hasta ahora. Su genoma tiene aproximadamente 30 kb de longitud, con cuatro proteínas estructurales, y varias proteínas accesorias y no estructurales. Se clasifican en alfa, beta, coronavirus gamma y delta.
Hasta ahora se han aislado varios coronavirus animales y humanos y en su mayoría causan infecciones respiratorias o gastrointestinales. Como otros virus, secuestran la maquinaria de la célula huésped en todas las etapas de su replicación. Esto implica modificar la expresión de varios genes del huésped, incluidos los que codifican las defensas del huésped para facilitar la replicación viral.
Recientemente, Los estudios han demostrado que al inicio de la infección, Los coronavirus alteran el metabolismo celular y aumentan la tasa de muerte celular. Esto ocurre antes de que se active la inmunidad adaptativa, y esto podría indicar su papel en la infección viral productiva.
Dos de los procesos más importantes involucrados en esta modulación son la apoptosis y la modificación del ciclo celular. La apoptosis se desencadena por una serie de vías de señalización. La apoptosis puede reducir la propagación viral, pero también puede producirse el efecto contrario:la liberación de las partículas virales infecciosas recién producidas durante la infección lítica.
Las vías celulares que activan la apoptosis pueden desencadenarse directamente por la propia infección viral o indirectamente a través de otras cascadas de señalización. Este último se desencadena por la presencia del virus y recluta células inmunes al sitio de infección. El evento final es la apoptosis, causando daño significativo a los tejidos en la infección lítica.
Los componentes virales dentro de la célula se denominan patrones moleculares asociados a patógenos (PAMP) y son reconocidos por receptores de reconocimiento de patrones (PRR). Estos responden activando citocinas y otras moléculas de señalización que regulan positivamente la expresión del gen del interferón.
Otro mecanismo de defensa implica el reconocimiento del ácido nucleico viral por las proteínas del huésped que se asocian, como los PRR, con proteínas adaptadoras para activar dos factores de transcripción clave, a saber, Factor regulador 3 de NFĸB e IFN (IRF3). Estos se trasladan al núcleo y aumentan la expresión de interferones de tipo I (IFN).
Estos se unen al receptor de IFN-α / β (IFNAR), Sucesivamente, desencadenó un sistema de señales que implican la vía de transductores de señal / transductores de señal de Janus y activadores de la transcripción (JAK / STAT). El resultado es la regulación positiva de múltiples genes estimulados por IFN (ISG).
Estos genes inactivan el proceso involucrado en la síntesis de proteínas celulares y así inducen la muerte celular. Otro ISG que participa en este proceso de cierre de la traducción es la combinación de 2 ′, 5′-oligoadenilato sintetasa (OAS) y RNasa L.
La apoptosis está regulada por varias proteínas pro y antiapoptóticas en la célula huésped. Una de esas familias de proteínas es la familia Bcl-2 (linfoma de células B-2), incluidos los factores que causan la poración de la membrana mitocondrial y la eventual activación de las enzimas caspasas, iniciando la apoptosis. Otros protegen contra la apoptosis.
Otra familia son las proteínas quinasas activadas por mitógenos (MAPK), que incluyen quinasa 1/2 regulada extracelular (ERK1 / 2), ERK5, p38, y quinasas c-Jun N-terminales (JNK). El primero está regulado positivamente por factores de crecimiento y mitógenos, los dos últimos por estrés celular. La vía JNK puede conducir a la activación de genes proapoptóticos o puede interactuar con genes Bcl-2 para hacerlo, o puede activar otros factores de transcripción como 53 y p73.
Se han identificado dos vías de apoptosis, lo extrínseco y lo intrínseco. El primero está mediado por la activación de ligandos de muerte (FasL, TNF) en su interacción con sus respectivos receptores de muerte (DR). La caspasa-8 es un inductor importante de apoptosis en coronavirus animales que actúan a través de DR. Esta enzima, cuando se activa, escinde oferta una proteína Bcl2, que conduce a la liberación del citocromo mitocondrial c. Este último es clave para la formación del apoptosoma con la escisión y activación de la caspasa 9.
La vía intrínseca se basa en la permeabilización de las membranas externas mitocondriales y se observa principalmente en los coronavirus animales. Las proteínas Bcl2 como Bax y Bak favorecen la apoptosis y son necesarias para desencadenar este proceso a través de la vía intrínseca o mediada por mitocondrias, junto con caspasa-9.
Muchos coronavirus animales provocan la activación de vías tanto extrínsecas como intrínsecas, mostrando la intrincada red de vías de señalización implicadas en la apoptosis.
Los genomas virales a menudo codifican genes que son homólogos para hospedar proteínas anti-apoptóticas. Esto les permite retrasar la apoptosis en las primeras etapas de la infección y así generar un rendimiento adecuado de nuevos viriones. Otras proteínas virales pueden prevenir la transcripción de algunos genes apoptóticos o provocar la modificación de sus productos proteicos. para suprimir su actividad.
La inducción de apoptosis por proteínas virales puede implicar la terminación de la traducción dependiente de cap en las células huésped, inducir apoptosis, como se ve con el poliovirus. En el caso del virus de la hepatitis C, la proteína viral NS3 interactúa con caspasa-8, para desencadenar la muerte celular.
La revisión actual se centra en identificar los mecanismos proapoptóticos desencadenados por los coronavirus animales. Por ejemplo, el virus de la diarrea epidémica porcina (PEDV) desencadena cambios en la expresión de 14 genes involucrados en la apoptosis independiente de caspasa para promover su replicación, además de producir los rasgos característicos de la enfermedad.
Otra forma en que la apoptosis está involucrada en la replicación viral es activando la caspasa, que se requiere para la escisión de la proteína nucleocápsida (N) viral durante este proceso. Este es el caso del virus de la gastroenteritis transmisible (TGEV), que activa la familia MAPK, así como apoptosis inducida por FasL y mitocondrias. Este proceso también incluye la regulación a la baja de los microARN del huésped que suprimen la vía apoptótica mitocondrial.
Betacoronavirus, como el virus de la hepatitis murina (MHV), induce la apoptosis. Este virus muestra apoptosis inducida por la proteína de la envoltura (E), de nuevo a través de la activación de caspasa. En este caso, la apoptosis parece proteger contra la producción de viriones.
Con el virus de la encefalomielitis hemaglutinante porcina (PHEV), la muerte celular está mediada por DR y las vías mediadas por mitocondrias, que involucra caspasa-8 y caspasa-9, como iniciadores, y caspasa-3, como efector de apoptosis.
Similar, los coronavirus gamma y delta muestran una inducción compleja de vías de señalización celular en la célula huésped, que conduce a la modulación de la apoptosis. Por lo tanto, muchas proteínas virales modulan las vías de la célula huésped para promover la replicación viral y las características de la enfermedad.
El hecho de que la apoptosis se produzca tras la infección de múltiples huéspedes por una variedad de coronavirus lleva a la conclusión de que es una característica común de la infección por coronavirus humanos y animales y tiene como objetivo favorecer la propagación.
Con el coronavirus del síndrome respiratorio agudo severo anterior (SARS-CoV), la proteína 7a forma un complejo con la proteína Bcl-XL u otros factores pro-supervivencia, inactivándolos y permitiendo así que la apoptosis proceda a través de la activación de caspasa-3. La proteasa similar a 3CL (3CLpro) también activa tanto la caspasa-3 como la caspasa-9 para inducir la apoptosis en cultivos celulares.
Tanto el SARS-CoV como los virus SARS-CoV-2 que circulan actualmente tienen la proteína ORF3a que desencadena la muerte celular a través de la activación de la caspasa en la vía extrínseca a través de las DR.
Aún no se ha demostrado un papel similar para las proteínas virales en las infecciones por coronavirus animal. Sin embargo, con PEDV, la subunidad S1 de la proteína de pico, y la proteína no estructural 1 (NSP1), se ha sugerido que es el iniciador y efector de la muerte celular, respectivamente, basado en experimentos recientes.
Más estudios pueden ayudar a comprender cómo operan estas vías en otros coronavirus. El estado actual de los conocimientos puede indicar la utilidad de apuntar a esta vía para controlar las infecciones por coronavirus.
 La superbacteria E. coli se propaga por una mala higiene del baño,
La superbacteria E. coli se propaga por una mala higiene del baño,
 Los inhibidores de GSK-3 se muestran prometedores en el tratamiento de las infecciones por coronavirus
Los inhibidores de GSK-3 se muestran prometedores en el tratamiento de las infecciones por coronavirus
 La dieta a base de plantas podría curar su artritis reumatoide
La dieta a base de plantas podría curar su artritis reumatoide
 Creación de un mapa físico y genético de Cannabis sativa
Creación de un mapa físico y genético de Cannabis sativa
 La codificación de metabarras de ADN podría mejorar el análisis de la dieta humana
La codificación de metabarras de ADN podría mejorar el análisis de la dieta humana
 El microbioma intestinal puede desempeñar un papel en el COVID-19 severo
El microbioma intestinal puede desempeñar un papel en el COVID-19 severo
 Un hongo común que se encuentra en la piel puede causar enfermedad inflamatoria intestinal
Las terapias que se dirigen a ciertos hongos comensales podrían proporcionar una nueva forma de tratar la enfermedad inflamatoria intestinal (EII), según investigadores de LA. Backgroundy |
Un hongo común que se encuentra en la piel puede causar enfermedad inflamatoria intestinal
Las terapias que se dirigen a ciertos hongos comensales podrían proporcionar una nueva forma de tratar la enfermedad inflamatoria intestinal (EII), según investigadores de LA. Backgroundy |
 Modificar genéticamente las bacterias intestinales reduce el riesgo de cáncer colorrectal en ratones, según un estudio
Los investigadores han descubierto que la edición de los genes de las bacterias presentes en el intestino de los ratones podría ayudar a reducir la inflamación y el riesgo asociado de cánceres colorre
Modificar genéticamente las bacterias intestinales reduce el riesgo de cáncer colorrectal en ratones, según un estudio
Los investigadores han descubierto que la edición de los genes de las bacterias presentes en el intestino de los ratones podría ayudar a reducir la inflamación y el riesgo asociado de cánceres colorre
 El trasplante fecal de ciertos donantes mejor que otros
El trasplante de microbiota fecal o el trasplante de heces de un donante es útil para los pacientes infectados con el mortal recurrente. Clostridium difficile que conduce a una diarrea severa, dolor
El trasplante fecal de ciertos donantes mejor que otros
El trasplante de microbiota fecal o el trasplante de heces de un donante es útil para los pacientes infectados con el mortal recurrente. Clostridium difficile que conduce a una diarrea severa, dolor