Ein neuer Beitrag in der Zeitschrift Leben präsentiert einen frühen Überblick über die viralen Faktoren, die an der Initiierung und Beeinflussung der Apoptose in infizierten Zellen beteiligt sind.
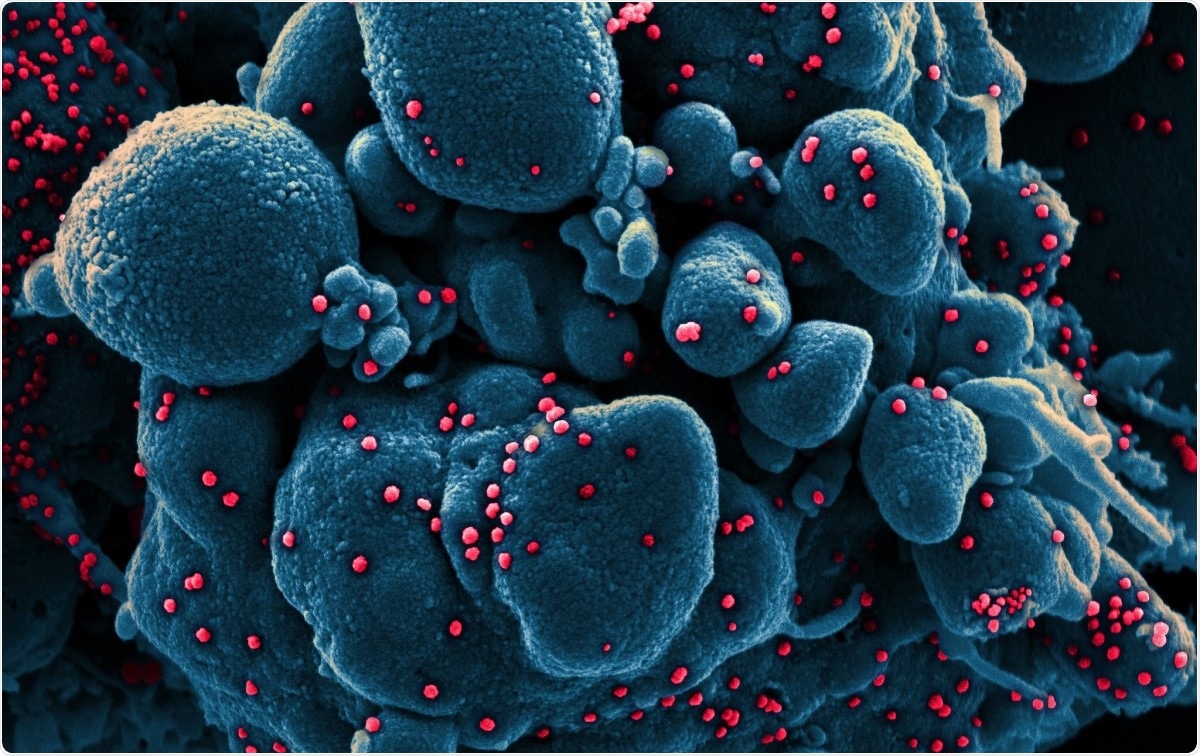 Farbige rasterelektronenmikroskopische Aufnahme einer apoptotischen Zelle (blau), die mit SARS-COV-2-Viruspartikeln (rot) infiziert ist, aus einer Patientenprobe isoliert. Bild aufgenommen in der NIAID Integrated Research Facility (IRF) in Fort Detrick, Maryland. Bildquelle:NIAID / Flickr
Farbige rasterelektronenmikroskopische Aufnahme einer apoptotischen Zelle (blau), die mit SARS-COV-2-Viruspartikeln (rot) infiziert ist, aus einer Patientenprobe isoliert. Bild aufgenommen in der NIAID Integrated Research Facility (IRF) in Fort Detrick, Maryland. Bildquelle:NIAID / Flickr Coronaviren gehören zu den größten bisher identifizierten Ribonukleinsäure (RNA)-Viren. Ihr Genom ist etwa 30 kb lang, mit vier Strukturproteinen, und mehrere nicht-strukturelle und akzessorische Proteine. Sie werden in Alpha, Beta, Gamma- und Delta-Coronaviren.
Mehrere tierische und menschliche Coronaviren wurden bisher isoliert und verursachen meist Atemwegs- oder Magen-Darm-Infektionen. Wie andere Viren, sie entführen die Wirtszellmaschinerie in allen Stadien ihrer Replikation. Dabei wird die Expression verschiedener Wirtsgene verändert, einschließlich solcher, die die Abwehr des Wirts kodieren, um die virale Replikation zu erleichtern.
Vor kurzem, Studien haben gezeigt, dass zu Beginn der Infektion, Coronaviren verändern den Zellstoffwechsel und erhöhen die Zelltodrate. Dies geschieht, bevor die adaptive Immunität ausgelöst wird. und dies könnte auf seine Rolle bei der produktiven Virusinfektion hinweisen.
Zwei der wichtigsten Prozesse, die an dieser Modulation beteiligt sind, sind Apoptose und Zellzyklusmodifikation. Die Apoptose wird durch eine Reihe von Signalwegen ausgelöst. Apoptose kann die Virusausbreitung reduzieren, es kann aber auch der gegenteilige Effekt auftreten – die Freisetzung der infektiösen neu produzierten Viruspartikel während der lytischen Infektion.
Die Zellwege, die die Apoptose aktivieren, können direkt durch die Virusinfektion selbst oder indirekt über andere Signalkaskaden ausgelöst werden. Letzteres wird durch das Vorhandensein des Virus ausgelöst und rekrutiert Immunzellen an den Infektionsort. Das Endereignis ist Apoptose, bei einer lytischen Infektion erhebliche Gewebeschäden verursachen.
Die viralen Bestandteile innerhalb der Zelle werden Pathogen-assoziierte molekulare Muster (PAMPs) genannt und von Mustererkennungsrezeptoren (PRRs) erkannt. Diese reagieren, indem sie Zytokine und andere Signalmoleküle aktivieren, die die Interferon-Genexpression hochregulieren.
Ein weiterer Abwehrmechanismus beinhaltet die Erkennung viraler Nukleinsäure durch Wirtsproteine, die assoziieren, wie die PRRs, mit Adapterproteinen, um zwei wichtige Transkriptionsfaktoren zu aktivieren, nämlich, NFĸB und IFN regulatorischer Faktor 3 (IRF3). Diese werden in den Zellkern verlagert und erhöhen die Expression von Typ-I-Interferonen (IFNs).
Diese binden an den IFN-α/β-Rezeptor (IFNAR), im Gegenzug, ein Signalsystem in Gang setzen, das die Janus-Kinase/Signaltransducer und Aktivatoren der Transkription (JAK/STAT) umfasst. Das Ergebnis ist die Hochregulierung mehrerer IFN-stimulierter Gene (ISGs).
Diese Gene inaktivieren den Prozess der Synthese von Zellproteinen und induzieren so den Zelltod. Eine weitere ISG, die an diesem Prozess des Herunterfahrens der Übersetzung beteiligt ist, ist die Kombination von 2′, 5'-Oligoadenylatsynthetase (OAS) und RNase L.
Die Apoptose wird durch mehrere pro- und anti-apoptotische Proteine in der Wirtszelle reguliert. Eine solche Proteinfamilie ist die Bcl-2 (B-Zell-Lymphom-2)-Familie. einschließlich Faktoren, die eine Poration der Mitochondrienmembran und eine eventuelle Aktivierung von Caspase-Enzymen verursachen, Apoptose einleiten. Andere schützen vor Apoptose.
Eine weitere Familie sind die Mitogen-aktivierten Proteinkinasen (MAPKs). die extrazellulär regulierte Kinase 1/2 (ERK1/2) umfassen, ERK5, S.38, und c-Jun N-terminale Kinasen (JNK). Die erste wird durch Wachstumsfaktoren und Mitogene hochreguliert. die letzten beiden durch Zellstress. Der JNK-Weg kann zur Aktivierung pro-apoptotischer Gene führen oder dazu mit Bcl-2-Genen interagieren. oder können andere Transkriptionsfaktoren wie 53 und p73 aktivieren.
Es wurden zwei Wege der Apoptose identifiziert, das Extrinsische und das Intrinsische. Ersteres wird durch die Aktivierung von Todesliganden (FasL, TNF) auf ihre Interaktion mit ihren jeweiligen Todesrezeptoren (DRs). Caspase-8 ist ein wichtiger Induktor der Apoptose bei tierischen Coronaviren, die über DRs wirken. Dieses Enzym, wenn aktiviert, spaltet Gebot, ein Bcl2-Protein, was zur Freisetzung von mitochondrialem Cytochrom c führt. Letzteres ist der Schlüssel zur Bildung des Apoptosoms mit der Spaltung und Aktivierung von Caspase 9.
Der intrinsische Weg basiert auf der Permeabilisierung der mitochondrialen Außenmembranen und wird hauptsächlich bei tierischen Coronaviren beobachtet. Bcl2-Proteine wie Bax und Bak begünstigen die Apoptose und werden benötigt, um diesen Prozess über den intrinsischen oder mitochondrial vermittelten Weg auszulösen. zusammen mit Caspase-9.
Viele tierische Coronaviren verursachen eine Aktivierung von sowohl extrinsischen als auch intrinsischen Signalwegen. zeigt das komplizierte Netzwerk von Signalwegen, die an der Apoptose beteiligt sind.
Virale Genome kodieren oft Gene, die homolog zu anti-apoptotischen Wirtsproteinen sind. Dadurch können sie die Apoptose in den frühen Stadien der Infektion verzögern und so eine ausreichende Ausbeute an neuen Virionen generieren. Andere virale Proteine können die Transkription einiger apoptotischer Gene verhindern oder die Modifikation ihrer Proteinprodukte verursachen. ihre Aktivität zu unterdrücken.
Die Induktion der Apoptose durch virale Proteine kann die Beendigung der cap-abhängigen Translation in Wirtszellen beinhalten. Apoptose induzieren, wie beim Poliovirus gesehen. Im Falle des Hepatitis-C-Virus, das virale NS3-Protein interagiert mit Caspase-8, Zelltod auszulösen.
Der aktuelle Review konzentriert sich auf die Identifizierung pro-apoptotischer Mechanismen, die durch tierische Coronaviren ausgelöst werden. Zum Beispiel, das Porcine Epidemic Diarrea Virus (PEDV) löst Veränderungen in der Expression von 14 Genen aus, die an der Caspase-unabhängigen Apoptose beteiligt sind, um deren Replikation zu fördern, sowie die charakteristischen Merkmale der Krankheit hervorzubringen.
Eine andere Art, wie Apoptose an der Virusreplikation beteiligt ist, ist die Aktivierung von Caspase, welches für die Spaltung des viralen Nukleokapsid(N)-Proteins während dieses Prozesses benötigt wird. Dies ist beim Transmissiblen Gastroenteritis Virus (TGEV) der Fall. die die MAPK-Familie aktiviert, sowie FasL- und Mitochondrien-induzierte Apoptose. Dieser Prozess umfasst auch die Herunterregulierung von Wirts-microRNAs, die den mitochondrialen apoptotischen Signalweg unterdrücken.
Betacoronaviren, wie das Maus-Hepatitis-Virus (MHV), induziert Apoptose. Dieses Virus zeigt Hüllprotein (E)-induzierte Apoptose, wieder über die Caspase-Aktivierung. In diesem Fall, Apoptose scheint gegen die Virionenproduktion zu schützen.
Mit dem porcinen hämagglutinierenden Enzephalomyelitis-Virus (PHEV) der Zelltod wird durch DRs und die mitochondrial vermittelten Signalwege vermittelt, mit Caspase-8 und Caspase-9, als Initiatoren, und Caspase-3, als Effektor der Apoptose.
Ähnlich, die Gamma- und Delta-Coronaviren zeigen eine komplexe Induktion zellulärer Signalwege in der Wirtszelle, was zur Modulation der Apoptose führt. Daher, viele virale Proteine modulieren Wirtszellwege, um die virale Replikation und Krankheitsmerkmale zu fördern.
Die Tatsache, dass die Apoptose nach einer Infektion mehrerer Wirte mit einer Reihe von Coronaviren auftritt, lässt den Schluss zu, dass sie ein gemeinsames Merkmal der Infektion mit menschlichen und tierischen Coronaviren ist und darauf abzielt, die Vermehrung zu begünstigen.
Mit dem früheren Coronavirus des schweren akuten respiratorischen Syndroms (SARS-CoV) das 7a-Protein einen Komplex mit Bcl-XL-Protein oder anderen überlebensfördernden Faktoren bildet, indem sie sie inaktivieren und somit die Apoptose über die Caspase-3-Aktivierung ablaufen lassen. Die 3CL-ähnliche Protease (3CLpro) aktiviert auch Caspase-3 und Caspase-9, um in Zellkulturen Apoptose zu induzieren.
Sowohl SARS-CoV als auch die derzeit zirkulierenden SARS-CoV-2-Viren besitzen das ORF3a-Protein, das den Zelltod über Caspase-Aktivierung im extrinsischen Weg durch DRs auslöst.
Eine ähnliche Rolle wurde für virale Proteine bei tierischen Coronavirus-Infektionen noch nicht gezeigt. Jedoch, mit PEDV, die S1-Untereinheit des Spike-Proteins, und das nicht-strukturelle Protein 1 (NSP1), wurde als Initiator und Effektor des Zelltods vermutet, bzw, basierend auf neueren Experimenten.
Weitere Studien könnten helfen zu verstehen, wie diese Signalwege bei anderen Coronaviren funktionieren. Der derzeitige Wissensstand könnte auf die Nützlichkeit der gezielten Behandlung dieses Signalwegs bei der Behandlung von Coronavirus-Infektionen hinweisen.
 Xylit und Grapefruitkernextrakt sind vielversprechend bei der Vorbeugung einer SARS-CoV-2-Infektion.
Xylit und Grapefruitkernextrakt sind vielversprechend bei der Vorbeugung einer SARS-CoV-2-Infektion.
 Umgang mit Reizdarmsyndrom
Umgang mit Reizdarmsyndrom
 Gentechnisch veränderte Darmbakterien reduzieren das Risiko von Darmkrebs bei Mäusen, findet Studie
Gentechnisch veränderte Darmbakterien reduzieren das Risiko von Darmkrebs bei Mäusen, findet Studie
 Gesündeste Darmbakterien bei pflanzlicher oder mediterraner Ernährung
Gesündeste Darmbakterien bei pflanzlicher oder mediterraner Ernährung
 Häufiger Pilz auf der Haut kann entzündliche Darmerkrankungen verursachen
Häufiger Pilz auf der Haut kann entzündliche Darmerkrankungen verursachen
 Eine vegane Ernährung könnte Darmmikroben fördern, die beim Abnehmen helfen
Eine vegane Ernährung könnte Darmmikroben fördern, die beim Abnehmen helfen
 Dass Pepto Ihrem Geschwür wahrscheinlich nicht hilft
Ein Magengeschwür ist eine Wunde oder Läsion, die sich in der Schleimhaut der Speiseröhre entwickelt. Magen, oder Zwölffingerdarm. Vor kurzem, Es wurde angenommen, dass Geschwüre durch eine Person ver
Dass Pepto Ihrem Geschwür wahrscheinlich nicht hilft
Ein Magengeschwür ist eine Wunde oder Läsion, die sich in der Schleimhaut der Speiseröhre entwickelt. Magen, oder Zwölffingerdarm. Vor kurzem, Es wurde angenommen, dass Geschwüre durch eine Person ver
 RNA-Sequenzierung bietet neue Einblicke in das Mikrobiom
Forscher der University of Chicago haben eine revolutionäre Strategie entwickelt, um die Aktivität des Darmmikrobioms zu untersuchen – mit Hochdurchsatz-Sequenzierung von tRNA. Alpha Taur
RNA-Sequenzierung bietet neue Einblicke in das Mikrobiom
Forscher der University of Chicago haben eine revolutionäre Strategie entwickelt, um die Aktivität des Darmmikrobioms zu untersuchen – mit Hochdurchsatz-Sequenzierung von tRNA. Alpha Taur
 Männer, die zweimal pro Woche Joghurt essen, erkranken seltener an Darmkrebs
Neue Forschungen haben ergeben, dass Männer, die zwei oder mehr Portionen Joghurt pro Woche essen, ihr Risiko für die Entwicklung von Krebsvorstufen, die zu Darmkrebs führen können, verringern können.
Männer, die zweimal pro Woche Joghurt essen, erkranken seltener an Darmkrebs
Neue Forschungen haben ergeben, dass Männer, die zwei oder mehr Portionen Joghurt pro Woche essen, ihr Risiko für die Entwicklung von Krebsvorstufen, die zu Darmkrebs führen können, verringern können.