LUNEDI', 24 agosto 2015 (HealthDay News) - L'approvazione della Food and Drug Administration statunitense del farmaco Promacta (eltrombopag) è stata ampliata per includere i bambini di un anno e più con una rara malattia del sangue chiamata porpora trombocitopenica immunitaria cronica (ITP).
La PTI è caratterizzata da un basso numero di piastrine nel sangue. Promacta è ora approvato per il disturbo tra i bambini che hanno avuto risultati insoddisfacenti con altri farmaci o con un intervento chirurgico per rimuovere la milza, ha affermato l'agenzia in un comunicato stampa.
Le piastrine aiutano la coagulazione del sangue e le persone con ITP possono sviluppare sanguinamento sotto la pelle o nelle mucose come la bocca. Promacta una volta al giorno è progettato per aiutare ad aumentare la produzione di piastrine, ha affermato la FDA.
Il farmaco, disponibile in forma di pillola o polvere, è stato valutato clinicamente in uno studio che ha coinvolto 159 persone. Circa il 62% di coloro che hanno assunto Promacta ha riscontrato un miglioramento della conta piastrinica, rispetto al 32% di coloro che hanno assunto un placebo.
Gli effetti collaterali più comuni di Promacta includevano infezioni delle vie respiratorie superiori, diarrea, dolore addominale, eruzioni cutanee e aumento degli enzimi epatici.
Il farmaco non è stato valutato tra i bambini di età inferiore a un anno, ha affermato la FDA.
Promacta è prodotto da Novartis, con sede a East Hanover, N.J.
-- Scott Roberts

Copyright © 2015 HealthDay. Tutti i diritti riservati.
 Il microbioma intestinale può avere un ruolo nella grave COVID-19
Lattuale pandemia globale di COVID-19 è causata dal beta coronavirus sindrome respiratoria acuta grave coronavirus-2 (SARS-CoV-2), che ha contagiato oltre 22,1 milioni e causato 780mila morti nel mond
Il microbioma intestinale può avere un ruolo nella grave COVID-19
Lattuale pandemia globale di COVID-19 è causata dal beta coronavirus sindrome respiratoria acuta grave coronavirus-2 (SARS-CoV-2), che ha contagiato oltre 22,1 milioni e causato 780mila morti nel mond
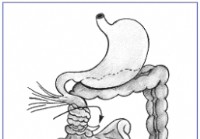 Volvolo
Volvolo è una condizione in cui lintestino si attorciglia su se stesso, causando ostruzione al flusso di materiale attraverso lintestino. Può anche portare allostruzione dellafflusso di sangue allinte
Volvolo
Volvolo è una condizione in cui lintestino si attorciglia su se stesso, causando ostruzione al flusso di materiale attraverso lintestino. Può anche portare allostruzione dellafflusso di sangue allinte
 È improbabile che i cani domestici trasmettano SARS-CoV-2,
dire ricercatori Ricercatori in Spagna e Germania hanno condotto uno studio che dimostra che è improbabile che i cani domestici contribuiscano alla trasmissione e alla diffusione nella comunità della
È improbabile che i cani domestici trasmettano SARS-CoV-2,
dire ricercatori Ricercatori in Spagna e Germania hanno condotto uno studio che dimostra che è improbabile che i cani domestici contribuiscano alla trasmissione e alla diffusione nella comunità della