MERCOLEDI', 1 marzo 2017 (HealthDay News) -- Le compresse di Xermelo (telotristat etile) sono state approvate dalla Food and Drug Administration statunitense per il trattamento di adulti con diarrea da sindrome carcinoide, uno di una serie di sintomi correlati a tumori carcinoidi rari.
La maggior parte di questi tumori a crescita lenta si trova nel tratto gastrointestinale, ha affermato l'agenzia in un comunicato stampa. La sindrome da carcinoide si verifica in meno del 10% delle persone con tumori carcinoidi, comunemente dopo che il tumore si è diffuso al fegato. Il tumore rilascia una quantità eccessiva dell'ormone serotonina, causando diarrea.
Le complicazioni possono includere perdita di peso, malnutrizione, disidratazione e squilibrio degli elettroliti.
Xermelo, assunto tre volte al giorno con il cibo, è progettato per inibire la produzione di serotonina da parte dei tumori carcinoidi, ha affermato la FDA.
Il farmaco è stato valutato in studi clinici che hanno coinvolto 90 adulti con diarrea da sindrome carcinoide, confrontando i risultati di quelli trattati con il farmaco rispetto a un placebo. L'agenzia ha avvertito che le persone a cui è stata somministrata una dose superiore a quella raccomandata hanno sviluppato una grave stitichezza e uno ha richiesto il ricovero in ospedale. Qualsiasi utente di Xermelo che sviluppi una grave costipazione o dolore addominale dovrebbe interrompere il farmaco e contattare un medico, ha affermato la FDA.
Xermelo è prodotto da Lexicon Pharmaceuticals, con sede a Woodlands, Texas.
-- Scott Roberts

Copyright © 2017 HealthDay. Tutti i diritti riservati.
 Come si può trattare il fecaloma
Come si può trattare il fecaloma
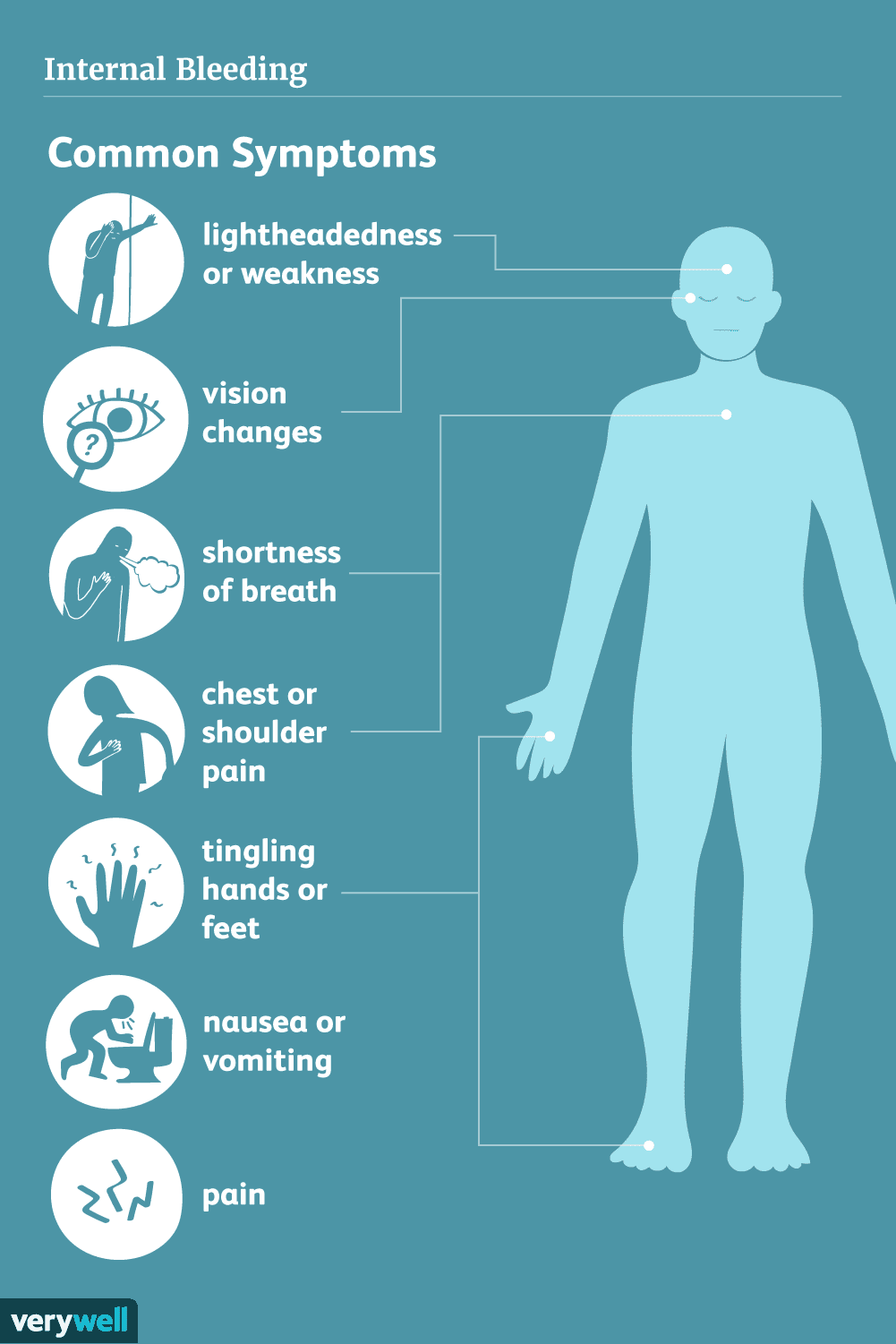 Sintomi di emorragia interna
Sintomi di emorragia interna
 Cos'è l'Omentum?
Cos'è l'Omentum?
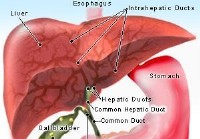 ERCP (colangio-pancreatografia retrograda endoscopica)
ERCP (colangio-pancreatografia retrograda endoscopica)
 Buone notizie per chi soffre di IBS poiché i ricercatori identificano il "prurito intestinale"
Buone notizie per chi soffre di IBS poiché i ricercatori identificano il "prurito intestinale"
 Braciole di maiale con mele e frutti di bosco decadenti da morire (senza avanzi per questo pasto)
Braciole di maiale con mele e frutti di bosco decadenti da morire (senza avanzi per questo pasto)
 Trattamento del cancro al fegato
Il cancro del fegato è un cancro che inizia nelle cellule del fegato. Il cancro al fegato è diverso dal cancro che si diffonde a il fegato. Il cancro che inizia in unaltra area del corpo, come il seno
Trattamento del cancro al fegato
Il cancro del fegato è un cancro che inizia nelle cellule del fegato. Il cancro al fegato è diverso dal cancro che si diffonde a il fegato. Il cancro che inizia in unaltra area del corpo, come il seno
 Dissinergia addomino-frenico:cosa devi sapere
A Accensione , uno dei disturbi più comuni che vediamo dai nostri clienti è il gonfiore e la distensione addominale. Il gonfiore è tipicamente descritto come una sensazione di aumento della pressione
Dissinergia addomino-frenico:cosa devi sapere
A Accensione , uno dei disturbi più comuni che vediamo dai nostri clienti è il gonfiore e la distensione addominale. Il gonfiore è tipicamente descritto come una sensazione di aumento della pressione
 3 casi di guarigione:sei un caso difficile o un caso lieve?
Una delle mie domande preferite che riceviamo (e ricevo da anni) si riduce sostanzialmente a questa: Quando potrò migliorare? ” Amo questa domanda. Soprattutto perché quando ero malato 7 anni fa ho p
3 casi di guarigione:sei un caso difficile o un caso lieve?
Una delle mie domande preferite che riceviamo (e ricevo da anni) si riduce sostanzialmente a questa: Quando potrò migliorare? ” Amo questa domanda. Soprattutto perché quando ero malato 7 anni fa ho p