A microbiota intestinal influencia a maneira como muitos processos corporais funcionam, como a função imunológica, metabolismo normal, e o desenvolvimento do organismo. Também afeta o comportamento do hospedeiro, incluindo atividades sociais e respostas ao estresse, que estão associados a muitos distúrbios diferentes do cérebro e / ou da mente. Contudo, não há muito conhecimento dos mecanismos subjacentes pelos quais as bactérias intestinais podem alterar a maneira como as células cerebrais funcionam, ou o comportamento do organismo maior.
Pesquisas anteriores fornecem fortes indícios da ligação entre a saúde intestinal e uma série de doenças tão diferentes como TEA e transtorno de estresse pós-traumático. Muitos estudos mostraram que as doenças autoimunes estão ligadas a um microbioma intestinal anormal, e também a várias condições psiquiátricas e neurológicas. Por exemplo, doença inflamatória intestinal, esclerose múltipla e psoríase são distúrbios de autoimunidade, e esses indivíduos têm um risco maior de ter um número menor de várias bactérias intestinais, bem como maiores chances de ansiedade, transtornos do humor e depressão. Genes comuns também parecem estar presentes em doenças psiquiátricas e autoimunes.
No presente estudo, os cientistas analisaram os cérebros de dois tipos de camundongos com microbiota intestinal anormal:camundongos que receberam antibióticos para reduzir o crescimento bacteriano no intestino, ou camundongos que foram criados em um ambiente totalmente estéril para serem livres de germes (GF). Eles primeiro expuseram essas populações de ratos a um perigo, e então o removeu. Ao estudar as respostas de aprendizagem nessas populações de camundongos, eles descobriram que ambos mostraram uma capacidade reduzida de aprender que um perigo que os ameaçava não era mais temível (chamado de aprendizado da extinção do medo). Em outras palavras, ratos normais desenvolvem uma resposta reflexa de medo a uma ameaça de perigo, mas com o tempo, à medida que o estímulo falhou em produzir qualquer dano após a exposição, suas respostas de medo condicionado diminuem. Esse aprendizado não foi aparente no GF ou nos camundongos tratados com antibióticos, que continuaram a mostrar respostas condicionadas ao medo ao longo do tempo.
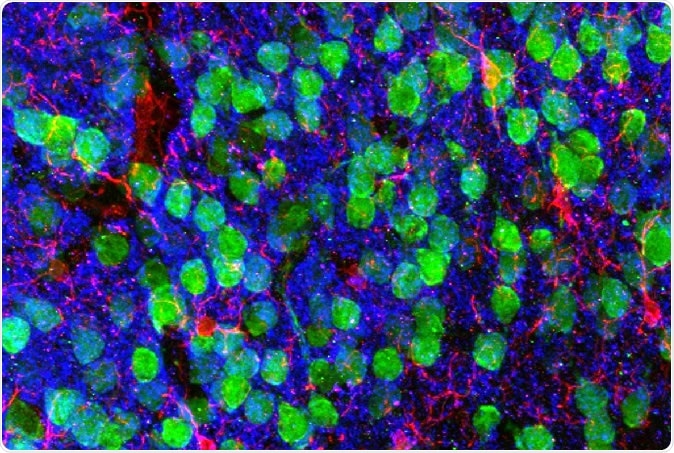 Imaginando o cérebro. Córtex pré-frontal medial demonstrando neurônios corticais (verde), microglia (vermelho), e o marcador pós-sináptico PSD95 (azul). Cortesia da imagem dos drs. Christopher Parkhurst e David Artis (WCM).
Imaginando o cérebro. Córtex pré-frontal medial demonstrando neurônios corticais (verde), microglia (vermelho), e o marcador pós-sináptico PSD95 (azul). Cortesia da imagem dos drs. Christopher Parkhurst e David Artis (WCM). Para descobrir o porquê, os pesquisadores sequenciaram o RNA dentro da microglia, as células imunológicas do cérebro. O RNA é a molécula intermediária entre o projeto genético no núcleo e a proteína final no citoplasma, produzido a partir do gene codificado. Assim, uma sequência de RNA mostra um gene expresso nessa célula particular.
O sequenciamento de RNA mostrou um padrão diferente de expressão gênica nas células cerebrais dessas populações de camundongos, que por sua vez afetou a remodelação normal que ocorre como parte do aprendizado. As células cerebrais formam conexões ou sinapses para passar informações entre si. Contudo, à medida que o aprendizado avança, certas sinapses são removidas e outras adicionadas, de acordo com o tráfego de impulsos ao longo dessa via. Isso é chamado de poda de sinapses e é um processo importante no aprendizado.
Ao examinar as diferenças na expressão gênica no córtex pré-frontal medial do cérebro do camundongo, os cientistas descobriram que, ao contrário da microglia em ratos saudáveis, essas microglia não mostraram mudanças normais de poda, e isso, por sua vez, reduziu o número de novas sinapses formadas durante uma experiência de aprendizado. Essa mudança afetou negativamente sua capacidade de aprender.
As espinhas dendríticas pós-sinápticas também não foram remodeladas normalmente, e os neurônios que codificam o sinal nessa parte do cérebro não conseguiram mostrar os níveis normais de atividade. Junto com microglia, neurônios excitatórios e outros tipos de células cerebrais mostraram mudanças semelhantes.
Além disso, os pesquisadores descobriram que houve mudanças nos níveis de quatro substâncias químicas no cérebro dos camundongos GF. Esses produtos químicos são normalmente associados a doenças neuropsiquiátricas, como esquizofrenia e transtorno do espectro do autismo. Mudanças nesses produtos químicos estão, portanto, intimamente ligadas a alterações no funcionamento do cérebro, que, por sua vez, decide como sentimos nosso ambiente e como respondemos a eles. O fato de um microbioma intestinal alterado estar ligado a algo tão fundamental quanto a química do cérebro é, portanto, significativo para desvendar o padrão subjacente. Como diz o pesquisador Frank Schroeder, “A química do cérebro determina essencialmente como nos sentimos e respondemos ao nosso ambiente, e há evidências de que produtos químicos derivados de micróbios intestinais desempenham um papel importante ”.
No estágio 3 - os pesquisadores agora tentaram restaurar a capacidade normal de aprendizagem em camundongos, colocando de volta os organismos do intestino para substituir aqueles que foram perdidos, no primeiro grupo, ou por transplante de microbiomas normais, na população GF. Eles tiveram sucesso se o microbioma intestinal foi restaurado ao normal imediatamente após o nascimento, com os ratos tratados mostrando padrões de aprendizagem normais. Por outro lado, a falta de melhora com intervenções posteriores sugere a necessidade essencial de sinais de um microbioma intestinal saudável para o cérebro em desenvolvimento assim que o bebê nasce.
Comentários do pesquisador Conor Liston, “Esta foi uma descoberta interessante, visto que muitas condições psiquiátricas associadas a doenças autoimunes estão associadas a problemas durante o desenvolvimento inicial do cérebro. ”
O pesquisador David Artis diz:“O eixo intestino-cérebro impacta cada ser humano todos os dias de suas vidas. Ninguém ainda entendeu como a DII e outras condições gastrointestinais crônicas influenciam o comportamento e a saúde mental. Nosso estudo fornece uma nova compreensão de como os mecanismos operam. ”
A elucidação da forma como a disbiose intestinal afeta o funcionamento do cérebro a nível molecular e celular irá, esperançosamente, acelerar a identificação de moléculas-alvo ou vias para tratar humanos afetados no futuro.
 Nova ferramenta registra e rastreia o crescimento do microbioma
Nova ferramenta registra e rastreia o crescimento do microbioma
 Pacientes em imunoterapia devem consumir mais fibras,
Pacientes em imunoterapia devem consumir mais fibras,
 O café ajuda a desenvolver micróbios intestinais saudáveis e evita os movimentos intestinais
O café ajuda a desenvolver micróbios intestinais saudáveis e evita os movimentos intestinais
 Os pesquisadores identificam uma bactéria com atividade anti-SARS-CoV-2 in vitro:Dolosigranulum pigrum
Os pesquisadores identificam uma bactéria com atividade anti-SARS-CoV-2 in vitro:Dolosigranulum pigrum
 Dieta e nutrição influenciam o microbioma na mucosa do cólon
Dieta e nutrição influenciam o microbioma na mucosa do cólon
 Microbiomas intestinais e orais predizem a gravidade de COVID-19
Microbiomas intestinais e orais predizem a gravidade de COVID-19
 Nova ferramenta registra e rastreia o crescimento do microbioma
Nos últimos anos, o microbioma humano ganhou imensa popularidade devido ao seu papel em moldar a saúde de uma pessoa. É essencial para o desenvolvimento humano, nutrição, e imunidade. É por isso que m
Nova ferramenta registra e rastreia o crescimento do microbioma
Nos últimos anos, o microbioma humano ganhou imensa popularidade devido ao seu papel em moldar a saúde de uma pessoa. É essencial para o desenvolvimento humano, nutrição, e imunidade. É por isso que m
 A pesquisa analisa os aerobiomas,
árvores e implicações para a saúde pública Os microrganismos ambientais desempenham um papel essencial na saúde humana - quanto diverso o consórcio, o melhor. A diversidade de microorganismos ajuda o
A pesquisa analisa os aerobiomas,
árvores e implicações para a saúde pública Os microrganismos ambientais desempenham um papel essencial na saúde humana - quanto diverso o consórcio, o melhor. A diversidade de microorganismos ajuda o
 Testes usados para diagnóstico de DRGE
Em alguns pacientes, podemos suspeitar de doença do refluxo gastroesofágico, mas os sintomas do paciente podem ser atípicos. Ou podemos simplesmente precisar confirmar nosso diagnóstico. Para fazer is
Testes usados para diagnóstico de DRGE
Em alguns pacientes, podemos suspeitar de doença do refluxo gastroesofágico, mas os sintomas do paciente podem ser atípicos. Ou podemos simplesmente precisar confirmar nosso diagnóstico. Para fazer is