Le microbiote intestinal influence le fonctionnement de nombreux processus corporels, comme la fonction immunitaire, métabolisme normal, et le développement de l'organisme. Il affecte également le comportement de l'hôte, y compris l'activité sociale et les réponses au stress, qui sont associés à de nombreux troubles différents du cerveau et/ou de l'esprit. Cependant, il n'y a pas beaucoup de connaissances sur les mécanismes sous-jacents par lesquels les bactéries intestinales peuvent modifier le fonctionnement des cellules du cerveau, ou le comportement de l'organisme plus grand.
Des recherches antérieures fournissent des indications solides sur le lien entre la santé intestinale et une gamme de maladies aussi différentes que les TSA et le trouble de stress post-traumatique. De nombreuses études ont montré que les maladies auto-immunes sont liées à un microbiome intestinal anormal, ainsi qu'à plusieurs troubles psychiatriques et neurologiques. Par exemple, maladie inflammatoire de l'intestin, la sclérose en plaques et le psoriasis sont tous des troubles de l'auto-immunité, et ces personnes ont un risque plus élevé d'avoir un nombre plus faible de diverses bactéries intestinales, ainsi qu'une plus grande probabilité d'anxiété, troubles de l'humeur et dépression. Des gènes communs semblent également être présents dans les affections psychiatriques et auto-immunes.
Dans la présente étude, les scientifiques ont examiné le cerveau de deux types de souris présentant un microbiote intestinal anormal :des souris ayant reçu des antibiotiques pour réduire la croissance bactérienne dans l'intestin, ou des souris qui ont été élevées dans un environnement totalement stérile pour être exemptes de germes (GF). Ils ont d'abord exposé ces populations de souris à un danger, puis l'a supprimé. En étudiant les réponses d'apprentissage dans ces populations de souris, ils ont constaté que les deux montraient une capacité réduite à apprendre qu'un danger qui les menaçait n'était plus à craindre (appelé apprentissage de l'extinction de la peur). En d'autres termes, les souris normales développent une réaction de peur réflexe à un danger menacé, mais au fil du temps, comme le stimulus n'a pas causé de dommages après l'exposition, leurs réactions de peur conditionnées déclinent. Cet apprentissage n'était pas apparent chez les souris GF ou traitées aux antibiotiques qui ont continué à montrer des réponses de peur conditionnées au fil du temps.
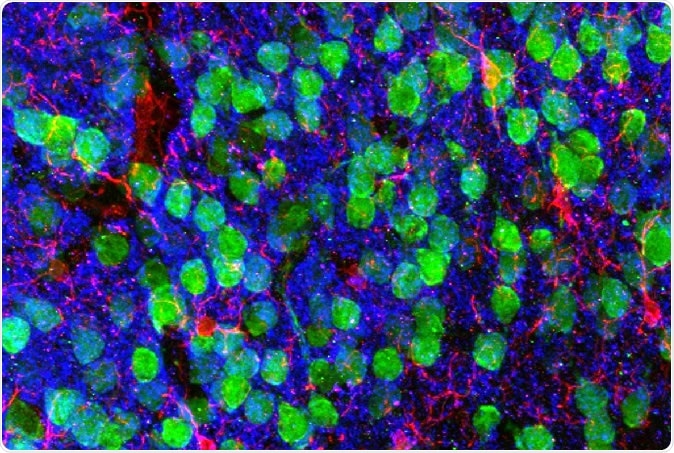 Imagerie du cerveau. Cortex préfrontal médial démontrant les neurones corticaux (vert), microglie (rouge), et le marqueur post-synaptique PSD95 (bleu). Image reproduite avec l'aimable autorisation des Drs. Christopher Parkhurst et David Artis (WCM).
Imagerie du cerveau. Cortex préfrontal médial démontrant les neurones corticaux (vert), microglie (rouge), et le marqueur post-synaptique PSD95 (bleu). Image reproduite avec l'aimable autorisation des Drs. Christopher Parkhurst et David Artis (WCM). Pour savoir pourquoi, les chercheurs ont séquencé l'ARN dans la microglie, les cellules immunitaires du cerveau. L'ARN est la molécule intermédiaire entre le modèle génétique dans le noyau et la protéine finale dans le cytoplasme, produit à partir du gène codé. Ainsi, une séquence d'ARN montre un gène exprimé dans cette cellule particulière.
Le séquençage de l'ARN a montré un modèle différent d'expression des gènes dans les cellules cérébrales de ces populations de souris, ce qui à son tour a affecté le remodelage normal qui se produit dans le cadre de l'apprentissage. Les cellules du cerveau forment des connexions ou des synapses pour transmettre des informations entre elles. Cependant, au fur et à mesure de l'apprentissage, certaines synapses sont supprimées et d'autres ajoutées, selon le trafic des impulsions le long de cette voie. C'est ce qu'on appelle l'élagage des synapses et c'est un processus important dans l'apprentissage.
En examinant les différences d'expression des gènes dans le cortex préfrontal médian du cerveau de souris, les scientifiques ont découvert que contrairement à la microglie chez les souris saines, ces microglies n'ont pas montré de changements de taille normaux, et cela à son tour réduit le nombre de nouvelles synapses qui se sont formées au cours d'une expérience d'apprentissage. Ce changement a eu un impact négatif sur leur capacité d'apprentissage.
Les épines dendritiques postsynaptiques n'étaient pas non plus remodelées normalement, et les neurones codant pour les signaux dans cette partie du cerveau n'ont pas montré des niveaux d'activité normaux. Avec la microglie, les neurones excitateurs et d'autres types de cellules cérébrales ont montré des changements similaires.
En outre, les chercheurs ont découvert qu'il y avait des changements dans les niveaux de quatre produits chimiques dans le cerveau des souris GF. Ces produits chimiques sont généralement associés à des maladies neuropsychiatriques telles que la schizophrénie et les troubles du spectre autistique. Les modifications de ces substances chimiques sont donc intimement liées à des altérations du fonctionnement cérébral, qui à son tour décide comment nous ressentons notre environnement et comment nous y répondons. Le fait qu'un microbiome intestinal altéré soit lié à quelque chose d'aussi fondamental que la chimie du cerveau est donc important pour démêler le modèle sous-jacent. Comme le dit le chercheur Frank Schroeder, « La chimie du cerveau détermine essentiellement comment nous nous sentons et réagissons à notre environnement, et les preuves s'accumulent que les produits chimiques dérivés des microbes intestinaux jouent un rôle majeur.
Passons à l'étape 3 - les chercheurs ont maintenant essayé de restaurer la capacité d'apprentissage normale chez les souris en remettant les organismes intestinaux pour remplacer ceux qui ont été perdus, dans le premier groupe, ou en transplantant des microbiomes normaux, dans la population GF. Ils ont réussi si le microbiome intestinal était restauré à la normale immédiatement après la naissance, les souris traitées présentant des schémas d'apprentissage normaux. D'autre part, le manque d'amélioration avec les interventions ultérieures suggère le besoin essentiel de signaux provenant d'un microbiome intestinal sain vers le cerveau en développement dès la naissance du bébé.
Le chercheur Conor Liston commente, "C'était une découverte intéressante, étant donné que de nombreuses affections psychiatriques associées aux maladies auto-immunes sont associées à des problèmes au cours du développement précoce du cerveau.
Le chercheur David Artis dit :« L'axe intestin-cerveau a un impact sur chaque être humain chaque jour de sa vie. Personne n'a encore compris comment les MII et d'autres affections gastro-intestinales chroniques influencent le comportement et la santé mentale. Notre étude apporte une nouvelle compréhension du fonctionnement des mécanismes.
L'élucidation de la façon dont la dysbiose intestinale affecte le fonctionnement du cerveau au niveau moléculaire et cellulaire sera, avec un peu de chance, accélérer l'identification de molécules ou de voies cibles pour traiter les humains affectés à l'avenir.
 La bave de poisson pourrait être une source potentielle d'antibiotiques selon une étude
La bave de poisson pourrait être une source potentielle d'antibiotiques selon une étude
 Les composés antiviraux dérivés des microalgues pourraient-ils combattre le SRAS-CoV-2 et d'autres virus ?
Les composés antiviraux dérivés des microalgues pourraient-ils combattre le SRAS-CoV-2 et d'autres virus ?
 Le café aide à développer des microbes intestinaux sains et facilite les selles
Le café aide à développer des microbes intestinaux sains et facilite les selles
 Les bactéries intestinales liées aux changements métaboliques et à l'autisme dans une nouvelle étude
Les bactéries intestinales liées aux changements métaboliques et à l'autisme dans une nouvelle étude
 Les hommes qui mangent du yaourt deux fois par semaine sont moins susceptibles de développer un cancer de l'intestin
Les hommes qui mangent du yaourt deux fois par semaine sont moins susceptibles de développer un cancer de l'intestin
 L'alcool endommage le microbiome de la bouche
L'alcool endommage le microbiome de la bouche
 Carte détaillée du microbiome de la langue humaine
Une nouvelle étude publiée dans la revue Rapports de cellule en mars 2020 rapporte lutilisation de techniques dimagerie spectrale avancées et rapides pour développer une carte détaillée des communau
Carte détaillée du microbiome de la langue humaine
Une nouvelle étude publiée dans la revue Rapports de cellule en mars 2020 rapporte lutilisation de techniques dimagerie spectrale avancées et rapides pour développer une carte détaillée des communau
 Les microbes intestinaux des guêpes aident à vaincre les pesticides
Une étude intrigante publiée en février 2020 dans la revue Hôte cellulaire et microbe rapporte que lorsque les guêpes sont exposées à latrazine, un pesticide couramment utilisé, le microbiome intest
Les microbes intestinaux des guêpes aident à vaincre les pesticides
Une étude intrigante publiée en février 2020 dans la revue Hôte cellulaire et microbe rapporte que lorsque les guêpes sont exposées à latrazine, un pesticide couramment utilisé, le microbiome intest
 Les préparations à base de lait de chèvre sont bonnes pour la santé intestinale des nourrissons
Des chercheurs du laboratoire du RMIT ont analysé le lait maternisé de chèvre et ont examiné les oligosaccharides quil contient. Ces sucres simples et les prébiotiques présents dans les préparations p
Les préparations à base de lait de chèvre sont bonnes pour la santé intestinale des nourrissons
Des chercheurs du laboratoire du RMIT ont analysé le lait maternisé de chèvre et ont examiné les oligosaccharides quil contient. Ces sucres simples et les prébiotiques présents dans les préparations p