Tarmmikrobiota påvirker måten mange kroppslige prosesser fungerer på, som immunfunksjon, normal metabolisme, og utviklingen av organismen. Det påvirker også oppførselen til verten, inkludert sosial aktivitet og stressresponser, som er forbundet med mange forskjellige lidelser i hjernen og/eller sinnet. Derimot, det er ikke mye kunnskap om de underliggende mekanismene som tarmbakterier kan endre måten hjernecellene fungerer på, eller oppførselen til den større organismen.
Tidligere forskning gir sterke indikasjoner på sammenhengen mellom tarmhelse og en rekke forskjellige sykdommer som ASD og posttraumatisk stresslidelse. Mange studier har vist at autoimmune sykdommer er knyttet til et unormalt tarmmikrobiom, og også til flere psykiatriske og nevrologiske tilstander. For eksempel, inflammatorisk tarmsykdom, multippel sklerose og psoriasis er alle sykdommer i autoimmunitet, og disse personene har en høyere risiko for å ha et lavere antall forskjellige tarmbakterier, samt større sjanse for angst, humørsykdommer og depresjon. Vanlige gener ser også ut til å være tilstede i både psykiatriske og autoimmune tilstander.
I denne undersøkelsen, forskerne så på hjernen til to typer mus med unormal tarmmikrobiota:mus som hadde fått antibiotika for å redusere bakterievekst i tarmen, eller mus som har blitt avlet i et totalt sterilt miljø for å være bakteriefrie (GF). De utsatte først disse musepopulasjonene for en fare, og fjernet den deretter. På å studere læringsresponsene i disse muspopulasjonene, de fant ut at begge viste en redusert evne til å lære at en fare som truet dem ikke lenger var fryktet (kalt fear extinction learning). Med andre ord, normale mus utvikler en refleks fryktrespons på en truet fare, men over tid da stimulansen ikke klarte å forårsake noen skade etter eksponering, deres betingede fryktrespons avtar. Denne læringen var ikke tydelig hos GF eller antibiotikabehandlede mus som fortsatte å vise betingede fryktresponser over tid.
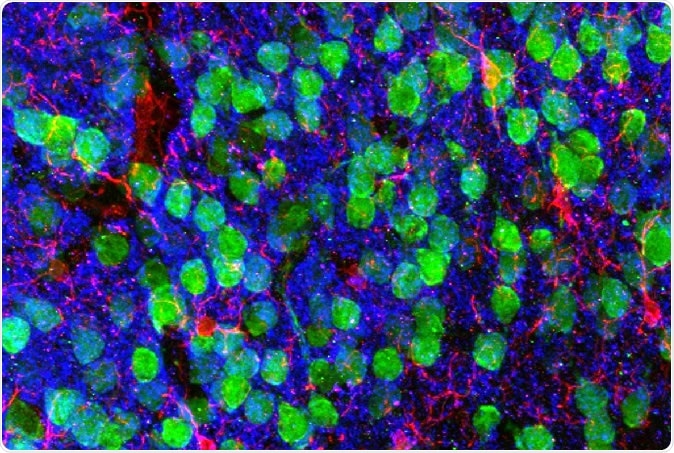 Imaging hjernen. Medial prefrontal cortex som demonstrerer kortikale nevroner (grønn), microglia (rød), og den postsynaptiske markøren PSD95 (blå). Bilde med lov av Dr. Christopher Parkhurst og David Artis (WCM).
Imaging hjernen. Medial prefrontal cortex som demonstrerer kortikale nevroner (grønn), microglia (rød), og den postsynaptiske markøren PSD95 (blå). Bilde med lov av Dr. Christopher Parkhurst og David Artis (WCM). For å finne ut hvorfor, forskerne sekvenserte RNA i mikroglia, hjernens immunceller. RNA er det mellomliggende molekylet mellom den genetiske planen i kjernen og det endelige proteinet i cytoplasma, produsert fra genet som er kodet. Således viser en RNA -sekvens et gen uttrykt i den aktuelle cellen.
RNA -sekvensering viste et annet mønster for genuttrykk i hjernecellene til disse muspopulasjonene, som igjen påvirket den normale ombyggingen som skjer som en del av læringen. Hjerneceller danner forbindelser eller synapser for å overføre informasjon seg imellom. Derimot, etter hvert som læringen fortsetter, visse synapser fjernes og andre legges til, i henhold til trafikken av impulser langs den stien. Dette kalles synapsbeskjæring og er en viktig prosess i læring.
Ved å undersøke forskjellene i genuttrykk i den mediale prefrontale cortex i musens hjerne, forskerne oppdaget at i motsetning til mikroglia hos friske mus, disse mikroglia viste ikke normale beskjæringsendringer, og dette reduserte igjen antall nye synapser som ble dannet under en læringsopplevelse. Denne endringen påvirket deres evne til å lære negativt.
Postsynaptiske dendrittiske pigger ble heller ikke ombygd normalt, og cue-kodende nevroner i denne delen av hjernen klarte ikke å vise normale aktivitetsnivåer. Sammen med microglia, eksitatoriske nevroner og andre hjernecelletyper viste lignende endringer.
I tillegg, forskerne fant at det var endringer i nivået av fire kjemikalier i hjernen til GF -musene. Disse kjemikaliene er vanligvis forbundet med nevropsykiatriske sykdommer som schizofreni og autismespekterforstyrrelse. Endringer i disse kjemikaliene er derfor nært knyttet til endringer i hjernens funksjon, som igjen avgjør hvordan vi fornemmer omgivelsene våre og hvordan vi reagerer på dem. Det faktum at et endret tarmmikrobiom er knyttet til noe så grunnleggende som hjernekjemi, er derfor viktig for å avdekke det underliggende mønsteret. Som forsker Frank Schroeder sier, "Hjernekjemi bestemmer i hovedsak hvordan vi føler og reagerer på miljøet vårt, og bevis bygger på at kjemikalier avledet fra tarmmikrober spiller en stor rolle. "
Videre til trinn 3 - forskerne prøvde nå å gjenopprette normal læringskapasitet hos mus ved å sette tilbake tarmorganismer for å erstatte de som gikk tapt, i den første gruppen, eller ved å transplantere normale mikrobiomer, i GF -befolkningen. De lyktes hvis tarmmikrobiomet ble gjenopprettet til det normale umiddelbart etter fødselen, med de behandlede musene som viser normale læringsmønstre. På den andre siden, den manglende forbedringen med senere inngrep antyder det vesentlige behovet for signaler fra et sunt tarmmikrobiom til hjernen som utvikler seg så snart babyen er født.
Forsker Conor Liston kommenterer, "Dette var et interessant funn, gitt at mange psykiatriske tilstander som er forbundet med autoimmun sykdom, er forbundet med problemer under tidlig hjerneutvikling. "
Forsker David Artis sier, "Tarm-hjerne-aksen påvirker hvert eneste menneske hver dag i livet. Ingen har ennå forstått hvordan IBD og andre kroniske gastrointestinale tilstander påvirker atferd og mental helse. Studien vår gir en ny forståelse av hvordan mekanismene fungerer. ”
Avklaringen av måten tarmdysbiose påvirker hjernens funksjon på molekylært og cellulært nivå vil, forhåpentligvis, fremskynde identifiseringen av målmolekyler eller veier for å behandle berørte mennesker i fremtiden.
 Gå videre,
Gå videre,
 Bruk FLUOstar Omega til å studere nye tarmbakterier som kan påvirke helsen vår
Bruk FLUOstar Omega til å studere nye tarmbakterier som kan påvirke helsen vår
 Høydepunkter og viktige takeaways fra Boston Bacterial Meeting i 2019 (BBM)
Høydepunkter og viktige takeaways fra Boston Bacterial Meeting i 2019 (BBM)
 Ny forskning identifiserer en kobling mellom tarmmikrobiomet og slag
Ny forskning identifiserer en kobling mellom tarmmikrobiomet og slag
 GSK-3-hemmere viser løfte om behandling av koronavirusinfeksjoner
GSK-3-hemmere viser løfte om behandling av koronavirusinfeksjoner
 Genetisk risiko for autoimmunitet kan være knyttet til forskjeller i tarmmikrobiomet
Genetisk risiko for autoimmunitet kan være knyttet til forskjeller i tarmmikrobiomet
 Apoptose er en viktig formidler av patogenese ved infeksjon av koronavirus fra dyr
Apoptose er en form for programmert celledød, som forekommer i celler som er uopprettelig skadet eller i celler infisert av noen virus. Denne mekanismen er ekstremt viktig for å begrense virusets repl
Apoptose er en viktig formidler av patogenese ved infeksjon av koronavirus fra dyr
Apoptose er en form for programmert celledød, som forekommer i celler som er uopprettelig skadet eller i celler infisert av noen virus. Denne mekanismen er ekstremt viktig for å begrense virusets repl
 RNA -sekvensering gir ny innsikt i mikrobiomet
Forskere ved University of Chicago har kommet med en revolusjonerende strategi for å studere aktiviteten til tarmmikrobiomet-ved å bruke sekvensering av tRNA med høy gjennomstrømning. Alp
RNA -sekvensering gir ny innsikt i mikrobiomet
Forskere ved University of Chicago har kommet med en revolusjonerende strategi for å studere aktiviteten til tarmmikrobiomet-ved å bruke sekvensering av tRNA med høy gjennomstrømning. Alp
 Gode nyheter for IBS -lider da forskere identifiserer "tarmkløe"
Flinders University -forskere ved South Australian Health and Medical Research Institute har gjort en viktig oppdagelse om smerten som oppstår i tilfeller av irritabel tarmsyndrom (IBS). Bi
Gode nyheter for IBS -lider da forskere identifiserer "tarmkløe"
Flinders University -forskere ved South Australian Health and Medical Research Institute har gjort en viktig oppdagelse om smerten som oppstår i tilfeller av irritabel tarmsyndrom (IBS). Bi