De darmflora beïnvloedt de manier waarop veel lichaamsprocessen functioneren, zoals immuunfunctie, normale stofwisseling, en de ontwikkeling van het organisme. Het beïnvloedt ook het gedrag van de gastheer, inclusief sociale activiteit en stressreacties, die worden geassocieerd met veel verschillende aandoeningen van de hersenen en/of de geest. Echter, er is niet veel kennis van de onderliggende mechanismen waardoor darmbacteriën de manier waarop de hersencellen functioneren kunnen veranderen, of het gedrag van het grotere organisme.
Eerder onderzoek geeft sterke aanwijzingen voor het verband tussen darmgezondheid en een reeks ziekten die zo verschillend zijn als ASS en posttraumatische stressstoornis. Veel onderzoeken hebben aangetoond dat auto-immuunziekten verband houden met een abnormaal darmmicrobioom, en ook voor verschillende psychiatrische en neurologische aandoeningen. Bijvoorbeeld, inflammatoire darmziekte, multiple sclerose en psoriasis zijn allemaal aandoeningen van auto-immuniteit, en deze personen hebben een hoger risico op een lager aantal verschillende darmbacteriën, evenals een grotere kans op angst, stemmingsstoornissen en depressie. Gemeenschappelijke genen lijken ook aanwezig te zijn in zowel psychiatrische als auto-immuunziekten.
In de huidige studie, de wetenschappers keken naar de hersenen van twee soorten muizen met abnormale darmflora:muizen die antibiotica hadden gekregen om de bacteriegroei in de darm te verminderen, of muizen die in een volledig steriele omgeving zijn gefokt om kiemvrij te zijn (GF). Ze stelden deze muizenpopulaties eerst bloot aan gevaar, en daarna verwijderd. Bij het bestuderen van de leerreacties in deze muispopulaties, ze ontdekten dat beide een verminderd vermogen vertoonden om te leren dat een gevaar dat hen bedreigde niet langer gevreesd hoefde te worden (angstuitdovingsleren genoemd). Met andere woorden, normale muizen ontwikkelen een reflex-angstreactie op een dreigend gevaar, maar na verloop van tijd, aangezien de stimulus na blootstelling geen schade aanrichtte, hun geconditioneerde angstreacties nemen af. Dit leren was niet duidelijk bij de met GF of antibiotica behandelde muizen die in de loop van de tijd geconditioneerde angstreacties bleven vertonen.
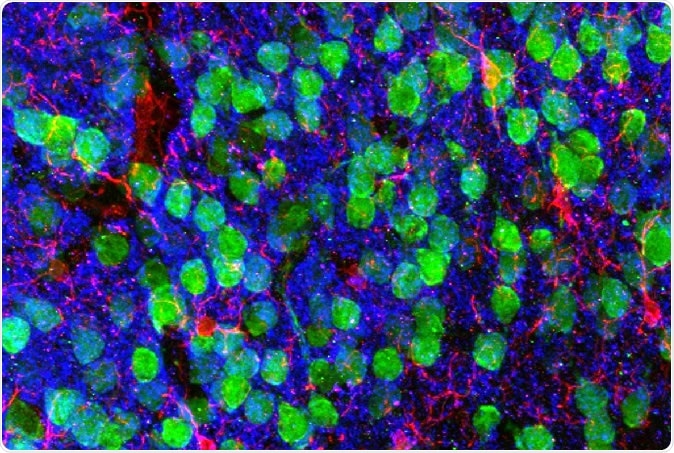 De hersenen in beeld brengen. Mediale prefrontale cortex met corticale neuronen (groen), microglia (rood), en de postsynaptische marker PSD95 (blauw). Afbeelding met dank aan Drs. Christopher Parkhurst en David Artis (WCM).
De hersenen in beeld brengen. Mediale prefrontale cortex met corticale neuronen (groen), microglia (rood), en de postsynaptische marker PSD95 (blauw). Afbeelding met dank aan Drs. Christopher Parkhurst en David Artis (WCM). Om erachter te komen waarom, de onderzoekers hebben het RNA in microglia gesequenced, de immuuncellen van de hersenen. RNA is het intermediaire molecuul tussen de genetische blauwdruk in de kern en het uiteindelijke eiwit in het cytoplasma, geproduceerd uit het gen dat wordt gecodeerd. Een RNA-sequentie toont dus een gen dat in die bepaalde cel tot expressie wordt gebracht.
RNA-sequencing toonde een ander patroon van genexpressie in de hersencellen van deze muizenpopulaties, wat op zijn beurt de normale hermodellering beïnvloedde die plaatsvindt als onderdeel van leren. Hersencellen vormen verbindingen of synapsen om informatie onderling door te geven. Echter, naarmate het leren vordert, bepaalde synapsen worden verwijderd en andere toegevoegd, volgens het verkeer van impulsen langs dat pad. Dit wordt synapssnoei genoemd en is een belangrijk leerproces.
Bij het onderzoeken van de verschillen in genexpressie in de mediale prefrontale cortex van de muizenhersenen, ontdekten de wetenschappers dat, in tegenstelling tot microglia bij gezonde muizen, deze microglia vertoonden geen normale snoeiveranderingen, en dit verminderde op zijn beurt het aantal nieuwe synapsen dat tijdens een leerervaring werd gevormd. Deze verandering had een negatief effect op hun leervermogen.
Postsynaptische dendritische stekels werden ook niet normaal geremodelleerd, en cue-coderende neuronen in dit deel van de hersenen vertoonden geen normale activiteitsniveaus. Samen met microglia, excitatoire neuronen en andere hersenceltypes vertoonden vergelijkbare veranderingen.
In aanvulling, de onderzoekers ontdekten dat er veranderingen waren in de niveaus van vier chemicaliën in de hersenen van de GF-muizen. Deze chemicaliën worden meestal geassocieerd met neuropsychiatrische ziekten zoals schizofrenie en autismespectrumstoornissen. Veranderingen in deze chemicaliën zijn daarom nauw verbonden met veranderingen in het functioneren van de hersenen, die op zijn beurt bepaalt hoe we onze omgeving voelen en hoe we erop reageren. Het feit dat een veranderd darmmicrobioom is gekoppeld aan zoiets fundamenteels als hersenchemie, is daarom belangrijk bij het ontrafelen van het onderliggende patroon. Zoals onderzoeker Frank Schroeder zegt:"Hersenchemie bepaalt in wezen hoe we ons voelen en reageren op onze omgeving, en er is steeds meer bewijs dat chemicaliën die zijn afgeleid van darmmicroben een belangrijke rol spelen.”
Op naar fase 3 - de onderzoekers probeerden nu het normale leervermogen bij muizen te herstellen door darmorganismen terug te plaatsen om de verloren gegane organismen te vervangen. in de eerste groep, of door normale microbiomen te transplanteren, in de GF-populatie. Ze slaagden erin als het darmmicrobioom onmiddellijk na de geboorte weer normaal werd, waarbij de behandelde muizen normale leerpatronen vertoonden. Anderzijds, het gebrek aan verbetering met latere interventies suggereert de essentiële behoefte aan signalen van een gezond darmmicrobioom naar de zich ontwikkelende hersenen zodra de baby wordt geboren.
Onderzoeker Conor Liston merkt op, “Dit was een interessante bevinding, gezien het feit dat veel psychiatrische aandoeningen die verband houden met auto-immuunziekten geassocieerd zijn met problemen tijdens de vroege hersenontwikkeling.
Onderzoeker David Artis zegt:"De darm-hersen-as heeft elke dag van zijn leven invloed op elk mens. Niemand heeft tot nu toe begrepen hoe IBD en andere chronische gastro-intestinale aandoeningen het gedrag en de geestelijke gezondheid beïnvloeden. Onze studie biedt een nieuw inzicht in hoe de mechanismen werken.”
De opheldering van de manier waarop darmdysbiose het functioneren van de hersenen op moleculair en cellulair niveau beïnvloedt, zal, Hopelijk, versnelt de identificatie van doelmoleculen of routes om getroffen mensen in de toekomst te behandelen.
 Microben op de tong kunnen worden gebruikt om alvleesklierkanker te diagnosticeren
Microben op de tong kunnen worden gebruikt om alvleesklierkanker te diagnosticeren
 Huishoudelijke ontsmettingsmiddelen kunnen bijdragen aan het risico op obesitas bij kinderen
Huishoudelijke ontsmettingsmiddelen kunnen bijdragen aan het risico op obesitas bij kinderen
 Afslankmiddel Wegovy goedgekeurd door FDA
Afslankmiddel Wegovy goedgekeurd door FDA
 Darmbacteriën in wespen helpen pesticiden te overwinnen
Darmbacteriën in wespen helpen pesticiden te overwinnen
 Apoptose is een belangrijke mediator van pathogenese bij dierlijk coronavirusinfectie
Apoptose is een belangrijke mediator van pathogenese bij dierlijk coronavirusinfectie
 Vaginale vloeistoftransplantatie kan helpen terugkerende bacteriële vaginose te behandelen
Vaginale vloeistoftransplantatie kan helpen terugkerende bacteriële vaginose te behandelen
 Hoe helpen gastheerfactoren zoals het longmicrobioom bij SARS-CoV‐2-infectie?
Ernstig acuut respiratoir syndroom coronavirus 2 (SARS-CoV-2) is een RNA-virus dat behoort tot het geslacht Coronaviridae en het subgenus betacoronavirus. Het is de nieuwe en zeer besmettelijke ziekte
Hoe helpen gastheerfactoren zoals het longmicrobioom bij SARS-CoV‐2-infectie?
Ernstig acuut respiratoir syndroom coronavirus 2 (SARS-CoV-2) is een RNA-virus dat behoort tot het geslacht Coronaviridae en het subgenus betacoronavirus. Het is de nieuwe en zeer besmettelijke ziekte
 Groeiproblemen bij premature baby's geassocieerd met veranderde darmbacteriën
Premature babys die niet groeien zoals verwacht of gedijen, kunnen problemen hebben met de ontwikkeling van hun microbioom, suggereert een nieuwe studie. Een team van onderzoekers van het Ann &Rober
Groeiproblemen bij premature baby's geassocieerd met veranderde darmbacteriën
Premature babys die niet groeien zoals verwacht of gedijen, kunnen problemen hebben met de ontwikkeling van hun microbioom, suggereert een nieuwe studie. Een team van onderzoekers van het Ann &Rober
 Nieuwe computationele modelleringsmethode voorspelt hoe darmmicroben in de loop van de tijd veranderen
Een nieuwe computationele modelleringsmethode maakt gebruik van momentopnamen van welke soorten microben in de darm van een persoon worden gevonden om te voorspellen hoe de microbiële gemeenschap in d
Nieuwe computationele modelleringsmethode voorspelt hoe darmmicroben in de loop van de tijd veranderen
Een nieuwe computationele modelleringsmethode maakt gebruik van momentopnamen van welke soorten microben in de darm van een persoon worden gevonden om te voorspellen hoe de microbiële gemeenschap in d