La microbiota intestinal influye en la forma en que funcionan muchos procesos corporales, como la función inmunológica, metabolismo normal, y el desarrollo del organismo. También afecta el comportamiento del anfitrión, incluyendo la actividad social y las respuestas al estrés, que están asociados con muchos trastornos diferentes del cerebro y / o la mente. Sin embargo, No hay mucho conocimiento de los mecanismos subyacentes por los cuales las bacterias intestinales pueden cambiar la forma en que funcionan las células del cerebro. o el comportamiento del organismo más grande.
Investigaciones anteriores proporcionan fuertes indicios del vínculo entre la salud intestinal y una variedad de enfermedades tan diferentes como el TEA y el trastorno de estrés postraumático. Muchos estudios han demostrado que las enfermedades autoinmunes están relacionadas con un microbioma intestinal anormal, y también a varias condiciones psiquiátricas y neurológicas. Por ejemplo, Enfermedad inflamatoria intestinal, la esclerosis múltiple y la psoriasis son todos trastornos de la autoinmunidad, y estas personas tienen un mayor riesgo de tener un menor número de diversas bacterias intestinales, así como mayores probabilidades de ansiedad, trastornos del estado de ánimo y depresión. Los genes comunes también parecen estar presentes tanto en afecciones psiquiátricas como autoinmunes.
En el presente estudio, los científicos observaron los cerebros de dos tipos de ratones con microbiota intestinal anormal:ratones que habían recibido antibióticos para reducir el crecimiento bacteriano en el intestino, o ratones que han sido criados en un ambiente totalmente estéril para estar libres de gérmenes (GF). Primero expusieron a estas poblaciones de ratones a un peligro, y luego lo retiró. Al estudiar las respuestas de aprendizaje en estas poblaciones de ratones, encontraron que ambos mostraban una menor capacidad para aprender que un peligro que los amenazaba ya no era temible (llamado aprendizaje de la extinción del miedo). En otras palabras, los ratones normales desarrollan una respuesta refleja de miedo a un peligro amenazado, pero con el tiempo, como el estímulo no produjo ningún daño después de la exposición, sus respuestas condicionadas de miedo declinan. Este aprendizaje no fue evidente en los ratones tratados con GF o con antibióticos que continuaron mostrando respuestas de miedo condicionadas a lo largo del tiempo.
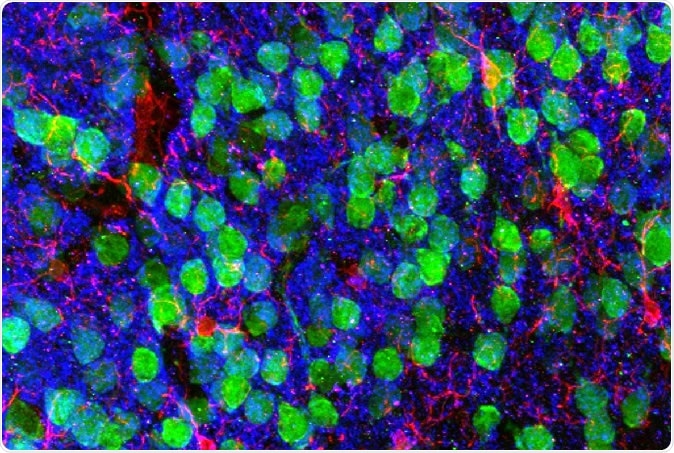 Imágenes del cerebro. Corteza prefrontal medial que muestra neuronas corticales (verde), microglia (rojo), y el marcador postsináptico PSD95 (azul). Imagen cortesía de los Dres. Christopher Parkhurst y David Artis (WCM).
Imágenes del cerebro. Corteza prefrontal medial que muestra neuronas corticales (verde), microglia (rojo), y el marcador postsináptico PSD95 (azul). Imagen cortesía de los Dres. Christopher Parkhurst y David Artis (WCM). Para averiguar por qué los investigadores secuenciaron el ARN dentro de la microglía, las células inmunes del cerebro. El ARN es la molécula intermedia entre el modelo genético en el núcleo y la proteína final en el citoplasma. producido a partir del gen codificado. Por tanto, una secuencia de ARN muestra un gen expresado en esa célula en particular.
La secuenciación de ARN mostró un patrón diferente de expresión génica en las células cerebrales de estas poblaciones de ratones, lo que a su vez afectó la remodelación normal que ocurre como parte del aprendizaje. Las células del cerebro forman conexiones o sinapsis para pasar información entre ellas. Sin embargo, a medida que avanza el aprendizaje, se eliminan ciertas sinapsis y se agregan otras, según el tráfico de impulsos a lo largo de ese camino. Esto se llama poda de sinapsis y es un proceso importante en el aprendizaje.
Al examinar las diferencias en la expresión génica en la corteza prefrontal medial del cerebro del ratón, los científicos descubrieron que, a diferencia de la microglía en ratones sanos, estas microglías no mostraron cambios de poda normales, y esto, a su vez, redujo el número de nuevas sinapsis que se formaron durante una experiencia de aprendizaje. Este cambio afectó negativamente su capacidad de aprendizaje.
Las espinas dendríticas postsinápticas tampoco se remodelaron normalmente, y las neuronas que codifican señales en esta parte del cerebro no lograron mostrar niveles normales de actividad. Junto con la microglia, las neuronas excitadoras y otros tipos de células cerebrales mostraron cambios similares.
Además, los investigadores encontraron que había cambios en los niveles de cuatro sustancias químicas en el cerebro de los ratones GF. Estos productos químicos se asocian típicamente con enfermedades neuropsiquiátricas como la esquizofrenia y el trastorno del espectro autista. Por lo tanto, los cambios en estos productos químicos están íntimamente relacionados con alteraciones en el funcionamiento del cerebro, que a su vez decide cómo sentimos nuestro entorno y cómo respondemos a ellos. El hecho de que un microbioma intestinal alterado esté relacionado con algo tan fundamental como la química cerebral es, por tanto, significativo para desentrañar el patrón subyacente. Como dice el investigador Frank Schroeder, "La química del cerebro determina esencialmente cómo nos sentimos y respondemos a nuestro entorno, y se están acumulando pruebas de que los productos químicos derivados de los microbios intestinales desempeñan un papel importante ".
En la etapa 3:los investigadores ahora intentaron restaurar la capacidad de aprendizaje normal en ratones volviendo a colocar organismos intestinales para reemplazar los que se perdieron. en el primer grupo, o trasplantando microbiomas normales, en la población GF. Tuvieron éxito si el microbioma intestinal se restauraba a la normalidad inmediatamente después del nacimiento, con los ratones tratados mostrando patrones de aprendizaje normales. Por otra parte, la falta de mejora con intervenciones posteriores sugiere la necesidad esencial de señales de un microbioma intestinal sano al cerebro en desarrollo tan pronto como nazca el bebé.
El investigador Conor Liston comenta:"Este fue un hallazgo interesante, dado que muchas afecciones psiquiátricas que están asociadas con enfermedades autoinmunes están asociadas con problemas durante el desarrollo temprano del cerebro ".
El investigador David Artis dice:“El eje intestino-cerebro impacta a todos los seres humanos todos los días de sus vidas. Nadie ha entendido todavía cómo la EII y otras afecciones gastrointestinales crónicas influyen en el comportamiento y la salud mental. Nuestro estudio proporciona una nueva comprensión de cómo funcionan los mecanismos ".
La elucidación de la forma en que la disbiosis intestinal afecta el funcionamiento del cerebro a nivel molecular y celular, Ojalá, acelerar la identificación de moléculas o vías diana para tratar a los seres humanos afectados en el futuro.
 Colitis ulcerosa y falta de microbio en el intestino
Colitis ulcerosa y falta de microbio en el intestino
 Es poco probable que los perros domésticos transmitan el SARS-CoV-2,
Es poco probable que los perros domésticos transmitan el SARS-CoV-2,
 La resistencia a los antibióticos se duplica en solo dos décadas
La resistencia a los antibióticos se duplica en solo dos décadas
 Adelante,
Adelante,
 Los científicos desarrollan péptidos que restablecen el equilibrio en las bacterias intestinales y revierten la aterosclerosis
Los científicos desarrollan péptidos que restablecen el equilibrio en las bacterias intestinales y revierten la aterosclerosis
 El microbioma intestinal no saludable reduce la poda sináptica del cerebro,
El microbioma intestinal no saludable reduce la poda sináptica del cerebro,
 El nuevo receptor de macrófagos súper activador podría explicar la hiperinflamación en el COVID-19 grave
La inmunidad es algo curioso. Si bien es esencial para proteger el cuerpo contra patógenos invasores y antígenos extraños, también puede volverse contra el cuerpo y desencadenar procesos inmunológicos
El nuevo receptor de macrófagos súper activador podría explicar la hiperinflamación en el COVID-19 grave
La inmunidad es algo curioso. Si bien es esencial para proteger el cuerpo contra patógenos invasores y antígenos extraños, también puede volverse contra el cuerpo y desencadenar procesos inmunológicos
 Los investigadores encuentran una nueva forma de protegerse contra la enfermedad en el modelo de EM
Investigadores del Brigham and Womens Hospital han encontrado una forma nueva e inesperada de prevenir enfermedades en un modelo preclínico de esclerosis múltiple (EM). Haber de imagen:Ligh
Los investigadores encuentran una nueva forma de protegerse contra la enfermedad en el modelo de EM
Investigadores del Brigham and Womens Hospital han encontrado una forma nueva e inesperada de prevenir enfermedades en un modelo preclínico de esclerosis múltiple (EM). Haber de imagen:Ligh
 ¿Las etiquetas de los productos comerciales de kéfir informan correctamente los niveles microbianos?
El microbioma intestinal es una parte esencial del organismo humano, como ha quedado muy claro a partir de muchas investigaciones realizadas durante las últimas décadas. La Asociación Científica Inter
¿Las etiquetas de los productos comerciales de kéfir informan correctamente los niveles microbianos?
El microbioma intestinal es una parte esencial del organismo humano, como ha quedado muy claro a partir de muchas investigaciones realizadas durante las últimas décadas. La Asociación Científica Inter