TIISTAI, 22. syyskuuta 2015 (HealthDay News) – Yhdysvaltain elintarvike- ja lääkevirasto on hyväksynyt Lonsurf-yhdistelmäpillerit (trifluridiini ja tipirasiili) pitkälle edenneen paksusuolensyövän hoitoon ihmisille, jotka eivät reagoi muihin hoitoihin, virasto. sanoi tiistaina lehdistötiedotteessa.
Paksusuolisyöpä on kolmanneksi yleisin ei-ihosyövän aiheuttaja Yhdysvalloissa, FDA sanoi viitaten Yhdysvaltain kansalliseen syöpäinstituuttiin. Se on edelleen toiseksi yleisin syöpäkuolemien syy keuhkosyövän jälkeen, vaikka määrät ovatkin laskeneet, osittain lisääntyneen taudin seulonnan vuoksi.
Lonsurfia arvioitiin kliinisissä tutkimuksissa, joihin osallistui noin 800 ihmistä, joilla oli aiemmin hoidettu pitkälle edennyt paksusuolen syöpä. Lonsurfia käyttäneet elivät keskimäärin yli 7 kuukautta, kun taas lumelääkettä saaneiden 5,3 kuukautta.
Lääkkeen yleisimpiä sivuvaikutuksia ovat anemia, infektioita torjuvien valkosolujen määrän väheneminen, verihiutaleiden määrän lasku, heikkous, väsymys, pahoinvointi, ruokahaluttomuus, ripuli, vatsakipu ja kuume.
Koska verisolujen ja verihiutaleiden tuotanto voi laskea vakavasti, lääkäreitä kehotetaan testaamaan käyttäjien verta ennen kunkin hoitojakson alkua, FDA sanoi. Lääkäreitä kehotetaan myös varoittamaan hedelmällisessä iässä olevia naisia mahdollisista haitoista kehittyville sikiöille. Ja Lonsurfia käyttävät naiset eivät saa imettää, virasto varoitti.
Lonsurfin tuottaa Princeton, N.J.-pohjainen Taiho Oncology.
-- Scott Roberts

Tekijänoikeus © 2015 HealthDay. Kaikki oikeudet pidätetään.
 Mitä tietää Pepcidistä (famotidiini)
Pepcid (famotidiini) on lääke, jota käytetään närästyksen, ruoansulatushäiriöiden ja maha-suolikanavan (GI) haavaumien hoitoon lapsilla ja aikuisilla. Pepcid vähentää mahalaukun (ruoansulatuskanavan)
Mitä tietää Pepcidistä (famotidiini)
Pepcid (famotidiini) on lääke, jota käytetään närästyksen, ruoansulatushäiriöiden ja maha-suolikanavan (GI) haavaumien hoitoon lapsilla ja aikuisilla. Pepcid vähentää mahalaukun (ruoansulatuskanavan)
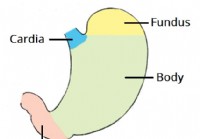 Vatsa
1 anatominen asento 2 anatominen rakenne 2.1 Vatsan jaot 2.2 Suuremmat ja pienemmät kaarevat 3 anatomista suhdetta 4 mahalaukun sulkijalihasta 4.1 Ruokatorven alasulkijalihas 4.2 Pylorinen sulkijal
Vatsa
1 anatominen asento 2 anatominen rakenne 2.1 Vatsan jaot 2.2 Suuremmat ja pienemmät kaarevat 3 anatomista suhdetta 4 mahalaukun sulkijalihasta 4.1 Ruokatorven alasulkijalihas 4.2 Pylorinen sulkijal
 Mitä hyötyä probioottien käytöstä on?
Mikä on suoliston mikrobiomi? Ruoansulatusjärjestelmä sisältää biljoonia hyödyllisiä bakteereja. Probioottien käytön etuja ovat ruuansulatuksen paraneminen, suun terveys ja emättimen terveys. Jos
Mitä hyötyä probioottien käytöstä on?
Mikä on suoliston mikrobiomi? Ruoansulatusjärjestelmä sisältää biljoonia hyödyllisiä bakteereja. Probioottien käytön etuja ovat ruuansulatuksen paraneminen, suun terveys ja emättimen terveys. Jos