 Рак толстой кишки является третьей по значимости причиной рака в США
Рак толстой кишки является третьей по значимости причиной рака в СШАПризнаки и симптомы рака толстой кишки, как правило, неспецифичны. Другими словами, признаки и симптомы могут возникать из-за ряда различных состояний. Когда рак толстой кишки обнаруживается на ранних стадиях, он может даже не вызывать симптомов. Симптомы также могут различаться в зависимости от конкретного участка толстой кишки, где находится опухоль.
Некоторые симптомы и признаки рака толстой кишки:

Каждый день в нашем организме происходит массовый процесс разрушения и восстановления. Тело человека состоит примерно из 15 триллионов клеток, и каждый день миллиарды клеток изнашиваются или разрушаются. В большинстве случаев каждый раз, когда клетка разрушается, организм создает новую клетку, чтобы заменить ее, пытаясь создать клетку, являющуюся точной копией клетки, которая была разрушена, потому что замещающая клетка должна быть способна выполнять ту же функцию, что и исходная. разрушенная клетка. Во время сложного процесса замены ячеек возникает множество ошибок. Несмотря на наличие удивительно элегантных систем предотвращения ошибок, организм по-прежнему ежедневно совершает десятки тысяч ошибок при замене клеток либо из-за случайных ошибок, либо из-за внешнего давления на процесс замены, которое способствует ошибкам. Большинство этих ошибок исправляются дополнительными элегантными системами или же ошибка приводит к гибели вновь созданной клетки, и получается еще одна нормальная новая клетка. Однако иногда ошибаются и не исправляют. Многие из неисправленных ошибок мало влияют на здоровье, но если ошибка позволяет новообразованной клетке делиться независимо от сдержек и противовесов, контролирующих нормальный рост клетки, эта клетка может начать размножаться неконтролируемым образом. Когда это происходит, может развиться опухоль (по сути, масса аномальных клеток).
Опухоли делятся на две категории:доброкачественные (нераковые) опухоли и злокачественные (раковые) опухоли. Так в чем же разница? Ответ заключается в том, что доброкачественная опухоль растет только в той ткани, из которой она возникает. Доброкачественные опухоли иногда могут расти довольно большими или быстро и вызывать серьезные симптомы, вплоть до смерти, хотя в большинстве случаев этого не происходит. Например, миома матки у женщины относится к типу доброкачественных опухолей. Он может вызвать кровотечение или боль, но он никогда не выйдет за пределы матки и не вырастет в виде новой опухоли в другом месте. Фибромы, как и все доброкачественные опухоли, не способны выделять клетки в кровь и лимфатическую систему, поэтому они не могут перемещаться в другие места тела и расти. С другой стороны, рак может выделять клетки, которые могут перемещаться по кровеносной или лимфатической системе, приземляясь в тканях, удаленных от первичной опухоли, и превращаясь в новые опухоли в этих отдаленных тканях. Этот процесс распространения в отдаленные ткани, называемый метастазированием, является определяющей характеристикой раковой или злокачественной опухоли.
Доброкачественные опухолевые клетки часто выглядят относительно нормальными при исследовании под микроскопом. Злокачественные или раковые клетки обычно выглядят более ненормально, если рассматривать их под микроскопом.
Рак — это группа из более чем 100 различных заболеваний, очень похожих на инфекционные заболевания. Раки называются по тканям, из которых возникает первая опухоль. Следовательно, рак легкого, который перемещается в печень, не является раком печени, а описывается как рак легких с метастазами в печень, а рак молочной железы, который распространяется в головной мозг, описывается не как опухоль головного мозга, а скорее как рак молочной железы с метастазами в печень. головной мозг. Каждый рак — это отдельное заболевание с разными вариантами лечения и разными прогнозами (вероятными исходами или ожидаемой продолжительностью жизни). На самом деле каждый человек с раком имеет уникальное заболевание, и относительный успех или отсутствие лечения у пациентов с одним и тем же диагнозом может сильно различаться. В результате важно относиться к каждому человеку с диагнозом «рак» индивидуально, независимо от типа рака.
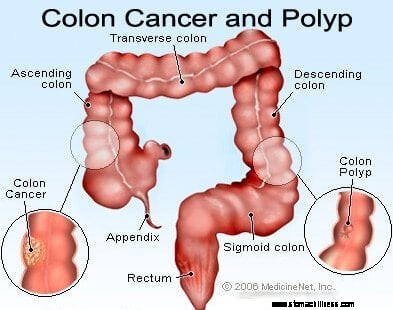 Изображение рака толстой кишки (колоректального).
Изображение рака толстой кишки (колоректального).
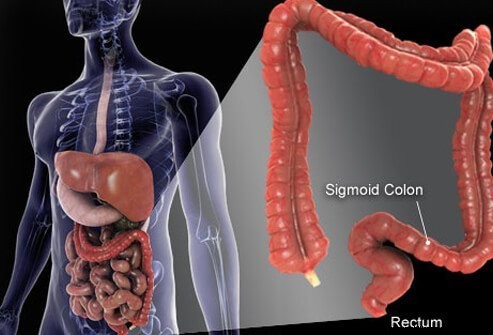
Толстая кишка и прямая кишка являются конечными частями трубки, которая простирается от рта до ануса. Пища попадает в рот, где она пережевывается, а затем проглатывается. Затем он проходит через пищевод и попадает в желудок. В желудке пища измельчается на более мелкие частицы, а затем тщательно контролируемым образом попадает в тонкую кишку. В тонком кишечнике происходит окончательное переваривание пищи и всасывание питательных веществ, содержащихся в пище. Пища, которая не переваривается и не всасывается, поступает в толстую кишку (толстую кишку) и, наконец, в прямую кишку. Толстая кишка действует в первую очередь как хранилище отходов; однако дополнительная вода, соли и некоторые витамины удаляются дополнительно. Кроме того, часть непереваренной пищи, например клетчатка, переваривается кишечными бактериями, а часть продуктов пищеварения всасывается из толстой кишки в организм. (Подсчитано, что 10% энергии, получаемой с пищей, поступает из этих продуктов бактериального пищеварения в толстой кишке.) Оставшаяся непереваренная пища, умирающие клетки слизистой оболочки кишечника и большое количество бактерий хранятся в толстой кишке и затем периодически переходили в прямую кишку. Их попадание в прямую кишку инициирует дефекацию, которая выводит содержимое толстой кишки из организма в виде стула.
Хотя толстая кишка представляет собой трубку, по своей структуре она представляет собой сложную трубку, больше похожую на радиальную шину со стальным ремнем, чем на садовый шланг. Трубка состоит из четырех слоев. Первый представляет собой внутренний слой клеток, выстилающих полость, через которую проходит непереваренная и перевариваемая пища, называемую слизистой оболочкой. Слизистая оболочка прикреплена к тонкому второму слою, подслизистому, который прикрепляется к мышечному слою, musculis. Вся трубка окружена фиброзной (рубцовой) тканью, называемой серозной оболочкой. Наиболее распространенные виды рака толстой кишки (тип, называемый аденокарциномой) возникают из слизистой оболочки, внутреннего слоя клеток. Эти клетки подвергаются воздействию токсинов из пищи и бактерий, а также механического износа, и они относительно быстро обновляются (отмирают и заменяются). Ошибки (обычно серия ошибок, связанных с генами в замещающих клетках) приводят к аномальным клеткам и неконтролируемой пролиферации аномальных клеток, которые вызывают рак. Быстрый оборот позволяет совершать больше ошибок по сравнению с тканями, которые не так быстро обновляются (например, тканью печени).
Большая часть толстой кишки находится внутри полости в брюшной полости, называемой брюшной полостью. Части толстой кишки способны достаточно свободно перемещаться в брюшной полости по мере прохождения через нее непереваренной пищи. Когда толстая кишка направляется к прямой кишке, она прикрепляется к тканям за брюшной полостью, областью, называемой забрюшинным пространством. Конечная часть толстой кишки, часть, которая находится в забрюшинном пространстве, называется прямой кишкой. В отличие от большей части остальной части толстой кишки, прямая кишка фиксируется окружающими ее тканями. Из-за его локализации лечение рака прямой кишки часто отличается от лечения рака остальной части толстой кишки.
 Изображение поперечного сечения толстой кишки.
Изображение поперечного сечения толстой кишки. 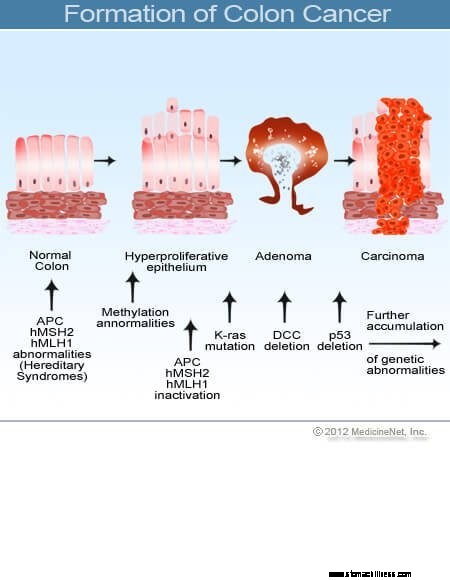 Изображение образования рака толстой кишки.
Изображение образования рака толстой кишки.
Толстая кишка человека (толстая кишка) имеет длину около 6 футов.
Рак толстой и прямой кишки (колоректальный рак) начинается, когда нарушается процесс нормального замещения клеток слизистой оболочки толстой кишки. Ошибки в делении клеток происходят часто. По малопонятным причинам иногда возникают ошибки, которые ускользают от наших систем редактирования. Когда это происходит, эти клетки начинают делиться независимо от обычных сдержек и противовесов, которые контролируют рост. По мере того, как эти аномальные клетки растут и делятся, они могут привести к образованию полипов в толстой кишке. Полипы различаются по типу, но многие из них являются предраковыми опухолями, которые медленно растут в течение многих лет и не распространяются. По мере роста полипов дополнительные генетические мутации еще больше дестабилизируют клетки. Когда эти предраковые опухоли меняют направление (прорастают в стенку трубы, а не в пространство в ее середине) и проникают в другие слои толстой кишки (например, в подслизистый слой или мышечный слой), предраковый полип становится раковым. В большинстве случаев этот процесс протекает медленно, требуется не менее восьми-десяти лет, чтобы превратиться из этих ранних аберрантных клеток в явный рак. Колоректальный рак обычно представляет собой аденокарциному, термин, который относится к раку, который сформировался в определенных типах слизистых тканей в организме.
Как только колоректальный рак формируется, он начинает расти двумя путями. Во-первых, рак может расти локально и распространяться через стенку кишечника и проникать в соседние структуры, что делает массу (называемую первичной опухолью) более серьезной проблемой, которую труднее удалить. Местное расширение может вызвать дополнительные симптомы, такие как боль или чувство полноты, перфорация толстой кишки или закупорка толстой кишки или близлежащих структур. Во-вторых, по мере роста рака начинается процесс метастазирования, когда тысячи клеток ежедневно попадают в кровь и лимфатическую систему, что может привести к образованию рака в отдаленных местах. Колоректальный рак чаще всего сначала распространяется на местные лимфатические узлы, а затем переходит в отдаленные органы. После поражения местных лимфатических узлов метастазы распространяются на печень, брюшную полость и легкие.
Колоректальный рак является третьей наиболее распространенной причиной рака в США как у мужчин, так и у женщин. Он поражает более 135 000 человек ежегодно, что составляет 8% всех случаев рака. Около 4,3 % людей в какой-то момент жизни диагностируют рак толстой или прямой кишки.
Нажимая "Отправить", я соглашаюсь с Условиями и положениями MedicineNet и Политикой конфиденциальности. Я также согласен получать электронные письма от MedicineNet и понимаю, что могу отказаться от подписки на MedicineNet в любое время.
Медицинские работники уверены, что колоректальный рак не заразен (человек не может заразиться от больного раком). Некоторые люди более склонны к развитию колоректального рака, чем другие. Факторы, повышающие риск развития колоректального рака, включают пожилой возраст, афроамериканскую расу, высокое потребление жиров, колоректальный рак и полипы в семейном анамнезе, наличие полипов в толстой кишке и воспалительные заболевания кишечника, в первую очередь хронический язвенный колит.
Пожилой возраст является основным фактором риска колоректального рака. Около 90 % случаев колоректального рака диагностируют после 50 лет.
У афроамериканцев заболеваемость колоректальным раком выше, чем у представителей других рас.
Многочисленные исследования показали, что диеты с высоким содержанием жиров предрасполагают людей к колоректальному раку. В странах с высоким уровнем заболеваемости колоректальным раком потребление жиров населением намного выше, чем в странах с низким уровнем заболеваемости раком. Считается, что переваривание жира, происходящее в тонком и толстом кишечнике, приводит к образованию вызывающих рак химических веществ (канцерогенов). Кроме того, научные исследования также показывают, что диеты с высоким содержанием овощей и продуктов с высоким содержанием клетчатки, таких как цельнозерновой хлеб и крупы, содержат меньше жира, который производит эти канцерогены и может противодействовать воздействию канцерогенов. Оба эффекта помогут снизить риск развития рака.
Исследования показали, что большинство случаев колоректального рака развиваются в колоректальных полипах. Следовательно, удаление доброкачественных (но предраковых) колоректальных полипов может предотвратить колоректальный рак. Предраковые колоректальные полипы чаще всего называют аденоматозными полипами. Они развиваются при хромосомном повреждении клеток внутренней оболочки толстой кишки. Повреждение производит аномальные клетки, но клетки еще не развили способность распространяться, что является отличительной чертой рака. Вместо этого растущая ткань остается локализованной внутри полипа. Когда внутри полипа хромосомные повреждения усиливаются, рост клеток становится неконтролируемым, и клетки начинают распространяться, то есть становятся раковыми. Таким образом, изначально доброкачественные полипы толстой кишки приобретают дополнительные хромосомные повреждения и становятся раковыми.
Хронический язвенный колит вызывает воспаление внутренней оболочки толстой кишки. Рак кишечника является признанным осложнением хронического язвенного колита. Риск рака начинает увеличиваться после восьми-десяти лет колита. Риск развития рака толстой кишки у пациента с язвенным колитом также зависит от локализации и степени его или ее заболевания.
Пациенты с повышенным риском развития рака — это пациенты с семейным анамнезом рака толстой кишки, длительным течением язвенного колита, обширным поражением толстой кишки язвенным колитом, а также пациенты с заболеваниями печени, связанными с язвенным колитом, склерозирующим холангитом.
Поскольку рак, связанный с неспецифическим язвенным колитом, имеет более благоприятный исход при обнаружении на более ранней стадии, часто рекомендуются ежегодные обследования толстой кишки после восьми лет известного распространенного заболевания. Во время этих обследований берутся образцы ткани (биопсия) для поиска предраковых изменений в клетках, выстилающих толстую кишку. При обнаружении предраковых изменений может потребоваться удаление всей толстой кишки для предотвращения рака толстой кишки.
Генетический фон человека является важным фактором риска развития рака толстой кишки. Наличие родственника первой степени родства с колоректальным раком, особенно если рак был диагностирован в возрасте до 55 лет, примерно удваивает риск развития заболевания.
Несмотря на то, что семейный анамнез рака толстой кишки является важным фактором риска, большинство (80%) случаев рака толстой кишки возникают спорадически у пациентов без семейного анамнеза рака толстой кишки. Приблизительно 20 % случаев рака связаны с семейным анамнезом рака толстой кишки.
Хромосомы содержат генетическую информацию, а хромосомные повреждения вызывают генетические дефекты, которые приводят к образованию полипов толстой кишки, а затем и рака толстой кишки. При спорадических полипах и раке (полипы и раки, развивающиеся при отсутствии семейного анамнеза) хромосомные повреждения приобретаются (развиваются в клетке во взрослом возрасте). Поврежденные хромосомы можно найти только в полипах и раковых образованиях, которые развиваются из этой клетки. Но при наследственных синдромах рака толстой кишки хромосомные дефекты наследуются при рождении и присутствуют в каждой клетке организма. Пациенты, унаследовавшие гены синдрома наследственного рака толстой кишки, подвержены риску развития полипов толстой кишки, обычно в молодом возрасте, и имеют очень высокий риск развития рака толстой кишки в раннем возрасте; они также подвержены риску развития рака других органов.
Семейный аденоматозный полипоз (САП) является одним из наследственных синдромов колоректального рака, при котором у пораженных членов семьи развивается бесчисленное количество (сотни, иногда тысячи) полипов толстой кишки, начиная с подросткового возраста. Если это состояние не будет обнаружено и вылечено на ранней стадии (лечение включает удаление толстой кишки), у человека, пораженного FAP, почти наверняка разовьется рак толстой кишки из-за этих полипов. Рак почти наверняка развивается к тому времени, когда человеку исполняется 40 лет. Эти пациенты также подвержены риску развития других видов рака, таких как рак щитовидной железы, желудка и ампулы (часть желчного протока, где он впадает в тонкую кишку из печени), а также доброкачественные опухоли, называемые десмоидными опухолями. FAP возникает в результате мутации в определенном гене, называемом геном APC. Специфическую мутацию можно выявить у большинства людей с помощью соответствующего тестирования, и такое тестирование рекомендуется лицам с диагнозом САП, а также членам их семей.
Ослабленный семейный аденоматозный полипоз (AFAP) является более мягкой версией FAP. У пораженных членов развивается менее 100 полипов толстой кишки. Тем не менее, они по-прежнему подвержены очень высокому риску развития рака толстой кишки в молодом возрасте. Они также подвержены риску возникновения полипов желудка и полипов двенадцатиперстной кишки.
Наследственный неполипозный рак толстой кишки (также известный как синдром Линча или HNPCC) это наследственный синдром колоректального рака, при котором у пострадавших членов семьи могут развиваться полипы и рак толстой кишки, обычно в правой части толстой кишки, в возрасте от 30 до 40 лет. Пациенты с HNPCC также подвержены риску развития рака матки, рака желудка, рака яичников и рака мочеточников (трубочек, соединяющих почки с мочевым пузырем) и желчных протоков. По иронии судьбы, похоже, что, хотя рак толстой кишки чаще встречается у пациентов с HNPCC, эти виды рака легче вылечить, чем «спорадические» виды рака толстой кишки. Были идентифицированы специфические генетические аномалии, связанные с HNPCC, и пациенты и члены их семей могут пройти тестирование, чтобы определить, присутствует ли HNPCC и есть ли у членов семьи аномалия и вероятность развития рака.
Синдром полипоза MYH Недавно открытый наследственный синдром колоректального рака. У пострадавших обычно развивается от 10 до 100 полипов в возрасте около 40 лет, и они подвержены высокому риску развития рака толстой кишки. Здесь также была выявлена генетическая аномалия.
Важно помнить, что в подавляющем большинстве случаев колоректального рака нет ни одной идентифицируемой хромосомной аномалии, которую можно искать у родственников, чтобы выявить лиц с риском развития колоректального рака.
Симптомы, связанные с колоректальным раком, многочисленны и неспецифичны. Они включают утомляемость, слабость, одышку, изменение характера стула, узкий стул, диарею или запор, красную или темную кровь в стуле, потерю веса, боль в животе, спазмы или вздутие живота. Другие состояния, такие как синдром раздраженного кишечника (спастическая толстая кишка), язвенный колит, болезнь Крона, дивертикулез и язвенная болезнь, могут иметь симптомы, имитирующие рак кишечника.
Колоректальный рак может присутствовать в течение нескольких лет, прежде чем появятся симптомы. Симптомы варьируются в зависимости от того, где в толстой кишке расположена опухоль. Правая кишка шире и более гибкая. Его даже можно назвать относительно просторным по сравнению с остальной частью толстой кишки. Рак правой половины толстой кишки может вырасти до больших размеров, прежде чем он вызовет какие-либо абдоминальные симптомы. Как правило, правосторонний рак вызывает железодефицитную анемию из-за медленной потери крови в течение длительного периода времени. Железодефицитная анемия вызывает усталость, слабость и одышку. Левая кишка уже правой. Таким образом, рак левой половины толстой кишки чаще вызывает частичную или полную кишечную непроходимость. Рак, вызывающий частичную непроходимость кишечника, может вызывать такие симптомы, как запор, сужение стула, диарею, боли в животе, спазмы и вздутие живота. Ярко-красная кровь в кале также может указывать на опухоль в конце левого отдела толстой или прямой кишки.
При подозрении на рак толстой кишки обычно проводится колоноскопия, чтобы подтвердить диагноз и определить местонахождение опухоли.
Колоноскопия — это процедура, при которой медицинский работник вводит в прямую кишку длинную гибкую трубку для осмотра с целью осмотра внутренней части всей толстой кишки. Колоноскопия обычно считается более точной, чем рентгенография с бариевой клизмой, особенно при обнаружении небольших полипов. Если обнаруживаются полипы толстой кишки, их обычно удаляют через колоноскоп и отправляют к патологоанатому. Патолог исследует полипы под микроскопом на наличие рака. Колоноскопия — лучшая процедура для использования при подозрении на рак толстой кишки. Хотя большинство полипов, удаленных с помощью колоноскопа, являются доброкачественными, многие из них являются предраковыми. Удаление предраковых полипов предотвращает развитие рака толстой кишки из этих полипов в будущем.
Ректороманоскопия — это процедура, выполняемая с использованием более короткого гибкого эндоскопа для осмотра только левых отделов толстой и прямой кишки. К ней легче подготовиться и выполнить, чем к полной колоноскопии, но она имеет очевидные ограничения в плане недостаточной продолжительности для оценки как правой, так и поперечной ободочной кишки. Удаление полипов и биопсию рака можно выполнить с помощью сигмоидоскопа.
Если во время колоноскопии обнаруживаются раковые новообразования, можно получить небольшие образцы ткани (биопсии) и исследовать их под микроскопом, чтобы определить, является ли полип злокачественным. Если рак толстой кишки подтверждается биопсией, проводятся стадирующие исследования, чтобы определить, распространился ли рак уже на другие органы. Поскольку колоректальный рак имеет тенденцию распространяться на легкие и печень, стадирующие тесты обычно включают компьютерную томографию легких, печени и брюшной полости. Позитронно-эмиссионная томография (ПЭТ) — более новый тест, который выявляет повышенную метаболическую активность, характерную для раковой ткани, — также часто используется для выявления распространения рака толстой кишки на лимфатические узлы или другие органы.
Иногда медицинский работник может получить анализ крови на онкомаркер, называемый раково-эмбриональным антигеном (СЕА), если есть подозрение на рак. CEA представляет собой вещество, вырабатываемое некоторыми раковыми клетками толстой и прямой кишки, а также некоторыми другими видами рака. Иногда его высокие уровни обнаруживаются у пациентов с колоректальным раком, особенно при распространении заболевания. Он может служить полезным тестом, если будет обнаружено, что он повышен до удаления рака. Однако не у всех пациентов с колоректальным раком будет повышен уровень СЕА, даже если их рак распространился. (Некоторые виды колоректального рака не вызывают его.) Кроме того, некоторые пациенты без рак может иметь повышенный анализ крови CEA. Например, около 15% курильщиков будут иметь повышенный уровень СЕА без рака толстой кишки. Таким образом, РЭА используется не для диагностики колоректального рака, а скорее для наблюдения за эффектами лечения колоректального рака у людей с известным анамнезом заболевания, потому что, опять же, у некоторых пациентов количество раковой ткани коррелирует с уровнем РЭА.
При диагностировании колоректального рака проводятся дополнительные анализы для определения степени заболевания. Этот процесс называется стадированием. Стадия определяет, насколько запущенным стал колоректальный рак. Стадия колоректального рака варьируется от стадии I (наименее запущенный рак) до стадии IV (самый запущенный рак).
С каждой последующей стадией рака толстой кишки повышается риск рецидива рака и смерти вследствие распространения рака (метастазирования). Как уже отмечалось, более ранние формы рака имеют более низкий риск рецидива и смерти. К тому времени, когда у человека развивается колоректальный рак IV стадии, прогноз неблагоприятный. Однако даже при колоректальном раке IV стадии (в зависимости от того, куда распространился рак) существует возможность излечения.
Хирургия является наиболее распространенным начальным лечением колоректального рака. Во время операции удаляют опухоль, небольшой край окружающей здоровой кишки и прилежащие лимфатические узлы. Затем хирург повторно соединяет здоровые участки кишечника. У пациентов с ректальным раком прямую кишку иногда удаляют навсегда, если рак возникает слишком низко в прямой кишке. Затем хирург создает отверстие (колостому) на брюшной стенке, через которое выводятся твердые отходы из толстой кишки. Специально обученные медсестры (энтеростомические терапевты) могут помочь пациентам приспособиться к колостоме, и большинство пациентов с колостомией возвращаются к нормальному образу жизни.
Для раннего рака кишечника рекомендуемое лечение — хирургическое удаление. Для большинства людей с раком толстой кишки на ранней стадии (стадия I и большинство стадии II) требуется только хирургическое вмешательство. Химиотерапия может быть предложена некоторым людям с раком II стадии, у которых есть факторы, указывающие на то, что их опухоль может подвергаться более высокому риску рецидива. Однако, как только рак толстой кишки распространился на местные лимфатические узлы (стадия III), риск рецидива рака остается высоким, даже если хирург удалил все видимые признаки рака. Это связано с повышенной вероятностью того, что крошечные раковые клетки могли ускользнуть до операции и слишком малы, чтобы их можно было обнаружить в это время с помощью анализов крови, сканирования или даже прямого обследования. Их наличие обусловлено более высоким риском рецидива рака толстой кишки в более поздние сроки (рецидив). Врачи-онкологи (медицинские онкологи) рекомендуют дополнительное лечение рака толстой кишки химиотерапией в этих условиях, чтобы снизить риск рецидива рака. Лекарства, используемые для химиотерапии, попадают в кровоток и атакуют любые раковые клетки толстой кишки, которые попали в кровь или лимфатическую систему до операции, пытаясь убить их, прежде чем они обосноваются в других органах. Было доказано, что эта стратегия, называемая адъювантной химиотерапией, снижает риск рецидива рака и рекомендуется для всех пациентов с раком толстой кишки III стадии, которые достаточно здоровы, чтобы пройти ее, а также для некоторых пациентов с более высоким риском II стадии, у которых опухоль может быть была обнаружена непроходимость или перфорация стенки кишечника до операции.
Существует несколько различных вариантов адъювантной химиотерапии для лечения рака толстой кишки. Лечение включает комбинацию химиотерапевтических препаратов, вводимых перорально или внутривенно. Лечение обычно проводится в течение шести месяцев. Важно встретиться с онкологом, который может объяснить варианты адъювантной химиотерапии, а также побочные эффекты, на которые следует обратить внимание, чтобы можно было сделать правильный выбор для каждого пациента.
Химиотерапия обычно проводится в клинике медицинского работника, в больнице амбулаторно или дома. Химиотерапия обычно проводится циклами лечения, за которыми следуют периоды восстановления без лечения. Побочные эффекты химиотерапии варьируются от человека к человеку, а также зависят от вводимых агентов. Современные химиотерапевтические агенты обычно хорошо переносятся, а побочные эффекты у большинства людей поддаются лечению. Как правило, противораковые препараты разрушают клетки, которые быстро растут и делятся. Поэтому нормальные эритроциты, тромбоциты и лейкоциты, которые также быстро растут, могут быть затронуты химиотерапией. В результате общие побочные эффекты включают анемию, потерю энергии и низкую устойчивость к инфекциям. Клетки корней волос и кишечника также быстро делятся. Таким образом, химиотерапия может вызвать выпадение волос, язвы во рту, тошноту, рвоту и диарею, но эти эффекты преходящи.
Как только колоректальный рак распространился далеко от места первичной опухоли, он описывается как заболевание IV стадии. Эти отдаленные опухолевые отложения, отделившиеся от первичной опухоли, прошли через кровь или лимфатическую систему, образуя новые опухоли в других органах. В этот момент колоректальный рак больше не является локальной проблемой, а представляет собой системную проблему с раковыми клетками, видимыми при сканировании и не обнаруживаемыми, но, вероятно, присутствующими в других частях тела. В результате в большинстве случаев лучшим лечением является химиотерапия, то есть системная терапия. Доказано, что химиотерапия при метастатическом колоректальном раке продлевает жизнь и улучшает ее качество. При правильном лечении побочные эффекты химиотерапии, как правило, намного меньше, чем побочные эффекты неконтролируемого рака. Сама по себе химиотерапия не может вылечить метастатический рак толстой кишки, но она может более чем удвоить ожидаемую продолжительность жизни и обеспечить хорошее качество жизни во время лечения.
Варианты химиотерапии для лечения колоректального рака варьируются в зависимости от других проблем со здоровьем, с которыми сталкивается человек. Для более здоровых людей обычно рекомендуются комбинации нескольких химиотерапевтических препаратов, тогда как для более больных людей лучше всего подходят более простые методы лечения. В различных схемах лечения сочетаются препараты с доказанной активностью при колоректальном раке, такие как 5-фторурацил (5-ФУ), который часто назначают вместе с препаратом лейковорином (также называемым фолиновой кислотой) или аналогичным препаратом под названием леволейковорин, который помогает ему работать лучше. /Р>
Капецитабин (Кселода) — химиотерапевтический препарат в форме таблеток. Попадая в организм, он превращается в 5-ФУ, когда попадает в место опухоли. Другими химиотерапевтическими препаратами для колоректального рака являются иринотекан (Камптозар), оксалиплатин (Элоксатин) и трифлуридин и типирацил (Лонсурф), комбинированный препарат в форме таблеток. Chemotherapy regimens often have acronyms to simplify their nomenclature (such as FOLFOX, FOLFIRI, and FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 7 простых в приготовлении блюд при СИБР, которые можно приготовить этой зимой
7 простых блюд сибо, которые можно приготовить этой зимой Снижение температуры говорит нам о том, что пришло время снова представить классические зимние рецепты на нашей кухне. В самом деле, когда на
7 простых в приготовлении блюд при СИБР, которые можно приготовить этой зимой
7 простых блюд сибо, которые можно приготовить этой зимой Снижение температуры говорит нам о том, что пришло время снова представить классические зимние рецепты на нашей кухне. В самом деле, когда на
 Что такое шелуха подорожника:руководство по преимуществам и побочным эффектам волокна подорожника
шелуха псиллиума — это растворимая клетчатка, которая поддерживает здоровье пищеварительной системы. Также известный как испагула, псиллиум помогает облегчить диарею, запор, синдром раздраженного кише
Что такое шелуха подорожника:руководство по преимуществам и побочным эффектам волокна подорожника
шелуха псиллиума — это растворимая клетчатка, которая поддерживает здоровье пищеварительной системы. Также известный как испагула, псиллиум помогает облегчить диарею, запор, синдром раздраженного кише
 Ленивое обжаривание говядины
Быстрый семейный ужин может быть вкуснее ресторанного, если вы уделите несколько минут маринованию мяса перед его приготовлением. Попробуйте этот рецепт жареной говядины, и вы получите взрыв вкуса! Я
Ленивое обжаривание говядины
Быстрый семейный ужин может быть вкуснее ресторанного, если вы уделите несколько минут маринованию мяса перед его приготовлением. Попробуйте этот рецепт жареной говядины, и вы получите взрыв вкуса! Я