 Darmkanker is de derde belangrijkste oorzaak van kanker in de VS
Darmkanker is de derde belangrijkste oorzaak van kanker in de VSTekenen en symptomen van darmkanker zijn meestal niet specifiek. Met andere woorden, de tekenen en symptomen kunnen optreden als gevolg van een aantal verschillende aandoeningen. Wanneer darmkanker in een vroeg stadium wordt ontdekt, heeft het misschien niet eens symptomen veroorzaakt. Symptomen kunnen ook variëren afhankelijk van de specifieke locatie in de dikke darm waar de tumor zich bevindt.
Enkele symptomen en tekenen van darmkanker zijn:

Elke dag vindt er in ons lichaam een enorm proces van vernietiging en herstel plaats. Het menselijk lichaam bestaat uit ongeveer 15 biljoen cellen, en elke dag miljarden van cellen verslijten of worden vernietigd. In de meeste gevallen maakt het lichaam elke keer dat een cel wordt vernietigd een nieuwe cel om deze te vervangen, in een poging een cel te maken die een perfecte kopie is van de cel die werd vernietigd, omdat de vervangende cel in staat moet zijn om dezelfde functie uit te voeren als de cel. vernietigde cel. Tijdens het complexe proces van het vervangen van cellen treden veel fouten op. Ondanks opmerkelijk elegante systemen om fouten te voorkomen, maakt het lichaam nog steeds dagelijks tienduizenden fouten bij het vervangen van cellen, hetzij vanwege willekeurige fouten, hetzij omdat er druk van buitenaf wordt uitgeoefend op het vervangingsproces die fouten bevordert. De meeste van deze fouten worden gecorrigeerd door extra elegante systemen of de fout leidt tot de dood van de nieuw gemaakte cel, en een andere normale nieuwe cel wordt geproduceerd. Soms wordt er echter een fout gemaakt en niet gecorrigeerd. Veel van de niet-gecorrigeerde fouten hebben weinig effect op de gezondheid, maar als de fout ervoor zorgt dat de nieuw gemaakte cel zich kan delen, onafhankelijk van de checks and balances die de normale celgroei beheersen, kan die cel zich op een ongecontroleerde manier gaan vermenigvuldigen. Wanneer dit gebeurt, kan zich een tumor (in wezen een massa abnormale cellen) ontwikkelen.
Tumoren vallen in twee categorieën:er zijn goedaardige (niet-kankerachtige) tumoren en kwaadaardige (kankerachtige) tumoren. Dus wat is het verschil? Het antwoord is dat een goedaardige tumor alleen groeit in het weefsel waaruit hij voortkomt. Goedaardige tumoren kunnen soms behoorlijk groot of snel groeien en ernstige symptomen veroorzaken, zelfs de dood, hoewel de meeste dat niet doen. Een vleesboomtumor in de baarmoeder van een vrouw is bijvoorbeeld een soort goedaardige tumor. Het kan bloedingen of pijn veroorzaken, maar het zal nooit buiten de baarmoeder reizen en ergens anders als een nieuwe tumor groeien. Vleesbomen hebben, net als alle goedaardige tumoren, niet het vermogen om cellen in het bloed en het lymfestelsel af te scheiden, dus kunnen ze niet naar andere plaatsen in het lichaam reizen en groeien. Aan de andere kant kan een kankercel cellen afstoten die door het bloed of het lymfestelsel kunnen reizen, in weefsels ver van de primaire tumor terechtkomen en in deze verre weefsels uitgroeien tot nieuwe tumoren. Dit proces van verspreiding naar verre weefsels, metastase genaamd, is het bepalende kenmerk van een kankergezwel of kwaadaardige tumor.
Goedaardige tumorcellen zien er vaak relatief normaal uit wanneer ze onder de microscoop worden onderzocht. Kwaadaardige of kankercellen zien er gewoonlijk meer abnormaal uit als ze op dezelfde manier onder de microscoop worden bekeken.
Kanker is een groep van meer dan 100 verschillende ziekten, vergelijkbaar met infectieziekten. Kankers worden genoemd naar de weefsels waaruit de eerste tumor ontstaat. Daarom is een longkanker die zich naar de lever verplaatst geen leverkanker, maar wordt deze beschreven als longkanker die uitgezaaid is naar de lever, en een borstkanker die zich uitbreidt naar de hersenen wordt niet beschreven als een hersentumor, maar eerder als borstkanker metastatisch naar de lever. brein. Elke kanker is een andere ziekte met verschillende behandelingsopties en verschillende prognoses (waarschijnlijke uitkomsten of levensverwachting). In feite heeft elk individu met kanker een unieke ziekte, en het relatieve succes of gebrek daaraan bij patiënten met dezelfde diagnose kan heel verschillend zijn. Daarom is het belangrijk om elke persoon met de diagnose kanker als een individu te behandelen, ongeacht het type kanker.
 Afbeelding van (darm)kanker.
Afbeelding van (darm)kanker.
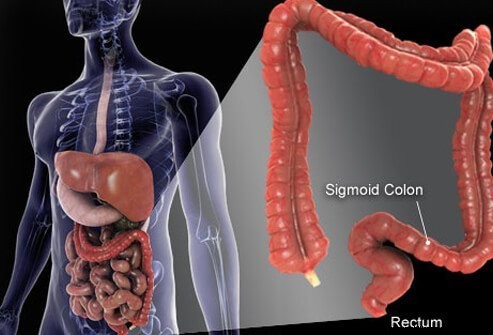
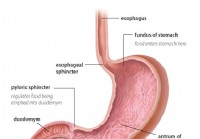
De dikke darm en het rectum zijn de laatste delen van de buis die zich uitstrekt van de mond tot de anus. Voedsel komt de mond binnen waar het wordt gekauwd en vervolgens wordt ingeslikt. Het reist dan door de slokdarm en in de maag. In de maag wordt het voedsel vermalen tot kleinere deeltjes en komt het vervolgens op een zorgvuldig gecontroleerde manier in de dunne darm. In de dunne darm vindt de uiteindelijke vertering van voedsel en opname van de voedingsstoffen in het voedsel plaats. Het voedsel dat niet wordt verteerd en geabsorbeerd, komt in de dikke darm (colon) en uiteindelijk in het rectum. De dikke darm fungeert vooral als opslagplaats voor afvalstoffen; extra water, zouten en sommige vitamines worden echter verder verwijderd. Bovendien wordt een deel van het onverteerde voedsel, bijvoorbeeld vezels, verteerd door darmbacteriën en worden sommige van de verteringsproducten vanuit de dikke darm en in het lichaam opgenomen. (Geschat wordt dat 10% van de energie die uit voedsel wordt gehaald, afkomstig is van deze producten van bacteriële vertering in de dikke darm.) Het resterende onverteerde voedsel, stervende cellen van het slijmvlies van de darmen en grote aantallen bacteriën worden opgeslagen in de dikke darm en dan periodiek overgegaan in het rectum. Hun aankomst in het rectum initieert een stoelgang die de inhoud van de dikke darm als ontlasting uit het lichaam leegt.
Hoewel de dikke darm een buis is, is het structureel een gecompliceerde buis, meer als een radiaalband met stalen gordel dan een tuinslang. De buis bestaat uit vier lagen. De eerste is een binnenlaag van cellen die de holte bekleden waardoor het onverteerde en verterende voedsel reist, het slijmvlies genoemd. Het slijmvlies is bevestigd aan een dunne tweede laag, de submucosa, die zich vastmaakt aan een spierlaag, de muscularis. De hele buis is omgeven door vezelig (littekenachtig) weefsel dat de serosa wordt genoemd. De meest voorkomende kankers van de dikke darm (het type dat adenocarcinoom wordt genoemd) komen voort uit het slijmvlies, de binnenste laag van cellen. Deze cellen worden blootgesteld aan gifstoffen uit voedsel en bacteriën, evenals mechanische slijtage, en ze draaien relatief snel om (afsterven en worden vervangen). Fouten (meestal een reeks fouten waarbij genen in de vervangende cellen betrokken zijn) leiden tot abnormale cellen en ongecontroleerde proliferatie van de abnormale cellen die kanker veroorzaken. Door de snelle omzet kunnen er meer fouten optreden in vergelijking met weefsels die niet zo snel omdraaien (bijvoorbeeld leverweefsel).
Het grootste deel van de dikke darm rust in een holte in de buik die de peritoneale holte wordt genoemd. Delen van de dikke darm kunnen vrij vrij bewegen in de buikholte terwijl het onverteerde voedsel er doorheen gaat. Terwijl de dikke darm naar het rectum gaat, wordt deze gefixeerd aan de weefsels achter de peritoneale holte, een gebied dat het retroperitoneum wordt genoemd. Het eindgedeelte van de dikke darm, het deel dat zich in het retroperitoneum bevindt, is het rectum. In tegenstelling tot veel van de rest van de dikke darm, wordt het rectum op zijn plaats gefixeerd door de weefsels eromheen. Vanwege de locatie is de behandeling van rectumkanker vaak anders dan de behandeling van kanker van de rest van de dikke darm.
 Afbeelding van een dwarsdoorsnede van de dikke darm.
Afbeelding van een dwarsdoorsnede van de dikke darm. 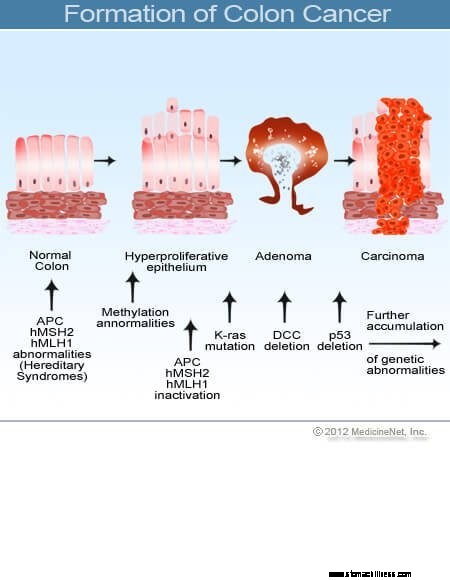 Foto van de vorming van darmkanker.
Foto van de vorming van darmkanker.
De menselijke dikke darm (colon) is ongeveer 1,80 meter lang.
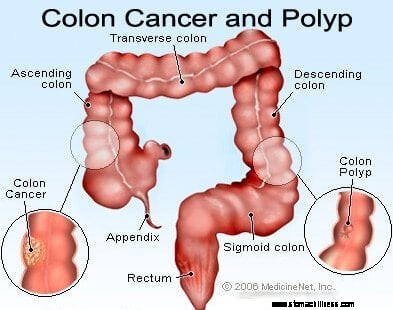
Kankers van de dikke darm en het rectum (darmkanker) beginnen wanneer het proces van de normale vervanging van de cellen van de colonbekleding misgaat. Fouten bij de celdeling komen vaak voor. Om redenen die slecht worden begrepen, treden er soms fouten op die aan onze bewerkingssystemen ontsnappen. Wanneer dit gebeurt, beginnen deze cellen zich te delen, onafhankelijk van de normale controlemechanismen die de groei beheersen. Naarmate deze abnormale cellen groeien en delen, kunnen ze leiden tot gezwellen in de dikke darm, poliepen genaamd. Poliepen variëren in type, maar veel zijn precancereuze tumoren die in de loop van de jaren langzaam groeien en zich niet verspreiden. Naarmate poliepen groeien, destabiliseren aanvullende genetische mutaties de cellen verder. Wanneer deze precancereuze tumoren van richting veranderen (groeien in de wand van de buis in plaats van in de ruimte in het midden ervan) en andere lagen van de dikke darm binnendringen (zoals de submucosa of spierlaag), is de precancereuze poliep kanker geworden. In de meeste gevallen is dit proces traag en duurt het minstens acht tot tien jaar om zich van die vroege afwijkende cellen tot een openhartige kanker te ontwikkelen. Colorectale kanker is meestal een adenocarcinoom, een term die verwijst naar een kanker die zich heeft gevormd in bepaalde soorten bekledingsweefsels in het lichaam.
Zodra een colorectale kanker zich vormt, begint deze op twee manieren te groeien. Ten eerste kan de kanker lokaal groeien en zich door de darmwand uitbreiden en aangrenzende structuren binnendringen, waardoor de massa (de primaire tumor) een groter probleem wordt en moeilijker te verwijderen is. Lokale extensie kan extra symptomen veroorzaken, zoals pijn of volheid, perforatie van de dikke darm of blokkades van de dikke darm of nabijgelegen structuren. Ten tweede, naarmate de kanker groeit, begint het proces van metastase, waarbij duizenden cellen per dag in het bloed en het lymfestelsel worden afgestoten, waardoor zich op verre locaties kanker kan vormen. Colorectale kankers verspreiden zich meestal eerst naar lokale lymfeklieren voordat ze naar verre organen reizen. Zodra lokale lymfeklieren erbij betrokken zijn, zijn verspreiding naar de lever, de buikholte en de long de volgende meest voorkomende bestemmingen van metastatische verspreiding.
Colorectale kanker is de derde meest voorkomende oorzaak van kanker in de VS, zowel bij mannen als bij vrouwen. Het treft jaarlijks meer dan 135.000 mensen, wat neerkomt op 8% van alle vormen van kanker. Ongeveer 4,3% van de mensen krijgt op enig moment in hun leven de diagnose darm- of endeldarmkanker.
Door op 'Verzenden' te klikken, ga ik akkoord met de algemene voorwaarden en het privacybeleid van MedicineNet. Ik ga er ook mee akkoord e-mails van MedicineNet te ontvangen en ik begrijp dat ik me op elk moment kan afmelden voor MedicineNet-abonnementen.
Beroepsbeoefenaren in de gezondheidszorg zijn er zeker van dat colorectale kanker niet besmettelijk is (een persoon kan de ziekte niet krijgen van een kankerpatiënt). Sommige mensen hebben meer kans op colorectale kanker dan anderen. Factoren die iemands risico op colorectale kanker verhogen, zijn onder meer een toenemende leeftijd, Afro-Amerikaans ras, hoge vetinname, een familiegeschiedenis van colorectale kanker en poliepen, de aanwezigheid van poliepen in de dikke darm en inflammatoire darmaandoeningen, voornamelijk chronische colitis ulcerosa.
Toenemende leeftijd is de belangrijkste risicofactor voor colorectale kanker. Ongeveer 90% van de colorectale kankers wordt gediagnosticeerd na de leeftijd van 50 jaar.
Afro-Amerikanen hebben een hogere incidentie van colorectale kanker dan mensen van andere rassen.
In tal van onderzoeken is aangetoond dat diëten met veel vet mensen vatbaar maken voor colorectale kanker. In landen met een hoog percentage darmkanker is de vetinname door de bevolking veel hoger dan in landen met een laag percentage kanker. Er wordt aangenomen dat de vertering van vet in de dunne darm en de dikke darm leidt tot de vorming van kankerverwekkende chemicaliën (kankerverwekkende stoffen). Evenzo onthullen onderzoeksstudies ook dat diëten met veel groenten en vezelrijk voedsel zoals volkoren brood en granen minder vet bevatten dat deze kankerverwekkende stoffen produceert en de effecten van de kankerverwekkende stoffen kan tegengaan. Beide effecten zouden het risico op kanker helpen verminderen.
Onderzoek heeft aangetoond dat de meeste colorectale kankers zich ontwikkelen in colorectale poliepen. Daarom kan het verwijderen van goedaardige (maar precancereuze) colorectale poliepen colorectale kanker voorkomen. Precancereuze colorectale poliepen worden meestal adenomateuze poliepen genoemd. Ze ontwikkelen zich wanneer chromosomale schade optreedt in cellen van de binnenwand van de dikke darm. De schade produceert abnormale cellen, maar de cellen hebben nog niet het vermogen ontwikkeld om zich te verspreiden, het kenmerk van kanker. In plaats daarvan blijft het groeiende weefsel gelokaliseerd in de poliep. Wanneer de chromosomale schade binnen de poliep verder toeneemt, wordt de celgroei ongecontroleerd en beginnen de cellen zich te verspreiden, dat wil zeggen dat ze kanker worden. Dus colonpoliepen die aanvankelijk goedaardig zijn, krijgen extra chromosoombeschadiging om kanker te worden.
Chronische colitis ulcerosa veroorzaakt een ontsteking van de binnenwand van de dikke darm. Darmkanker is een erkende complicatie van chronische colitis ulcerosa. Het risico op kanker begint toe te nemen na acht tot tien jaar colitis. Het risico op het ontwikkelen van darmkanker bij een patiënt met colitis ulcerosa is ook gerelateerd aan de locatie en de omvang van zijn of haar ziekte.
Patiënten met een hoger risico op kanker zijn patiënten met een familiegeschiedenis van darmkanker, een langdurige colitis ulcerosa, uitgebreide betrokkenheid van de dikke darm bij colitis ulcerosa en patiënten met colitis ulcerosa-geassocieerde leverziekte, scleroserende cholangitis.
Aangezien de kankers die gepaard gaan met colitis ulcerosa een gunstiger resultaat hebben wanneer ze in een vroeger stadium worden ontdekt, wordt vaak aanbevolen om jaarlijks de dikke darm te onderzoeken na acht jaar bekende uitgebreide ziekte. Tijdens deze onderzoeken worden weefselmonsters (biopten) genomen om te zoeken naar precancereuze veranderingen in de cellen die de dikke darm bekleden. Wanneer precancereuze veranderingen worden gevonden, kan verwijdering van de gehele dikke darm nodig zijn om darmkanker te voorkomen.
De genetische achtergrond van een persoon is een belangrijke factor bij het risico op darmkanker. Het hebben van een eerstegraads familielid met colorectale kanker, vooral als de kanker werd gediagnosticeerd vóór de leeftijd van 55 jaar, verdubbelt ongeveer het risico op het ontwikkelen van de aandoening.
Hoewel een familiegeschiedenis van darmkanker een belangrijke risicofactor is, komt een meerderheid (80%) van de darmkanker sporadisch voor bij patiënten zonder familiegeschiedenis van darmkanker. Ongeveer 20% van de kankers wordt in verband gebracht met een familiegeschiedenis van darmkanker.
Chromosomen bevatten genetische informatie en chromosomale schade veroorzaakt genetische defecten die leiden tot de vorming van darmpoliepen en later darmkanker. Bij sporadische poliepen en kankers (poliepen en kankers die zich ontwikkelen zonder familiegeschiedenis), worden de chromosoombeschadigingen verworven (zich ontwikkelen in een cel tijdens het volwassen leven). De beschadigde chromosomen zijn alleen te vinden in de poliepen en de kankers die zich uit die cel ontwikkelen. Maar bij erfelijke darmkankersyndromen worden de chromosomale defecten bij de geboorte overgeërfd en zijn ze in elke cel van het lichaam aanwezig. Patiënten die de erfelijke genen voor het colonkankersyndroom hebben geërfd, lopen het risico op het ontwikkelen van dikke darmpoliepen, meestal op jonge leeftijd, en lopen een zeer hoog risico op het ontwikkelen van darmkanker op jonge leeftijd; ze lopen ook het risico kanker in andere organen te ontwikkelen.
Familiale adenomateuze polyposis (FAP) is een erfelijk colorectaal kankersyndroom waarbij de getroffen familieleden vanaf hun tienerjaren ontelbare aantallen (honderden, soms duizenden) dikke darmpoliepen zullen ontwikkelen. Tenzij de aandoening vroeg wordt ontdekt en behandeld (de behandeling omvat het verwijderen van de dikke darm), is het vrijwel zeker dat een persoon met FAP darmkanker krijgt door deze poliepen. Kankers ontwikkelen zich vrijwel zeker tegen de tijd dat een persoon in de veertig is. Deze patiënten lopen ook het risico andere vormen van kanker te ontwikkelen, zoals kankers in de schildklier, de maag en de ampulla (deel van het galkanaal waar het vanuit de lever in de dunne darm terechtkomt), evenals goedaardige tumoren die desmoïdtumoren worden genoemd. FAP komt voort uit een mutatie in een specifiek gen dat het APC-gen wordt genoemd. De specifieke mutatie kan bij de meeste mensen worden geïdentificeerd met de juiste tests, en dergelijke tests worden aanbevolen voor zowel personen met de diagnose FAP als hun familieleden.
Verzwakte familiale adenomateuze polyposis (AFAP) is een mildere versie van FAP. Getroffen leden ontwikkelen minder dan 100 dikke darmpoliepen. Toch lopen ze nog steeds een zeer hoog risico om op jonge leeftijd darmkanker te krijgen. Ze lopen ook het risico maagpoliepen en duodenumpoliepen te krijgen.
Erfelijke niet-polyposis colonkanker (ook bekend als Lynch-syndroom of HNPCC) is een erfelijk colorectaal kankersyndroom waarbij getroffen familieleden poliepen en kankers in de dikke darm kunnen ontwikkelen, meestal in de rechter dikke darm, in de leeftijd van 30 tot 40 jaar. Patiënten met HNPCC lopen ook het risico baarmoederkanker, maagkanker, eierstokkanker en kanker van de urineleiders (de buizen die de nieren met de blaas verbinden) en de galwegen te ontwikkelen. Ironisch genoeg lijkt het erop dat, hoewel darmkanker vaker voorkomt bij patiënten met HNPCC, deze kankers gemakkelijker te genezen zijn dan "sporadische" darmkankers. De specifieke genetische afwijkingen die verband houden met HNPCC zijn geïdentificeerd en patiënten en familieleden kunnen worden getest om te bepalen of HNPCC aanwezig is en of familieleden de afwijking dragen en waarschijnlijk kanker krijgen.
MYH polyposis-syndroom is een recent ontdekt erfelijk colorectaal kankersyndroom. Getroffen leden ontwikkelen doorgaans 10 tot 100 poliepen rond de leeftijd van 40 jaar en lopen een hoog risico op het ontwikkelen van darmkanker. Ook hier is de genetische afwijking geconstateerd.
Het is belangrijk om te onthouden dat de overgrote meerderheid van colorectale kankers geen enkele, identificeerbare chromosomale afwijking heeft waarnaar bij familieleden kan worden gezocht om personen met een risico op colorectale kanker te identificeren.
Aan colorectale kanker gerelateerde symptomen zijn talrijk en niet-specifiek. Ze omvatten vermoeidheid, zwakte, kortademigheid, verandering in stoelgang, smalle ontlasting, diarree of constipatie, rood of donker bloed in de ontlasting, gewichtsverlies, buikpijn, krampen of een opgeblazen gevoel. Andere aandoeningen zoals het prikkelbare darm syndroom (spastische dikke darm), colitis ulcerosa, de ziekte van Crohn, diverticulose en maagzweren kunnen symptomen hebben die op darmkanker lijken.
Colorectale kanker kan enkele jaren aanwezig zijn voordat de symptomen zich ontwikkelen. Symptomen variëren afhankelijk van waar in de dikke darm de tumor zich bevindt. De rechter dubbele punt is breder en flexibeler. Het kan zelfs relatief ruim worden genoemd in vergelijking met de rest van de dikke darm. Kankers van de rechter dikke darm kunnen uitgroeien tot grote maten voordat ze abdominale symptomen veroorzaken. Typisch, rechtszijdige kankers veroorzaken bloedarmoede door ijzertekort als gevolg van het langzame bloedverlies gedurende een lange periode. Bloedarmoede door ijzertekort veroorzaakt vermoeidheid, zwakte en kortademigheid. De linker colon is smaller dan de rechter colon. Daarom is de kans groter dat kankers van de linker colon een gedeeltelijke of volledige darmobstructie veroorzaken. Kankers die gedeeltelijke darmobstructie veroorzaken, kunnen symptomen van constipatie, vernauwde ontlasting, diarree, buikpijn, krampen en een opgeblazen gevoel veroorzaken. Helder rood bloed in de ontlasting kan ook wijzen op een groei nabij het einde van de linker dikke darm of het rectum.
Wanneer colonkanker wordt vermoed, wordt meestal een colonoscopie uitgevoerd om de diagnose te bevestigen en de tumor te lokaliseren.
Colonoscopie is een procedure waarbij een beroepsbeoefenaar in de gezondheidszorg een lange, flexibele kijkbuis in het rectum inbrengt om de binnenkant van de gehele dikke darm te inspecteren. Colonoscopie wordt over het algemeen als nauwkeuriger beschouwd dan röntgenfoto's van bariumklysma, vooral bij het opsporen van kleine poliepen. Als er dikkedarmpoliepen worden gevonden, worden deze meestal via de colonoscoop verwijderd en naar de patholoog gestuurd. De patholoog onderzoekt de poliepen onder de microscoop om te controleren op kanker. Colonoscopie is de beste procedure om te gebruiken wanneer kanker van de dikke darm wordt vermoed. Hoewel de meerderheid van de poliepen die door colonoscopen worden verwijderd goedaardig zijn, zijn veel precancereus. Verwijdering van precancereuze poliepen voorkomt de toekomstige ontwikkeling van darmkanker door deze poliepen.
Sigmoïdoscopie is een procedure die wordt uitgevoerd met een kortere flexibele reikwijdte om alleen de linker dikke darm en het rectum te onderzoeken. Het is gemakkelijker voor te bereiden en uit te voeren dan een volledige colonoscopie, maar heeft duidelijke beperkingen in termen van niet lang genoeg om zowel de rechter- als de transversale colon te beoordelen. Poliepverwijdering en kankerbiopsie kunnen worden uitgevoerd via de sigmoidoscoop.
Als tijdens colonoscopie kankergezwellen worden gevonden, kunnen kleine weefselmonsters (biopten) worden verkregen en onder de microscoop worden onderzocht om te bepalen of de poliep kankerachtig is. Als darmkanker wordt bevestigd door een biopsie, worden stadiëringsonderzoeken uitgevoerd om te bepalen of de kanker zich al naar andere organen heeft verspreid. Aangezien colorectale kanker de neiging heeft zich naar de longen en de lever te verspreiden, omvatten stadiëringstests meestal CT-scans van de longen, lever en buik. Positronemissietomografie (PET)-scans, een nieuwere test die zoekt naar de verhoogde metabolische activiteit die gebruikelijk is in kankerweefsel, wordt ook vaak gebruikt om te kijken naar de verspreiding van darmkanker naar lymfeklieren of andere organen.
Soms kan de beroepsbeoefenaar in de gezondheidszorg een bloedtest met een "tumormarker" verkrijgen, een carcino-embryonaal antigeen (CEA) genaamd, als er een vermoeden van kanker bestaat. CEA is een stof die wordt geproduceerd door sommige colon- en endeldarmkankercellen en door sommige andere soorten kanker. Het wordt soms in hoge concentraties aangetroffen bij patiënten met colorectale kanker, vooral wanneer de ziekte zich heeft verspreid. Het kan dienen als een nuttige test om te volgen als blijkt dat het verhoogd is voordat de kanker wordt verwijderd. Niet alle patiënten met colorectale kanker zullen echter een verhoogde CEA hebben, zelfs als hun kanker zich heeft verspreid. (Sommige colorectale kankers produceren het niet.) Bovendien, sommige patiënten zonder kanker kan een verhoogde CEA-bloedtest hebben. Zo zal ongeveer 15% van de rokers een verhoogde CEA hebben zonder darmkanker. De CEA wordt dus niet gebruikt om colorectale kanker te diagnosticeren, maar om de effecten van de behandeling van colorectale kanker te volgen bij iemand met een bekende voorgeschiedenis van de ziekte, omdat bij sommige patiënten de hoeveelheid kankerweefsel correleert met het niveau van CEA.
Wanneer colorectale kanker wordt gediagnosticeerd, worden aanvullende tests uitgevoerd om de omvang van de ziekte te bepalen. Dit proces wordt enscenering genoemd. Staging bepaalt hoe vergevorderd colorectale kanker is geworden. De stadiëring voor colorectale kanker varieert van stadium I, de minst gevorderde kanker, tot stadium IV, de meest geavanceerde kanker.
Bij elke volgende fase van darmkanker neemt het risico op terugkerende kanker en overlijden als gevolg van de verspreiding van kanker (metastase) toe. Zoals opgemerkt, hebben eerdere kankers een lager risico op herhaling en overlijden. Tegen de tijd dat een persoon stadium IV colorectale kanker heeft, is de prognose slecht. Maar zelfs in stadium IV colorectale kanker (afhankelijk van waar de kanker zich heeft verspreid) bestaat er een kans op genezing.
Chirurgie is de meest voorkomende initiële medische behandeling voor colorectale kanker. Tijdens de operatie worden de tumor, een kleine marge van de omliggende gezonde darm en aangrenzende lymfeklieren verwijderd. De chirurg verbindt vervolgens de gezonde delen van de darm opnieuw. Bij patiënten met endeldarmkanker wordt de endeldarm soms definitief verwijderd als de kanker te laag in de endeldarm ontstaat. De chirurg maakt dan een opening (colostoma) op de buikwand waardoor vast afval uit de dikke darm wordt uitgescheiden. Speciaal opgeleide verpleegkundigen (enterostomale therapeuten) kunnen patiënten helpen zich aan te passen aan colostomieën, en de meeste patiënten met colostomieën keren terug naar een normale levensstijl.
Voor vroege darmkanker is de aanbevolen behandeling chirurgische verwijdering. Voor de meeste mensen met darmkanker in een vroeg stadium (stadium I en de meeste stadium II), is alleen een operatie de enige vereiste behandeling. Chemotherapie kan worden aangeboden aan sommige mensen met stadium II-kankers die factoren hebben die suggereren dat hun tumor een hoger risico op herhaling heeft. Echter, als darmkanker zich eenmaal heeft uitgezaaid naar lokale lymfeklieren (stadium III), blijft het risico dat de kanker terugkeert hoog, zelfs als al het zichtbare bewijs van de kanker door de chirurg is verwijderd. Dit komt door een verhoogde kans dat kleine kankercellen mogelijk zijn ontsnapt voorafgaand aan de operatie en te klein zijn om op dat moment te detecteren door middel van bloedonderzoek, scans of zelfs direct onderzoek. Hun aanwezigheid wordt afgeleid uit een hoger risico op herhaling van de darmkanker op een later tijdstip (recidief). Medische kankerartsen (medische oncologen) adviseren in deze setting aanvullende behandelingen van darmkanker met chemotherapie om het risico op terugkeer van de kanker te verminderen. Geneesmiddelen die voor chemotherapie worden gebruikt, komen in de bloedbaan en vallen alle darmkankercellen aan die voorafgaand aan de operatie in het bloed of de lymfestelsels zijn uitgestoten, in een poging ze te doden voordat ze zich in andere organen vestigen. Van deze strategie, adjuvante chemotherapie genaamd, is bewezen dat het het risico op terugkeer van kanker verlaagt en wordt aanbevolen voor alle patiënten met stadium III colonkanker die gezond genoeg zijn om het te ondergaan, evenals voor sommige stadium II-patiënten met een hoger risico bij wie de tumor mogelijk is bleek de darmwand vóór de operatie te hebben geblokkeerd of geperforeerd.
Er zijn verschillende opties voor adjuvante chemotherapie voor de behandeling van darmkanker. De behandelingen omvatten een combinatie van chemotherapiemedicijnen die oraal of in de aderen worden toegediend. De behandelingen worden doorgaans gegeven voor een totaal van zes maanden. Het is belangrijk om een oncoloog te ontmoeten die de opties voor adjuvante chemotherapie kan uitleggen, evenals de bijwerkingen waarop u moet letten, zodat de juiste keuze kan worden gemaakt voor een patiënt als individu.
Chemotherapie wordt meestal gegeven in de kliniek van een beroepsbeoefenaar in de gezondheidszorg, poliklinisch in het ziekenhuis of thuis. Chemotherapie wordt meestal gegeven in behandelingscycli gevolgd door herstelperioden zonder behandeling. Bijwerkingen van chemotherapie variëren van persoon tot persoon en zijn ook afhankelijk van de toegediende middelen. Moderne chemotherapiemiddelen worden meestal goed verdragen en bijwerkingen zijn voor de meeste mensen beheersbaar. Over het algemeen vernietigen medicijnen tegen kanker cellen die snel groeien en zich delen. Daarom kunnen normale rode bloedcellen, bloedplaatjes en witte bloedcellen die ook snel groeien, worden aangetast door chemotherapie. Dientengevolge zijn vaak voorkomende bijwerkingen bloedarmoede, verlies van energie en lage weerstand tegen infecties. Cellen in de haarwortels en darmen delen zich ook snel. Daarom kan chemotherapie haaruitval, zweertjes in de mond, misselijkheid, braken en diarree veroorzaken, maar deze effecten zijn van voorbijgaande aard.
Zodra colorectale kanker zich ver van de primaire tumorplaats heeft verspreid, wordt het beschreven als stadium IV-ziekte. Deze verre tumorafzettingen, afgescheiden van de primaire tumor, zijn door het bloed of het lymfestelsel gereisd en vormen nieuwe tumoren in andere organen. Op dat moment is colorectale kanker niet langer een lokaal probleem, maar een systemisch probleem met kankercellen die zowel zichtbaar zijn op de scan als niet-detecteerbaar, maar waarschijnlijk elders in het lichaam aanwezig zijn. Als gevolg hiervan is in de meeste gevallen chemotherapie de beste behandeling, wat systemische therapie is. Het is bewezen dat chemotherapie bij uitgezaaide darmkanker de levensduur verlengt en de kwaliteit van leven verbetert. Als het goed wordt behandeld, zijn de bijwerkingen van chemotherapie doorgaans veel minder dan de bijwerkingen van ongecontroleerde kanker. Chemotherapie alleen kan uitgezaaide darmkanker niet genezen, maar het kan de levensverwachting meer dan verdubbelen en zorgen voor een goede kwaliteit van leven tijdens de behandeling.
Chemotherapie-opties voor de behandeling van colorectale kanker variëren afhankelijk van andere gezondheidsproblemen waarmee een persoon wordt geconfronteerd. Voor fittere personen worden meestal combinaties van verschillende chemotherapeutische geneesmiddelen aanbevolen, terwijl voor ziekere mensen eenvoudiger behandelingen het beste kunnen zijn. Verschillende multidrug-regimes combineren middelen met bewezen activiteit bij colorectale kanker, zoals 5-fluorouracil (5-FU), dat vaak wordt gegeven met het medicijn leucovorine (ook folinezuur genoemd) of een vergelijkbaar medicijn genaamd levoleucovorine, waardoor het beter werkt.
Capecitabine (Xeloda), is een medicijn voor chemotherapie dat in pilvorm wordt gegeven. Eenmaal in het lichaam wordt het veranderd in 5-FU wanneer het de tumorplaats bereikt. Andere chemotherapiemedicijnen voor colorectale kanker zijn irinotecan (Camptosar), oxaliplatine (Eloxatin) en trifluridine en tipiracil (Lonsurf), een combinatiemedicijn in pilvorm. Chemotherapieschema's hebben vaak acroniemen om hun nomenclatuur te vereenvoudigen (zoals FOLFOX, FOLFIRI en FLOX).
Targeted therapies are newer treatments that target specific aspects of the cancer cell, which may be more important to the tumor than the surrounding tissues, offering potentially effective treatments with fewer side effects than traditional chemotherapy. Bevacizumab (Avastin), cetuximab (Erbitux), panitumumab (Vectibix), ramucirumab (Cyramza), regorafenib (Stivarga), and ziv-aflibercept (Zaltrap) are targeted therapies that have been used in the management of advanced colorectal cancer. These newer chemotherapeutic agents most often are combined with standard chemotherapy to enhance their effectiveness.
If the first treatment is not effective, second- and third-line options are available that can confer a benefit to people living with colorectal cancer.
Radiation therapy is the primary treatment of colorectal cancer has been limited to treating cancer of the rectum. As noted earlier, whereas parts of the colon move freely within the abdominal cavity, the rectum is fixed in place within the pelvis. It is in an intimate relationship with many other structures and the pelvis is a more confined space. For these reasons, a tumor in the rectum often is harder to remove surgically because space is smaller and other structures can be involved with cancer. As a result, for all but the earliest rectal cancers, initial chemotherapy and radiation treatments (a local treatment to a defined area) are recommended to try and shrink cancer, allowing for easier removal and lowering the risk of cancer returning locally. Radiation therapy is typically given under the guidance of a radiation specialist called a radiation oncologist. Initially, individuals undergo a planning session, a complicated visit as the doctors and technicians determine exactly where to give the radiation and which structures to avoid. Chemotherapy usually is administered daily while the radiation is delivered. Side effects of radiation treatment include fatigue, temporary or permanent pelvic hair loss, and skin irritation in the treated areas.
Radiation therapy will occasionally be used as a palliative treatment to reduce pain from the recurrent or metastatic colon or rectal cancer.
Follow-up exams are important for people with colorectal cancer. The cancer can come back near the original site, although this is unusual. If the cancer returns, it typically does so in a distant location such as the lymph nodes, liver, or lungs. Individuals diagnosed with colorectal cancer remain at risk of their cancer returning for up to 10 years after their original diagnosis and treatment, although the risk of recurrence is much higher in the first few years. Medical providers in the United States follow patients with physical examinations and blood tests including the CEA (if it was elevated before surgery) tumor marker every three months for the first two years and then with decreasing frequency thereafter. Patients are also followed with colonoscopies (starting one year after their diagnosis) and with CT scans (typically performed at least once yearly for the first two to five years).
If a recurrence is noted either locally or with metastatic spread, individuals may still be treated with the intention of cure. For example, if a new tumor were to recur in the liver, individuals can be treated with a combination of chemotherapy and surgery (or sophisticated radiation techniques) in hopes of eradicating the cancer completely. Evaluation in hospitals of excellence that specialize in liver surgery can help guide these complicated treatment decisions and increase the chances of cure even in the setting of metastatic disease.
In addition to checking for cancer recurrence, patients who have had bowel cancer may have an increased risk of cancer of the prostate, breast, and ovary. Therefore, follow-up examinations in the clinic should include cancer screening for these diseases, as well.
Colorectal cancers are typically slow-growing cancers that take years to develop. Because they grow most often in a step-wise manner, screening can greatly reduce the likelihood of death associated with the disease. Whether with virtual colonoscopy or newer screening techniques, the future must focus first and foremost on better, more comprehensive screening programs that find polyps and early cancers before they become life-threatening. The public also must be educated on the value of screening programs.
For those living with cancer, intensive research is ongoing to better understand cancer biology and genetics so that specific approaches can be developed to attack specific types of cancers and, more importantly, specific individuals' cancers. Each person living with cancer has a disease with a unique biology and genetic code and the secret to better treatments involves unlocking that code. Cancer is very complex and scientists are just beginning to unravel its secrets. Progress is frustratingly slow for those battling the disease. With each passing year, however, our understanding increases and treatments become more refined. If you or your family member is living with colorectal cancer, speak with your doctor about ways you can participate in research through clinical trials to help increase our knowledge and improve our therapies for this difficult disease.
Survival rates for any cancer are often reported by stage, the extent of spread when the cancer is identified. For colon and rectum cancer, around 39% are diagnosed at the local stage, before the cancer has spread outside the local area. The five-year survival for these patients with localized colon and rectum cancer is around 90%.
When the cancer has spread to the regional lymph nodes near the site of origin, the five-year survival rate is about 71%. When the cancer has metastasized to distant sites in the body (stage IV cancer), the five-year survival rate lowers to about 14%.
The most effective prevention for colorectal cancer is early detection and removal of precancerous colorectal polyps before they turn cancerous. Even in cases where cancer has already developed, early detection still significantly improves the chances of a cure by surgically removing the cancer before the disease spreads to other organs.
Regular physical activity is associated with lower risk of colon cancer. Aspirin use also appears to lower the risk of bowel cancer. The use of combined estrogen and progestin in hormone replacement therapy lowers the risk of colon cancer in postmenopausal women. Hormone replacement therapy has risks which must be weighed against this effect, and should be discussed with a doctor.
Blood tests are now available to test for hereditary colon cancer syndromes. Families with multiple members having colon cancers, multiple colon polyps, cancers at young ages, and other cancers such as cancers of the ureters, uterus, duodenum, and more, may take advantage of resources such as genetic counseling, followed possibly by genetic testing. Genetic testing without prior counseling is discouraged because of the extensive family education that is involved and the complicated nature of interpreting the test results.
The advantages of genetic counseling followed by genetic testing include:(1) identifying family members at high risk of developing colon cancer to begin colonoscopies early; (2) identifying high-risk members so that screening may begin to prevent other cancers such as ultrasound tests for uterine cancer, urine examinations for ureter cancer, and upper endoscopies for stomach and duodenal cancers; and (3) alleviating concern for members who test negative for the hereditary genetic defects.
People can change their eating habits by reducing fat intake and increasing fiber (roughage) in their diet. Major sources of fat are meat, eggs, dairy products, salad dressings, and oils used in cooking. Fiber is the insoluble, nondigestible part of plant material present in fruits, vegetables, and whole-grain breads and cereals. It is postulated that high fiber in the diet leads to the creation of bulky stools which can rid the intestines of potential carcinogens. In addition, fiber leads to the more rapid transit of fecal material through the intestine, thus allowing less time for a potential carcinogen to react with the intestinal lining.
The term "screening" is properly applied only to the use of testing to look for evidence of cancer or pre-cancerous polyps in individuals who are asymptomatic and at only average risk for a type of cancer. Those patients who, for example, have a positive family history of colon cancer, or are symptomatic for a colon abnormality, undergo diagnostic testing rather than screening tests.
There are different types of screening tests for colorectal cancer:fecal (stool) occult blood testing, sigmoidoscopy, colonoscopy, digital colonoscopy, and DNA testing of the stool. The US Preventive Services Task Force (USPSTF) recommends strongly that screening begin at age 50 years for average-risk adults, but there is no specific recommendation for one screening test or strategy over another. The USPSTF advises that patients be offered a choice of screening options, using shared decision-making with the patient and physician to arrive at the best choice of screening programs for each individual.
Tumors of the colon and rectum tend to bleed slowly into the stool. The small amount of blood mixed into the stool usually is not visible to the naked eye. The commonly used stool occult blood tests rely on chemical color conversions to detect microscopic amounts of blood. These tests are both convenient and inexpensive. There are two kinds of fecal occult blood tests. The first is known as a guaiac FOBT. In this test, a small amount of stool is smeared on a special card for occult blood testing when a chemical is added to the card. Usually, three consecutive stool cards are collected. The other type of FOBT is an immunochemical test in which a special solution is added to the stool sample and analyzed in the laboratory using antibodies that can detect blood in a stool sample. The immunochemical test is a quantitative test that is more sensitive and specific for the diagnosis of polyps and cancer. It is preferred over the guaiac test.
A person who tests positive for stool occult blood has a 30%-45% chance of having a colon polyp and a 3%-5% chance of having a colon cancer. Colon cancers found under these circumstances tend to be small and not to have spread and have a better long-term prognosis.
It is important to remember that having stool tested positive for occult blood does not necessarily mean a person has colon cancer. Many other conditions can cause occult blood in the stool. However, patients with a positive stool occult blood test should undergo further evaluations to exclude colon cancer and to explain the source of the bleeding. It is also important to realize that stool that has tested negative for occult blood does not mean that colorectal cancer or polyps do not exist. Even under ideal testing conditions, a significant percentage of colon cancers can be missed by stool occult blood screening. Many patients with colon polyps do not have positive stool occult blood. In patients suspected of having colorectal polyps and in those at higher risk for developing colorectal polyps and cancer, screening flexible sigmoidoscopies or colonoscopies are performed even if the FOBT is negative.
Flexible sigmoidoscopy is an exam of the rectum and the lower colon (60 cm or about 2 feet in from the outside) using a viewing tube (a short version of colonoscopy). Research studies have shown that the use of screening flexible sigmoidoscopy can reduce mortality from colon cancer. This is a result of the detection of polyps or early cancers in people with no symptoms. If a polyp or cancer is found, a complete colonoscopy is recommended. The majority of colon polyps can be completely removed at the time of colonoscopy without surgery; however, polyps in the proximal colon that cannot be reached by the sigmoidoscope will be missed. Flexible sigmoidoscopy is often combined with fecal occult blood testing for colorectal cancer screening.
Colonoscopy uses a long (120 cm-150 cm) flexible tube, which can examine the entire length of the colon. Through this tube, the doctor (typically a gastroenterologist) can both view and take pictures of the entire colon and also can take biopsies of colon masses and remove polyps.
Patients with a high risk of developing colorectal cancer may undergo screening colonoscopies starting at earlier ages than 50. For example, patients with a family history of colon cancer are recommended to start screening colonoscopies at an age 10 years before the earliest colon cancer diagnosed in a first-degree relative or five years earlier than the earliest precancerous colon polyp discovered in a first-degree relative. Patients with hereditary colon cancer syndromes such as FAP, AFAP, HNPCC, and MYH are recommended to begin colonoscopies early. The recommendations differ depending on the genetic defect. For example, in people with FAP, colonoscopies may begin during teenage years to look for the development of colon polyps. Patients with a prior history of polyps or colon cancer may also undergo colonoscopies to exclude recurrence. Patients with a long history (greater than 10 years) of chronic ulcerative colitis have an increased risk of colon cancer and should have regular colonoscopies to look for precancerous changes in the colon lining.
Virtual colonoscopy (computerized tomographic or CT colonography) has been utilized in the clinic as a screening technique for colorectal cancer. Virtual colonoscopy employs a CT scan using low doses of radiation with special software to visualize the inside of the colon and look for polyps or masses. The procedure typically involves a bowel preparation with laxatives and/or enemas (although not always) followed by a CT scan after air is introduced into the colon. Because no sedation is necessary, individuals can return to work or other activities upon completion of the test. Virtual colonoscopies appear to be equally able to detect larger polyps (over 1 centimeter in size) as regular colonoscopies. The virtual colonoscopy cannot be used to biopsy or remove tissue from the colon. A follow-up sigmoidoscopy or colonoscopy must be done to accomplish that.
The Cologuard test is available in the U.S. for in-home sample collection for adults over 50 at average risk for colon cancer. The sample is sent to a laboratory for analysis of DNA changes in DNA from cells shed by the intestinal lining into the stool or hemoglobin in the sample. In a research study, the test was able to find 92% of colon cancers and 69% of precancers of the colon. False-negative and false-positive results are also possible.
 Wat betekent het als je gal overgeeft?
Wat betekent het als je gal overgeeft?
 Endoskopie kan de overlevingskansen van kanker verbeteren door artsen te helpen bij het vroegtijdig detecteren van waarschuwingssignalen
Endoskopie kan de overlevingskansen van kanker verbeteren door artsen te helpen bij het vroegtijdig detecteren van waarschuwingssignalen
 Wat is de vitamine D-test?
Wat is de vitamine D-test?
 Diabetische gastroparese
Diabetische gastroparese
 10 gezonde zomervoedingen
10 gezonde zomervoedingen
 Een gastro-enteroloog bezoeken voor chronische diarree
Een gastro-enteroloog bezoeken voor chronische diarree
 Caecum torsie - Diagnose van acute buik
Naast torsies, in deze afdeling van een darmpad nog andere vormen van onbegaanbaarheid die voortkomen uit verschillende excessen blind en de stijgende ingewanden die worden gecombineerd met torsies, e
Caecum torsie - Diagnose van acute buik
Naast torsies, in deze afdeling van een darmpad nog andere vormen van onbegaanbaarheid die voortkomen uit verschillende excessen blind en de stijgende ingewanden die worden gecombineerd met torsies, e
 Ultraviolet B-licht is goed voor het darmmicrobioom
Een kleine studie gepubliceerd in het tijdschrift Grenzen in de immunologie op 24 oktober, 2019, laat zien dat blootstelling aan ultraviolet B (UVB) licht, die gewoonlijk wordt bereikt door blootste
Ultraviolet B-licht is goed voor het darmmicrobioom
Een kleine studie gepubliceerd in het tijdschrift Grenzen in de immunologie op 24 oktober, 2019, laat zien dat blootstelling aan ultraviolet B (UVB) licht, die gewoonlijk wordt bereikt door blootste
 Galblaaskanker
Galblaaskankercentrum Diavoorstelling met kanker 101-fotos Diavoorstelling van borstkanker Diavoorstelling Huidkanker Opmerkingen van de patiënt:Galblaaskanker - Tekenen en symptomen Patiëntopmerkinge
Galblaaskanker
Galblaaskankercentrum Diavoorstelling met kanker 101-fotos Diavoorstelling van borstkanker Diavoorstelling Huidkanker Opmerkingen van de patiënt:Galblaaskanker - Tekenen en symptomen Patiëntopmerkinge