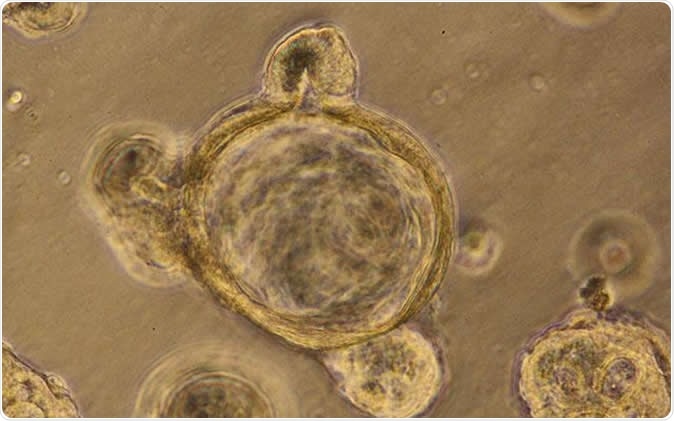
 Il s'agit d'un organoïde mini-intestinal généré en laboratoire à partir de cellules souches humaines. Crédit d'image:Sciences de la santé de l'UC San Diego
Il s'agit d'un organoïde mini-intestinal généré en laboratoire à partir de cellules souches humaines. Crédit d'image:Sciences de la santé de l'UC San Diego L'équipe a découvert qu'elle pouvait utiliser des cellules intestinales tridimensionnelles dans une boîte de Pétri sous la forme d'organoïdes intestinaux et tester les médicaments pour leur efficacité sur les intestins qui fuient. Ces organoïdes peuvent recréer avec succès le système moléculaire au sein du laboratoire, y compris les cellules de la muqueuse intestinale, etc. Ces cellules sont normalement scellées pour éviter les fuites. Dans certaines maladies, les phoques peuvent être dysfonctionnels entraînant des fuites intestinales, ont écrit les chercheurs. Ces conditions sont fréquemment observées dans les cancers et chez les personnes âgées, ils ont expliqué. Dans cette condition, il peut y avoir une fuite de microbes ainsi que de molécules vitales des intestins dans les cavités abdominales.
Pour créer ces organoïdes, l'équipe a utilisé des cellules intestinales provenant de patients. Les intestins ont généralement des crêtes et des cryptes avec des pics et des vallées. Des cryptes, ils pourraient isoler des cellules souches. Ces cellules ont été utilisées pour créer les organoïdes tridimensionnels dans les laboratoires, l'équipe a écrit. Les cellules souches se sont développées pour devenir quatre types de cellules qui sont normalement notées dans l'intestin. Ces cellules se sont ensuite enroulées pour devenir de mini boyaux dans les boîtes de Pétri qu'elles ont écrites. Maintenant, les organoïdes pouvaient être testés.
Il peut y avoir plusieurs états pathologiques qui conduisent à l'affaiblissement des liaisons entre les cellules et les cellules jonctionnelles entre deux cellules intestinales, ont écrit les chercheurs. Cela conduit à une fuite des molécules de l'intérieur des intestins ainsi qu'à une fuite de microbes. Cela peut déclencher le système immunitaire conduisant à un état d'inflammation chronique. Maladies inflammatoires de l'intestin telles que la colite ulcéreuse et la maladie de Crohn ainsi que d'autres affections telles que les lésions hépatiques, cancéreux, Diabète, athérosclérose, Selon les chercheurs, l'arthrite et même la démence pourraient être associées à des cellules intestinales qui fuient. Jusqu'à présent, il n'y avait aucun moyen d'étudier ce problème, encore moins résolu, ont écrit les chercheurs. Cette nouvelle étude ouvre enfin une voie où la condition pourrait être répliquée en laboratoire et étudiée à son niveau moléculaire.
Pour cette étude, l'équipe a pris les mini organoïdes et a ouvert les boules roulées pour exposer la surface intestinale. Au-dessus de ceux-ci, ils ont utilisé des bactéries et d'autres facteurs de stress pour affaiblir les cellules jonctionnelles et créer des ouvertures qui fuient. Maintenant, ils pourraient étudier les mécanismes moléculaires ainsi que les médicaments qui pourraient aider à resserrer ces liens entre les cellules pour éviter les fuites.
Des chercheurs de la faculté de médecine de l'Université de Californie à San Diego ont ainsi utilisé des modèles 3D d'intestins humains dans des boîtes de Pétri. Ces cellules ont été données par de vrais patients souffrant de fuites intestinales. Les cellules ont été créées en mini organoïdes 3D afin qu'elles puissent imiter les vrais intestins. L'équipe a ensuite trouvé certains biomarqueurs caractéristiques des intestins présentant un problème de fuite. L'équipe spécule que ces marqueurs pourraient aider les chercheurs à diagnostiquer cette maladie tôt et également à suivre la progression de la maladie au fil du temps.
Pour leur étude, ils ont utilisé un médicament contre le diabète couramment utilisé, la metformine, pour essayer de colmater les fuites dans les parois intestinales. L'étude menée par Pradipta Ghosh, MARYLAND, professeur de médecine cellulaire et moléculaire à la faculté de médecine de l'UC San Diego et au Moores Cancer Center, et auteur principal Soumita Das, Doctorat, professeur agrégé de pathologie à la faculté de médecine de l'UC San Diego, a révélé que ce médicament couramment utilisé pouvait aider les patients souffrant d'une fuite intestinale.
Ghosh et Das avaient plus tôt, dans une autre étude, a montré qu'un mécanisme appelé voie de signalisation de polarité de stress pourrait aider à combler les écarts entre les cellules et à prévenir les fuites. Dans cette étude, ils avaient également noté que les connexions et les liaisons entre les cellules se dissociaient à cause du stress.
Cette nouvelle étude a révélé que la metformine pourrait fonctionner pour activer certaines réactions chimiques qui pourraient resserrer ces jonctions et ainsi empêcher les fuites. L'équipe dit que leur succès n'a encore été vu que dans les boîtes de Pétri sur les mini organoïdes de l'intestin. Ils doivent le reproduire chez l'homme pour voir si le médicament pourrait réellement aider les patients souffrant de fuites intestinales. Ils ont toutefois ajouté que le succès du médicament dans ces organoïdes est un grand pas en avant pour prouver que le médicament pourrait réellement aider. Metformine, ils ont écrit augmenter les niveaux d'une protéine appelée occlusion qui peut resserrer les jonctions entre les cellules. En cas de succès, cela pourrait aider un grand nombre de patients, ils ont expliqué.
Gosh a dit, "De nombreuses recherches sont effectuées sur des souris consanguines afin qu'elles soient génétiquement identiques, tous dans la même cage, manger le même régime, afin de retirer ces variables des études. Mais les souris de laboratoire sont bien plus standardisées que le même humain au jour le jour, ou les patients que nous voyons dans les cliniques. Ici, notre modèle est une meilleure représentation de l'humanité. D'autre part, cela signifie également que chaque organoïde est sa propre expérience unique. Nous devons tester de nombreux organoïdes pour pouvoir prétendre, ce que nous avons fait dans notre étude. Das ajouté, «Je pense que vous auriez du mal à trouver une maladie dans laquelle l'inflammation systémique n'est pas un moteur. C'est pourquoi, Même s'il y a tellement de choses que nous ne savons toujours pas, nous sommes enthousiasmés par le vaste potentiel de ce modèle et ces découvertes ouvrent pour le développement de thérapies personnalisées de l'intestin qui fuient qui ciblent l'AMPK et la voie de signalisation de la polarité du stress.
 Les probiotiques comme thérapie adjuvante pour les patients COVID-19
Les probiotiques comme thérapie adjuvante pour les patients COVID-19
 Le microbiome intestinal est également une réalité dans la vie fœtale
Le microbiome intestinal est également une réalité dans la vie fœtale
 Le microbiome pourrait aider à identifier le risque de pré-cancer chez les femmes atteintes du VPH
Le microbiome pourrait aider à identifier le risque de pré-cancer chez les femmes atteintes du VPH
 Un type de bactérie intestinale peut augmenter le risque de cancer de l'intestin
Un type de bactérie intestinale peut augmenter le risque de cancer de l'intestin
 Pourquoi les patients COVID-19 ont plus de bactéries pathogènes dans le nez
Pourquoi les patients COVID-19 ont plus de bactéries pathogènes dans le nez
 Des scientifiques extraient le génome humain complet d'un « chewing-gum » vieux de plusieurs milliers d'années
Des scientifiques extraient le génome humain complet d'un « chewing-gum » vieux de plusieurs milliers d'années
 Le microbiome intestinal change avec la cuisson des aliments végétaux,
dit une nouvelle étude Lorsque des chercheurs de lUC San Francisco et de Harvard se sont associés pour découvrir comment le microbiome intestinal est affecté par la cuisson, ils ont découvert que de p
Le microbiome intestinal change avec la cuisson des aliments végétaux,
dit une nouvelle étude Lorsque des chercheurs de lUC San Francisco et de Harvard se sont associés pour découvrir comment le microbiome intestinal est affecté par la cuisson, ils ont découvert que de p
 Une étude met en lumière les causes des douleurs intestinales débilitantes
Les douleurs intestinales débilitantes sont fréquentes, mais la cause sous-jacente nest toujours pas claire. Dhabitude, il provient dune infection intestinale qui déclenche des réponses immunitaires.
Une étude met en lumière les causes des douleurs intestinales débilitantes
Les douleurs intestinales débilitantes sont fréquentes, mais la cause sous-jacente nest toujours pas claire. Dhabitude, il provient dune infection intestinale qui déclenche des réponses immunitaires.
 Des scientifiques résolvent un mystérieux cas de syndrome de l'auto-brasserie
Des chercheurs en Chine ont fait une découverte importante qui explique le cas déroutant dun homme de 27 ans qui avait des antécédents dintoxication sans réellement boire dalcool. Ils ont découvert
Des scientifiques résolvent un mystérieux cas de syndrome de l'auto-brasserie
Des chercheurs en Chine ont fait une découverte importante qui explique le cas déroutant dun homme de 27 ans qui avait des antécédents dintoxication sans réellement boire dalcool. Ils ont découvert