Fatos sobre o esôfago de Barrett
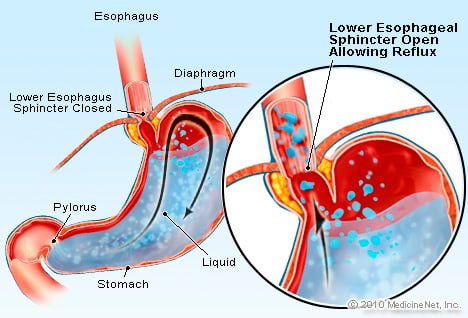
10% dos pacientes com DRGE desenvolvem esôfago de Barrett, um fator de risco para câncer de esôfago.
- O esôfago de Barrett é uma complicação da doença do refluxo gastrointestinal (DRGE) crônica (de longa duração) e geralmente grave, mas ocorre em apenas uma pequena porcentagem de pacientes com DRGE.
- Os critérios são necessários para a triagem de pacientes com DRGE para esôfago de Barrett. Até que critérios validados estejam disponíveis, parece razoável fazer endoscopias de triagem em pacientes com DRGE que não podem ser retirados da terapia de supressão ácida após dois a três anos.
- O diagnóstico do esôfago de Barrett baseia-se em ver (na endoscopia) um revestimento esofágico rosa que se estende por uma curta distância (geralmente menos de 2,5 polegadas) até o esôfago a partir da junção gastroesofágica e encontrar células do tipo intestinal (células caliciformes) na biópsia do forro.
- Há um pequeno, mas definido aumento do risco de câncer de esôfago (adenocarcinoma) em pacientes com esôfago de Barrett.
- Se o diagnóstico de esôfago de Barrett for incerto, uma segunda opinião deve ser obtida, pois esse diagnóstico pode gerar custos maiores do que a DRGE isoladamente, bem como problemas para obter seguro de vida, saúde e invalidez. Portanto, é fundamental fazer um diagnóstico preciso.
- O tratamento do esôfago de Barrett é, em geral, essencialmente o mesmo da DRGE. O tratamento da DRGE, seja médico (medicamentos supressores de ácido) ou cirúrgico (fundoplicatura), não resulta no desaparecimento do esôfago de Barrett ou na redução do risco de câncer.
- A displasia é um processo celular que ocorre no revestimento de Barrett e indica um risco aumentado de câncer. Portanto, biópsias endoscópicas periódicas da mucosa de Barrett são realizadas para procurar displasia.
- A frequência recomendada para vigilância inicial de biópsia endoscópica em Barrett sem displasia é duas vezes ao ano. Se nenhuma displasia for encontrada, a vigilância é realizada a cada três anos.
- Se houver displasia de baixo grau, a vigilância por biópsia endoscópica deve ser feita a cada seis meses indefinidamente.
- O manejo da displasia de alto grau envolve a repetição das biópsias logo após a descoberta da displasia de alto grau para excluir o câncer concomitante. A esofagectomia (remoção cirúrgica do esôfago) é o padrão-ouro da terapia para displasia de alto grau e câncer, mas procedimentos experimentais estão disponíveis.
- A ablação (remoção por destruição) e outras técnicas experimentais parecem promissoras, mas aguardam-se dados de longo prazo (5 anos) para provar sua durabilidade e impacto na história natural da doença de Barrett, displasia e câncer precoce.
>

Sintomas do esôfago de Barrett
O esôfago de Barrett não apresenta sintomas únicos. Pacientes com Barrett têm os sintomas de DRGE ou refluxo ácido inclui o seguinte:
- náusea,
- vômitos,
- regurgitação (a presença de conteúdo estomacal regurgitado na boca) e
- erosões dos dentes induzidas por ácido.
Leia mais sobre sintomas e sinais de DRGE »
O que é o esôfago de Barrett?
O esôfago de Barrett é uma complicação da doença crônica do refluxo gastroesofágico (DRGE), principalmente em homens brancos. A DRGE é uma doença na qual há refluxo de fluido ácido do estômago para o esôfago (o tubo de deglutição). A DRGE causa mais comumente azia.
Existem dois requisitos para o diagnóstico do esôfago de Barrett. Os requisitos exigem uma endoscopia do esôfago. Durante a endoscopia, um tubo longo e flexível com uma luz e uma câmera na ponta (um endoscópio) é inserido pela boca até o esôfago para visualizar e fazer uma biópsia (amostra de tecido) do revestimento do esôfago. Os dois requisitos são:
- Na endoscopia, um revestimento anormal rosa ou salmão deve ser visto como substituto do revestimento esbranquiçado normal do esôfago. Esse revestimento anormal se estende por uma curta distância (geralmente menos de 2,5 polegadas) até o esôfago a partir da junção gastroesofágica (a junção GE, que é onde o esôfago se une ao estômago).
- A avaliação microscópica da biópsia desse revestimento anormal deve mostrar que as células de revestimento normais do esôfago foram substituídas por células de revestimento do tipo intestinal, incluindo células produtoras de muco chamadas células caliciformes. Outras células também estão presentes, algumas das quais se assemelham às células que revestem o estômago. No entanto, se as células caliciformes intestinais não estiverem presentes, o diagnóstico de esôfago de Barrett não deve ser feito.
O esôfago de Barrett é oficialmente codificado pela Biblioteca do Congresso para pesquisas eletrônicas da literatura como esôfago de Barrett, mas o esôfago de Barrett (com o apóstrofo "s") é o nome usado universalmente. A condição recebeu o nome de um cirurgião, Norman Barrett, que descreveu a condição. No entanto, verifica-se que sua interpretação das descobertas não estava correta. Em 1953, os doutores Allison e Johnstone realmente descreveram essa condição como a entendemos agora, ou seja, que a metaplasia estava ocorrendo. (Metaplasia, que será discutida abaixo, é o termo usado quando um tecido adulto substitui outro.) No entanto, a condição foi imortalizada com o nome de Barrett.
Inicialmente, pensava-se que o esôfago de Barrett consistia em tecido estomacal (gástrico) substituindo o tecido escamoso usual que reveste o esôfago. No entanto, em meados dos anos 70, o Dr. Paull e colegas publicaram um artigo no qual descreviam a mucosa (revestimento interno) do esôfago de Barrett com mais detalhes do que havia sido feito anteriormente. Eles apontaram que o esôfago de Barrett consistia em uma metaplasia na qual as células normais que revestiam o esôfago eram substituídas por uma mistura de células do revestimento gástrico e intestinal. As células de revestimento do tipo intestinal também são chamadas de células colunares especializadas que incluem células caliciformes. Por vários anos, alguns cientistas pensaram que havia dois tipos de Barrett; um em que o revestimento normal foi substituído apenas por células do tipo estômago (gástrico), e o segundo em que as células intestinais estavam presentes. No entanto, a crença atual é que apenas a presença de células caliciformes do tipo intestinal estabelece o diagnóstico de esôfago de Barrett, independentemente de quais outros tipos de células estejam presentes.
Por que há tanto interesse no esôfago de Barrett?
A razão para o grande interesse no esôfago de Barrett é que ele está associado a um risco aumentado de câncer de esôfago. O tipo de câncer que ocorre em pacientes com Barrett é o adenocarcinoma, que surge do tecido intestinal metaplásico. O câncer usual do esôfago que não está associado ao de Barrett é o carcinoma escamoso, que surge do revestimento de células escamosas que normalmente está presente no esôfago. A conexão entre o adenocarcinoma do esôfago e o esôfago de Barrett está agora clara, e o adenocarcinoma do esôfago está aumentando em frequência na maioria dos países do hemisfério ocidental.
A boa notícia, no entanto, é que o câncer ocorre em relativamente poucos pacientes com esôfago de Barrett. Ainda assim, o principal desafio nessa condição é observar os primeiros sinais de alerta de câncer, fazendo biópsias em intervalos regulares durante a endoscopia. Essa prática é chamada de vigilância e é semelhante, em princípio, à vigilância em mulheres para câncer de colo do útero, em que os exames de Papanicolau são feitos em intervalos regulares.
O que causa o esôfago de Barrett?

DRGE é uma condição na qual o excesso de fluido contendo ácido reflui (flui) de volta para o esôfago, em parte porque o esfíncter esofágico inferior é fraco.
Doença do refluxo gastroesofágico (DRGE)
A DRGE causa o esôfago de Barrett. O esôfago é um tubo muscular que está localizado no tórax e serve para transferir os alimentos da boca para o estômago. O esfíncter esofágico inferior (LES) é uma válvula localizada na junção do estômago com o esôfago. Sua função é evitar que o ácido e outros conteúdos do estômago voltem para o esôfago. A DRGE é uma condição na qual o excesso de líquido contendo ácido reflui (flui) de volta para o esôfago, em parte porque o esfíncter esofágico inferior é fraco. A fraqueza do EEI pode estar relacionada, em parte, ao fato de praticamente todos os pacientes com DRGE apresentarem hérnia hiatal. Em pacientes com hérnia hiatal, os poucos centímetros superiores do estômago deslizam para frente e para trás entre o abdômen e o tórax através do diafragma. Esse deslizamento pode interferir na forma como o esfíncter funciona como uma barreira ao refluxo do estômago para o esôfago.
Hérnia de hiato
Anteriormente, o termo hérnia era usado em vez de DRGE para explicar aos pacientes a base de seus sintomas (geralmente azia), porque praticamente todos os pacientes com DRGE têm hérnias de hiato. DRGE, no entanto, é o termo mais preciso. Embora as hérnias hiatais sejam extremamente comuns na população, apenas um pequeno número de pessoas com hérnia hiatal desenvolve DRGE. Em outras palavras, a presença de uma hérnia hiatal não significa que a pessoa desenvolverá DRGE. Por outro lado, no entanto, se uma pessoa tem DRGE, a hérnia de hiato quase sempre está presente.
Refluxo ácido grave
Assim, o esôfago de Barrett é causado por refluxo ácido crônico (de muitos anos de duração) e geralmente grave. Em alguns pacientes com DRGE, o esôfago reage à lesão repetida do fluido ácido, alterando o tipo de células que o revestem de escamosas (células normais) para colunares (células do tipo intestinal). Acredita-se que essa transformação, chamada metaplasia, seja uma resposta protetora porque o epitélio colunar especializado (epitélio significa revestimento) no esôfago de Barrett é mais resistente à lesão por ácido do que o epitélio escamoso.
Outros contribuintes para o esôfago de Barrett
O fluido no estômago contém ácido que é produzido pelo estômago. Além disso, no entanto, o fluido pode conter ácidos biliares (da bile produzida pelo fígado) e enzimas (produzidas pelo pâncreas) que refluíram do duodeno para o estômago. (O duodeno é a primeira parte do intestino delgado logo após o estômago.) O ácido que reflui do estômago para o esôfago é prejudicial ao esôfago. Há alguma evidência, no entanto, de que as enzimas biliares e pancreáticas combinadas com o ácido podem ser mais prejudiciais do que o ácido sozinho.
Quem desenvolve o esôfago de Barrett?
Uma porcentagem significativa de indivíduos com sintomas crônicos de DRGE desenvolve esôfago de Barrett, sendo mais comum em populações masculinas caucasianas. Nem todo mundo com DRGE tem sintomas de DRGE, no entanto. Portanto, algumas pessoas com Barrett não sabem que têm Barrett porque têm DRGE sem nenhum sintoma ou têm sintomas muito leves e infrequentes.
Não está claro por que o esôfago de Barrett é tão esmagadoramente mais comum em homens brancos do que em qualquer outro grupo. Por exemplo, embora as mulheres e os afro-americanos não pareçam estar protegidos contra o desenvolvimento da DRGE, eles estão amplamente protegidos (especialmente os afro-americanos) contra o desenvolvimento do esôfago de Barrett e do câncer de Barrett (adenocarcinoma). Há evidências de que, no hemisfério ocidental, o câncer de esôfago e o câncer da junção gastroesofágica (chamado câncer de cárdia) estão aumentando em frequência, talvez mais do que qualquer outro câncer do trato gastrointestinal. (No entanto, o câncer de cólon ainda é muito mais comum do que o câncer de esôfago.)
O esôfago de Barrett pode ocorrer em algumas famílias e ser geneticamente determinado. Estudos estão em andamento para determinar se quaisquer genes ou marcadores podem ser encontrados nessas famílias que possam prever o desenvolvimento do esôfago de Barrett na população em geral. Nessas famílias com Barrett, bem como com Barrett na população geral, a DRGE é o denominador comum. No entanto, a questão é por que a síndrome de Barrett ocorre mais comumente nessas famílias do que em outras com DRGE comparativamente grave, mas sem associação familiar.
Qual é a anormalidade específica no revestimento interno (epitélio) do esôfago de Barrett?
Repetindo, o primeiro critério para o diagnóstico do esôfago de Barrett é o achado na endoscopia de um revestimento róseo no esôfago, onde normalmente não é visto. Este revestimento anormal pode aparecer circunferencialmente como uma faixa, como uma língua ou como ilhas. O segundo critério é que as biópsias do revestimento rosa revelam a mucosa intestinalizada característica (o revestimento normalmente visto nos intestinos) com as células caliciformes típicas. As biópsias esofágicas são obtidas durante uma endoscopia. Uma endoscopia digestiva alta é um procedimento no qual o médico insere um tubo longo e flexível (endoscópio) pela boca e desce até o esôfago para visualizar diretamente o revestimento do esôfago. Durante o mesmo exame endoscópico, o estômago e o duodeno também podem ser visualizados. Várias pequenas amostras (biópsias) do tecido epitelial de revestimento podem ser obtidas através do endoscópio.
Metaplasia intestinal
Como mencionado anteriormente, o processo de substituição de um tipo de tecido de revestimento por outro é chamado de metaplasia. No estômago e nos intestinos, a metaplasia é uma resposta comum a certos tipos de lesão. Como Henry Appelman, um patologista, afirmou:"Quando o intestino está sob estresse, ele quer ser outra coisa". Outros exemplos de metaplasia em que um revestimento substitui outro são:(1) no estômago, onde a inflamação crônica (gastrite) pode resultar em um revestimento do tipo intestinal substituindo partes do revestimento normal do estômago; e (2) no duodeno (logo além do estômago no intestino) onde ocorrem úlceras pépticas e o revestimento intestinal que envolve a úlcera se transforma em revestimento do tipo estômago.
Acreditamos que o processo de metaplasia é uma resposta protetora ou adaptativa à lesão do revestimento. No entanto, a desvantagem da metaplasia é que, no esôfago de Barrett, ela carrega um pequeno, mas definitivo, aumento no risco de se tornar canceroso. Nem todas as metaplasias têm um risco aumentado de câncer. Por exemplo, das duas metaplasias referidas no parágrafo anterior, a metaplasia intestinal no estômago pode levar ao câncer, mas a metaplasia intestinal no duodeno não.
O processo de desenvolvimento de Barrett começa na junção dos revestimentos do estômago e do esôfago. O esôfago normalmente é revestido por um epitélio escamoso ou camada de revestimento. Este epitélio escamoso tem uma aparência branca perolada, enquanto o revestimento do estômago e intestinos tem uma cor mais rosa salmão porque é um epitélio colunar em vez de um epitélio escamoso. O epitélio escamoso é composto de células escamosas planas, que são semelhantes às células da pele. O estômago ou revestimento gástrico consiste em células colunares mais altas, vistas ao microscópio. A junção do epitélio escamoso do esôfago e do epitélio colunar gástrico ocorre na junção do esôfago com o estômago onde, como você lembra, está localizado o esfíncter esofágico inferior. A borda comum (interface) desses dois revestimentos é frequentemente chamada de linha Z, porque quando examinada durante uma endoscopia, ela tem uma aparência de ziguezague.
Com lesão progressiva do esôfago, ocorre metaplasia e o tecido metaplásico se move para cima no esôfago por uma distância que varia de pessoa para pessoa, geralmente de cerca de 0,5 a 2,5 polegadas (cerca de 1 a 6 centímetros). O tipo de célula que dá origem ao tecido metaplásico não é conhecido.
O esôfago de Barrett geralmente é categorizado em segmento curto ou longo de Barrett, com base no comprimento do esôfago afetado. Segmento curto Barrett geralmente se refere a envolvimento de 3 centímetros ou menos, enquanto segmento longo significa envolvimento de mais de 3 centímetros do esôfago. Curiosamente, uma vez que o esôfago de Barrett é diagnosticado em um paciente, o revestimento metaplásico não parece progredir mais para o esôfago se o paciente estiver sendo tratado para DRGE. Assim, ao longo do tempo, o tempo de envolvimento com Barrett geralmente permanece o mesmo.
Metaplasia intestinal da linha Z (junção gastroesofágica) sem Barrett visível
Se as biópsias são feitas de pacientes com DRGE que têm uma linha Z de aparência normal (sem evidência visível do esôfago de Barrett), até 30% mostrará a mesma metaplasia do tipo intestinal com células caliciformes que aquelas observadas no esôfago de Barrett. No entanto, não fazemos biópsias rotineiras de linhas Z de aparência normal para procurar essa alteração, nem fazemos vigilância quando a encontramos lá. A razão é que a metaplasia intestinal limitada da região da junção gastroesofágica na DRGE parece ocorrer com frequência semelhante em mulheres e afro-americanos como em homens brancos, mas o risco de esôfago de Barrett evidente é muito menor do que em homens brancos.
Portanto, a presença de metaplasia em uma biópsia de rotina de uma linha Z de aparência normal na DRGE não deve levar a nenhuma mudança no manejo. Além disso, a descoberta de células caliciformes nesse contexto não deve ser rotulada, como alguns sugeriram, como segmento ultracurto de Barrett. A principal razão para não rotulá-lo como de Barrett é que o termo Barrett implica um risco aumentado de câncer, e não há evidências de que esse achado esteja associado a um risco aumentado de câncer.
E o câncer que ocorre no esôfago de Barrett?
Adenocarcinoma do esôfago
O tipo de câncer que ocorre com o esôfago de Barrett é o adenocarcinoma. O câncer decorrente do revestimento escamoso do esôfago é chamado de câncer escamoso ou carcinoma. Entre os caucasianos, a taxa (frequência ao longo do tempo) de câncer escamoso está diminuindo em relação ao adenocarcinoma associado a Barrett. Outros grupos raciais (por exemplo, afro-americanos), no entanto, não experimentaram a mesma taxa de declínio no câncer escamoso em relação ao adenocarcinoma.
O tabagismo e a ingestão excessiva de álcool são fatores de risco definitivos para cânceres escamosos. Eles também são fatores de risco para adenocarcinoma visto no esôfago de Barrett. Nessa situação, no entanto, não está claro se o tabagismo e o álcool aumentam o risco de adenocarcinoma tornando a DRGE mais grave ou se o fumo e o álcool têm um efeito cancerígeno mais direto, como ocorre no câncer escamoso. Os cânceres de células escamosas tornaram-se cada vez menos comuns, enquanto os diagnósticos de adenocarcinoma aumentaram. A incidência de adenocarcinoma em homens brancos aumentou mais acentuadamente do que em outros grupos étnicos.
Ao longo do restante desta seção, o termo câncer de esôfago se referirá ao adenocarcinoma que surge do esôfago de Barrett.
Conexão com câncer da junção gastroesofágica (cárdia)
O câncer da junção gastroesofágica também é chamado de câncer de cárdia porque a região onde o esôfago encontra o estômago é chamada de cárdia. Este câncer, como o adenocarcinoma associado a Barrett, é encontrado predominantemente em homens brancos, aparentemente está aumentando em frequência na mesma proporção que o câncer de esôfago e está associado à DRGE crônica. Portanto, especula-se que o câncer de cárdia começa a partir de segmentos curtos (por exemplo, 1-2 cm) de Barrett. No momento em que o diagnóstico de câncer é feito, no entanto, o tumor pode ter se espalhado além do curto segmento de Barrett e pode parecer estar na cárdia. Essa especulação sobre a origem do câncer de cárdia, no entanto, ainda precisa ser comprovada.
Aumento de casos de câncer associado a Barrett e câncer da cárdia
Um aumento na frequência de adenocarcinoma de esôfago foi observado por pelo menos 20 anos, principalmente em homens brancos. Uma pista para o motivo dessa tendência pode estar relacionada a uma diminuição na frequência de
H. pylori infecção do estômago. Em outras palavras, pessoas com câncer de Barrett, incluindo câncer de cárdia, parecem ter taxas mais baixas de H. pylori infecção do que outros da mesma idade e sexo na mesma população.
H. pylori é um tipo de bactéria que é uma das principais causas de úlceras. É uma infecção muito comum em todo o mundo e não causa sintomas na grande maioria das pessoas afetadas. No entanto, algumas pessoas com
H. pylori desenvolver úlcera péptica do estômago e duodeno. Essas úlceras são tratadas eliminando as bactérias, o que, por sua vez, evita a recidiva das úlceras.
Se
H. pylori não tratada, causa inflamação progressiva do estômago (gastrite) que está associada à redução da secreção ácida e possivelmente menor refluxo de ácido para o esôfago. Em muitas áreas do mundo, esta infecção está diminuindo em frequência, presumivelmente devido a melhores medidas de saúde pública. Portanto, é possível que o efeito protetor (como diminuição da produção de ácido) do
H. pylori infecção diminuiu. Em outras palavras, com menos
H. pylori gastrite, o estômago produz mais ácido e há mais ácido para refluxo para o esôfago. Ao mesmo tempo, estamos mais predispostos ao refluxo em nossos últimos anos. Embora esta não seja uma questão resolvida, a frequência decrescente de
H. pylori infecção pode ser uma das razões para o aumento da frequência de adenocarcinoma associado a Barrett.
O que é displasia no esôfago de Barrett?
A displasia é uma alteração nas células que revestem o esôfago em que as células realmente mostram alterações anormais em sua estrutura e aparência. Quando essas alterações se tornam suficientemente graves (passando de displasia de baixo grau para alto grau), as células começam a parecer malignas (como células cancerígenas). No entanto, ao contrário do câncer, essas células permanecem no lugar e não invadem os tecidos fora do revestimento. A displasia ocorre como uma série de alterações celulares à medida que o esôfago de Barrett progride para o câncer associado a Barrett. Pacientes com Barrett são monitorados com endoscopia e biópsias (vigilância) para detectar essas alterações celulares (a displasia) ou, na pior das hipóteses, câncer precoce para que possam ser tratados. Atualmente, não há como prever quais pacientes com esôfago de Barrett irão desenvolver displasia.
A displasia também foi identificada adjacente a tumores do trato gastrointestinal além do adenocarcinoma de esôfago. Por exemplo, a displasia é encontrada em metade dos casos de câncer de estômago e no câncer de cólon, em que a displasia é visível como os chamados pólipos adenomatosos. Além disso, a displasia é a mesma alteração celular de alerta precoce que os patologistas procuram nos esfregaços de PAP do colo do útero que predizem o câncer do colo do útero.
Implicações da displasia no risco de câncer
A displasia é considerada pré-maligna. Isso significa que, se a displasia foi demonstrada em várias ocasiões, acredita-se que o paciente desenvolverá câncer se viver o suficiente. A displasia é classificada como sendo de alto grau ou de baixo grau. Quando a displasia de alto grau é diagnosticada, o câncer já pode estar presente e, caso contrário, o risco de desenvolver câncer mais cedo é maior do que com os graus menores de displasia.
Em biópsias de acompanhamento de pacientes com displasia, a condição pode não ser detectada novamente em alguns pacientes, enquanto em outros são encontrados graus baixos de displasia. Essa ausência ou diminuição da displasia pode ser devido a fatores como variações de amostragem, remoção de pequenos focos (grupos de células) de displasia com a biópsia inicial ou reversão biológica real. O(s) motivo(s) exato(s) são desconhecidos.
Biomarcadores
Usando técnicas moleculares, algumas alterações referidas como biomarcadores podem ser detectadas em espécimes de biópsia antes que a displasia se desenvolva. Essas alterações são semelhantes às observadas em outros cânceres. Os biomarcadores incluem alterações no conteúdo de DNA das células, nos genes e cromossomos e nos fatores de crescimento. Vários desses biomarcadores podem aparecer antes e durante a ocorrência da displasia. O objetivo final é encontrar um marcador mágico que possa nos dizer quais pacientes entre aqueles sem displasia ou displasia de baixo grau são mais propensos a desenvolver displasia de alto grau ou câncer. Esses pacientes podem então ser acompanhados por vigilância mais de perto do que outros.
Atualmente, todos os pacientes com esôfago de Barrett, do ponto de vista da vigilância, são tratados da mesma forma. A disponibilidade de biomarcadores separaria (estratificaria) os pacientes de Barrett com base em seu risco de câncer. Essa estratificação permitiria que os médicos fizessem endoscopias de vigilância e biópsias com mais frequência na minoria de pacientes com maior risco de câncer e com menos frequência naqueles com menor risco de câncer.
Outro uso para biomarcadores comprovados seria ajudar a confirmar a interpretação da displasia do patologista em biópsias.
Qual é o risco de desenvolver adenocarcinoma do esôfago na doença de Barrett?
Quando os pacientes com esôfago de Barrett são avaliados como um grupo, o risco de câncer é tão baixo quanto um em 300 pacientes por ano. Isso significa que, se examinássemos 300 pacientes anualmente, um paciente seria diagnosticado com câncer a cada ano. O que realmente precisamos saber é o risco de câncer se nenhuma displasia for encontrada após um ou dois anos de vigilância. Acreditamos que esse risco seria muito menor do que os números citados anteriormente de um em cada 300 pacientes por ano.
Pacientes com displasia de alto grau podem frequentemente ter câncer. Portanto, a primeira ordem de tratamento quando a displasia de alto grau é encontrada é excluir a presença de um adenocarcinoma.
A displasia de baixo grau é muito menos ameaçadora do que a displasia de alto grau, mas não sabemos quanto menos. Na verdade, não temos dados precisos para indicar exatamente qual é o risco de câncer em pacientes com Barrett e displasia de baixo grau.
O diagnóstico de displasia deve ser o mais preciso possível, pois esse diagnóstico pode levar a uma mudança no tratamento ou na intensidade do acompanhamento dos pacientes com esôfago de Barrett. Requer muita experiência para poder fazer um diagnóstico preciso da presença e grau de displasia. Portanto, é uma prática comum e útil pedir a um segundo patologista (ou mesmo um terceiro, se necessário) para revisar as biópsias. A ideia é verificar se há concordância entre os patologistas e/ou obter uma opinião mais experiente sobre a presença e grau de displasia.
Se uma pessoa tem um segmento mais longo de Barrett, pode-se supor que o risco de câncer é maior do que com um segmento mais curto de Barrett. Os dados, no entanto, são controversos a esse respeito. Por essa razão, a prática atual é fazer vigilância de biópsia endoscópica com frequência semelhante em pacientes com esôfago de Barrett de segmento curto e longo.
Quais são os sintomas do esôfago de Barrett?
O esôfago de Barrett não apresenta sintomas únicos. Pacientes com Barrett apresentam sintomas de DRGE (por exemplo, azia, regurgitação, náusea, etc.). A tendência geral é que os pacientes de Barrett tenham DRGE mais grave. No entanto, nem todos os de Barrett têm sintomas marcantes de DRGE, e alguns pacientes são detectados acidentalmente com sintomas mínimos ou inexistentes de DRGE.
A azia é uma sensação de queimação atrás do esterno, geralmente na metade inferior, mas pode se estender até a garganta. Às vezes, é acompanhada de queimação ou dor na boca do estômago logo abaixo de onde termina o esterno. O segundo sintoma mais comum é a regurgitação (backup) de líquido com sabor amargo. Os sintomas da DRGE geralmente são piores após as refeições e quando deitado.
O fluido regurgitado e refluxado ocasionalmente pode entrar nos pulmões ou na laringe, resultando no que chamamos de sintomas extraesofágicos (fora do esôfago) (manifestações) da DRGE. Esses sintomas incluem:
- asma em adulto de início recente,
- bronquite frequente,
- tosse crônica,
- dor de garganta e
- rouquidão.
Por razões não totalmente compreendidas, alguns pacientes com DRGE têm azia mínima, mas experimentam outros sintomas de DRGE, por exemplo, sintomas extraesofágicos.
A DRGE pode resultar em estenoses e ulceração do esôfago. Uma estenose ou estreitamento é devido à cicatrização (fibrose) do esôfago que pode causar dificuldade em engolir (disfagia). A disfagia é sentida como uma gruda (parada) de alimentos sólidos no peito (no esôfago) e líquidos quando o estreitamento é grave. As estenoses podem ser tratadas esticando-as com dilatadores durante a endoscopia. Não tratadas, as estenoses podem promover mais derramamento de alimentos e/ou fluidos gástricos para os pulmões. Raramente, pode ocorrer sangramento gastrointestinal (GI) maciço causado por inflamação do esôfago. Esse sangramento resulta em vômito de sangue ou passagem de fezes pretas ou marrons. Mais comumente, no entanto, um esôfago inflamado pode causar sangramento lento que é detectado quando a anemia (uma baixa contagem de glóbulos vermelhos) é encontrada e/ou as fezes são testadas para sangue.
Como a DRGE com ou sem o esôfago de Barrett tratada ?
Terapia médica (não cirúrgica)
Os tratamentos médicos para os sintomas do esôfago de Barrett são os mesmos da DRGE.
A supressão do ácido é a espinha dorsal do tratamento para a DRGE. Para sintomas leves de refluxo, medicamentos de venda livre são comumente usados, variando de antiácidos a baixas doses de medicamentos chamados antagonistas dos receptores H-2 ou bloqueadores H2. Exemplos de bloqueadores H2 de venda livre são cimetidina (Tagamet) e famotidina (Pepcid, Zantac 360). Para sintomas mais persistentes, doses mais altas (prescritas) dos medicamentos antagonistas do receptor H-2 podem ser usadas, por exemplo:
- cimetidina (Tagamet),
- famotidina (Pepcid, Zantac 360) e
- nizatidina (Axid).
No entanto, para sintomas persistentes que requerem terapia de manutenção (contínua) ou para DRGE complicada com estenoses ou sangramento, os inibidores da bomba de prótons (IBPs) são usados. Exemplos de IPPs são:
- omeprazol (Prilosec, Zegerid),
- lansoprazol (Prevacid),
- pantoprazol (Protonix),
- rabeprazol (Aciphex) e
- esomeprazol (Nexium).
Alguns pacientes precisam tomar apenas um comprimido por dia, enquanto outros precisam de dois comprimidos (dose dupla) para controlar os sintomas. A dose dupla pode ser tomada como um comprimido duas vezes ao dia ou 2 comprimidos uma vez ao dia.
Os IBPs são potentes inibidores da secreção ácida do estômago. Eles são eficazes no alívio da azia e na cicatrização da inflamação esofágica (esofagite) e úlceras esofágicas induzidas pelo refluxo ácido. Os IBPs são bem tolerados com poucos efeitos colaterais. Depois de interromper esses medicamentos, os sintomas de refluxo ácido geralmente se repetem, às vezes com intensidade aumentada. Esse aumento dos sintomas ocorre, em parte, por causa de uma secreção rebote de ácido (hipersecreção ácida), que é uma resposta desencadeada pela recuperação da inibição da secreção de ácido pelo IBP.
A segurança a longo prazo dos IBPs é uma consideração importante. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Esses incluem:
- Losing weight, if overweight.
- Change the diet, by reducing fat, chocolate, caffeine, and acid food and fluids (for example, citrus).
- Stop smoking.
- Avoid excessive alcohol.
- Avoid food and fluids for 90 to 120 minutes before going to bed.
- Elevate the upper body when lying in bed by (for example, putting blocks under the head of the bed).
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
Surgical treatment of GERD, with or without Barrett's esophagus
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
- Have serious complications, such as recurring strictures; ou
- Require high doses of acid-suppressing medications, and want to stop taking these medications.
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new
endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Why is it important to screen patients with GERD to diagnose Barrett's esophagus?
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
Why is it critical to be accurate in the diagnosis of Barrett's esophagus?
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
- One is the location of the lower esophageal sphincter (LES) or gastroesophageal junction.
- The second is the upper end of the squamo-columnar junction (Z line),which now (with Barrett's) is in the esophagus (moved north).
- The third is the location of the biopsies.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
- To avoid concern about long term cancer risk if the diagnosis of Barrett's was incorrectly made.
- To avoid difficulties with insurance that may arise with an incorrect diagnosis of Barrett's esophagus.
- To begin cancer surveillance if the diagnosis of Barrett's is confirmed.
What does endoscopic biopsy surveillance in Barrett's esophagus involve?
Periodic random biopsies
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
Other ways to diagnose dysplasia
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
How is low grade dysplasia managed?
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
How is high grade dysplasia managed?
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
Esophagectomy
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
What are the experimental approaches for treatment of high grade dysplasia?
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy(PDT)
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other methods of ablation
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Endoscopic mucosal resection (EMR)
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
Chemoprevention with drugs
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
What experimental options are there for Barrett's esophagus WITHOUT dysplasia?
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
What does the future hold for Barrett's esophagus?
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
- Standardize the diagnosis of Barrett's, especially to avoid over-diagnosis.
- Standardize how surveillance biopsies are done so that we can "do it right and do it less often," and devote more resources to the next step, which is screening.
- Develop strategies for determining whom to screen and when to screen for the presence of Barrett's esophagus among patients with chronic GERD. At present, most GERD patients with adenocarcinoma of the esophagus have never had an endoscopy to determine whether they had Barrett's esophagus.
- • Look for biomarkers (molecular tests on tissues or in blood) that are able to separate (stratify) patients with the highest risk of cancer and who would need closer follow-up than the majority of Barrett's patients who do not.
- Evaluate the effectiveness and safety of the techniques for ablation and endoscopic mucosal resection (EMR) of Barrett's with and without dysplasia, and carry out long term follow-up studies to determine whether cancer is prevented.
- Evaluate better techniques for targeting biopsies to areas of dysplasia in order to avoid the currently used method of taking random biopsies.
- Evaluate better techniques for staging early cancer with refinements of endoscopic ultrasound and other imaging techniques.
 10% dos pacientes com DRGE desenvolvem esôfago de Barrett, um fator de risco para câncer de esôfago.
10% dos pacientes com DRGE desenvolvem esôfago de Barrett, um fator de risco para câncer de esôfago. 
 DRGE é uma condição na qual o excesso de fluido contendo ácido reflui (flui) de volta para o esôfago, em parte porque o esfíncter esofágico inferior é fraco.
DRGE é uma condição na qual o excesso de fluido contendo ácido reflui (flui) de volta para o esôfago, em parte porque o esfíncter esofágico inferior é fraco.  5 shakes de ganho de peso com comida real (Paleo e SCD)
“Como consigo mais calorias?” é uma pergunta comum neste site. Comer mais carne e alimentos ricos em gordura é o primeiro passo. A segunda mudança fácil de fazer é comer mais refeições todos os dias;
5 shakes de ganho de peso com comida real (Paleo e SCD)
“Como consigo mais calorias?” é uma pergunta comum neste site. Comer mais carne e alimentos ricos em gordura é o primeiro passo. A segunda mudança fácil de fazer é comer mais refeições todos os dias;
 O papel dos mastócitos em nossa saúde
Os mastócitos são células encontradas no tecido conjuntivo em todo o nosso corpo como parte do nosso sistema imunológico. Os mastócitos são particularmente proeminentes nos tecidos do nosso corpo que
O papel dos mastócitos em nossa saúde
Os mastócitos são células encontradas no tecido conjuntivo em todo o nosso corpo como parte do nosso sistema imunológico. Os mastócitos são particularmente proeminentes nos tecidos do nosso corpo que
 As chaves para derrotar doenças digestivas – (não é força de vontade)
A dieta SCD é diferente… Ou é? Recebo muitos e-mails de pessoas que me perguntam o que devem fazer, pois estão pensando em iniciar a Dieta SCD. Parece que a maioria das pessoas intuitivamente adiv
As chaves para derrotar doenças digestivas – (não é força de vontade)
A dieta SCD é diferente… Ou é? Recebo muitos e-mails de pessoas que me perguntam o que devem fazer, pois estão pensando em iniciar a Dieta SCD. Parece que a maioria das pessoas intuitivamente adiv