 10% dei pazienti con GERD sviluppa l'esofago di Barrett, un fattore di rischio per il cancro dell'esofago.
10% dei pazienti con GERD sviluppa l'esofago di Barrett, un fattore di rischio per il cancro dell'esofago.

L'esofago di Barrett non ha sintomi unici. I pazienti con Barrett hanno i sintomi di GERD o reflusso acido include quanto segue:
L'esofago di Barrett è una complicanza della malattia da reflusso gastroesofageo cronica (GERD), principalmente negli uomini bianchi. GERD è una malattia in cui vi è un reflusso di liquido acido dallo stomaco nell'esofago (il tubo di deglutizione). GERD più comunemente provoca bruciore di stomaco.
Ci sono due requisiti per la diagnosi dell'esofago di Barrett. I requisiti richiedono un'endoscopia dell'esofago. Durante l'endoscopia, un lungo tubo flessibile con una luce e una telecamera sulla punta (un endoscopio) viene inserito attraverso la bocca e giù nell'esofago per visualizzare e biopsiare (tessuto campione) il rivestimento dell'esofago. I due requisiti sono:
L'esofago di Barrett è ufficialmente codificato dalla Library of Congress per le ricerche elettroniche della letteratura come esofago di Barrett, ma l'esofago di Barrett (con l'apostrofo "s") è il nome usato universalmente. La condizione prende il nome da un chirurgo, Norman Barrett, che ha descritto la condizione. Tuttavia, si scopre che la sua interpretazione dei risultati non era corretta. Nel 1953, i dottori Allison e Johnstone descrissero effettivamente questa condizione come la intendiamo ora, vale a dire che si stava verificando la metaplasia. (Metaplasia, che è discussa di seguito, è il termine usato quando un tessuto adulto ne sostituisce un altro.) Tuttavia, la condizione è stata immortalata con il nome di Barrett.
Inizialmente, si pensava che l'esofago di Barrett fosse costituito da tessuto dello stomaco (gastrico) che sostituiva il solito tessuto squamoso che riveste l'esofago. Tuttavia, a metà degli anni '70, il dottor Paull e colleghi hanno pubblicato un articolo in cui hanno descritto la mucosa (rivestimento interno) dell'esofago di Barrett in modo più dettagliato di quanto non fosse stato fatto in precedenza. Hanno sottolineato che l'esofago di Barrett consisteva in una metaplasia in cui le cellule normali che rivestono l'esofago erano sostituite da una miscela di cellule di rivestimento gastriche e intestinali. Le cellule di rivestimento di tipo intestinale sono anche chiamate cellule colonnari specializzate che includono cellule caliciformi. Per un certo numero di anni, alcuni scienziati hanno pensato che esistessero due tipi di Barrett; uno in cui il rivestimento normale è stato sostituito solo con cellule di tipo gastrico (gastrico) e il secondo in cui erano presenti cellule intestinali. Tuttavia, la convinzione attuale è che solo la presenza di cellule caliciformi di tipo intestinale stabilisca la diagnosi dell'esofago di Barrett, indipendentemente da quali altri tipi cellulari siano presenti.
Il motivo del grande interesse per l'esofago di Barrett è che è associato ad un aumentato rischio di cancro dell'esofago. Il tipo di cancro che si verifica nei pazienti con Barrett è l'adenocarcinoma, che nasce dal tessuto intestinale metaplastico. Il solito cancro dell'esofago che non è associato a quello di Barrett è il carcinoma squamoso, che deriva dal rivestimento delle cellule squamose che è normalmente presente nell'esofago. La connessione tra l'adenocarcinoma dell'esofago e l'esofago di Barrett è ora chiara e l'adenocarcinoma dell'esofago sta aumentando di frequenza nella maggior parte dei paesi dell'emisfero occidentale.
La buona notizia, tuttavia, è che il cancro si verifica in relativamente pochi pazienti con esofago di Barrett. Tuttavia, la sfida principale in questa condizione è osservare i primi segni premonitori di cancro eseguendo biopsie a intervalli regolari durante l'endoscopia. Questa pratica è chiamata sorveglianza ed è simile, in linea di principio, alla sorveglianza nelle donne per il cancro della cervice, in cui i pap test vengono eseguiti a intervalli regolari.
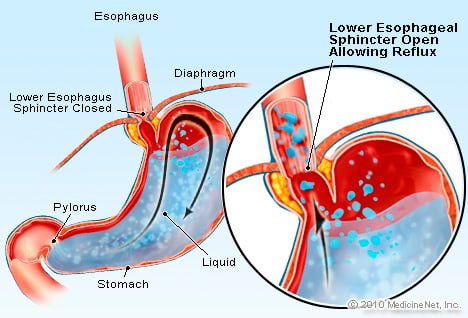
 GERD è una condizione in cui un liquido contenente acido eccessivo refluisce (rifluisce) nell'esofago, in parte perché lo sfintere esofageo inferiore è debole.
GERD è una condizione in cui un liquido contenente acido eccessivo refluisce (rifluisce) nell'esofago, in parte perché lo sfintere esofageo inferiore è debole. GERD provoca l'esofago di Barrett. L'esofago è un tubo muscolare che si trova nel torace e serve a trasferire il cibo dalla bocca allo stomaco. Lo sfintere esofageo inferiore (LES) è una valvola che si trova alla giunzione dello stomaco con l'esofago. La sua funzione è impedire che l'acido e altri contenuti dello stomaco tornino nell'esofago. La malattia da reflusso gastroesofageo è una condizione in cui il fluido contenente acido eccessivo refluisce (fluisce) nell'esofago, in parte perché lo sfintere esofageo inferiore è debole. La debolezza del LES può essere correlata, in parte, al fatto che praticamente tutti i pazienti con GERD hanno un'ernia iatale. Nei pazienti con ernia iatale, i pochi centimetri superiori dello stomaco scivolano avanti e indietro tra l'addome e il torace attraverso il diaframma. Questo scorrimento può interferire con il funzionamento dello sfintere come barriera al reflusso dallo stomaco all'esofago.
In precedenza, il termine ernia veniva usato al posto di GERD per spiegare ai pazienti la base dei loro sintomi (di solito bruciore di stomaco) perché praticamente tutti i pazienti con GERD hanno ernie iatali. GERD, tuttavia, è il termine più accurato. Sebbene le ernie iatali siano estremamente comuni nella popolazione, solo un piccolo numero di persone con ernia iatale sviluppa GERD. In altre parole, la presenza di un'ernia iatale non significa che la persona svilupperà GERD. D'altra parte, tuttavia, se una persona ha GERD, l'ernia iatale è quasi sempre presente.
Pertanto, l'esofago di Barrett è causato da un reflusso acido cronico (della durata di molti anni) e solitamente grave. In alcuni pazienti con GERD, l'esofago reagisce alla lesione ripetuta del fluido acido modificando il tipo di cellule che lo rivestono da squamose (cellule normali) a colonnari (cellule di tipo intestinale). Si ritiene che questa trasformazione, chiamata metaplasia, sia una risposta protettiva perché l'epitelio colonnare specializzato (epitelio significa rivestimento) nell'esofago di Barrett è più resistente alle lesioni da acido rispetto all'epitelio squamoso.
Il liquido nello stomaco contiene acido prodotto dallo stomaco. In aggiunta, tuttavia, il fluido può contenere acidi biliari (dalla bile prodotta dal fegato) ed enzimi (prodotti dal pancreas) che sono refluiti dal duodeno nello stomaco. (Il duodeno è la prima parte dell'intestino tenue appena oltre lo stomaco.) L'acido che rifluisce dallo stomaco all'esofago è dannoso per l'esofago. Ci sono alcune prove, tuttavia, che la bile e gli enzimi pancreatici combinati con l'acido possono essere più dannosi del solo acido.
Una percentuale significativa di individui con sintomi cronici di GERD sviluppa l'esofago di Barrett ed è più comune nelle popolazioni maschili caucasiche. Tuttavia, non tutti quelli con GERD hanno sintomi di GERD. Pertanto, alcune persone con Barrett non sono consapevoli di avere il Barrett perché hanno GERD senza alcun sintomo o hanno sintomi molto lievi e rari.
Non è chiaro perché l'esofago di Barrett sia così straordinariamente più comune nei maschi bianchi che in qualsiasi altro gruppo. Ad esempio, sebbene le donne e gli afroamericani non sembrino essere protetti dallo sviluppo di GERD, sono in gran parte protetti (soprattutto gli afroamericani) dallo sviluppo dell'esofago di Barrett e del cancro di Barrett (adenocarcinoma). Ci sono prove che nell'emisfero occidentale, il cancro esofageo e il cancro della giunzione gastroesofagea (chiamato cancro del cardias) stanno aumentando di frequenza, forse più di qualsiasi altro cancro del tratto gastrointestinale. (Tuttavia, il cancro del colon è ancora molto più comune del cancro esofageo.)
L'esofago di Barrett può funzionare in alcune famiglie ed essere geneticamente determinato. Sono in corso studi per determinare se in queste famiglie è possibile trovare geni o marcatori che prevedano lo sviluppo dell'esofago di Barrett nella popolazione generale. In queste famiglie con Barrett così come con Barrett nella popolazione generale, GERD è il denominatore comune. Tuttavia, la domanda è perché il Barrett si verifica più comunemente in queste famiglie rispetto ad altre con GERD relativamente grave, ma senza alcuna associazione familiare.
Ripeto, il primo criterio per la diagnosi dell'esofago di Barrett è il riscontro all'endoscopia di un rivestimento rosa nell'esofago dove normalmente non si vede. Questo rivestimento anormale può apparire circonferenzialmente come una fascia, simile a una lingua o come isole. Il secondo criterio è che le biopsie del rivestimento rosa rivelino la caratteristica mucosa intestinalizzata (il rivestimento normalmente visto nell'intestino) con le tipiche cellule caliciformi. Le biopsie esofagee si ottengono durante un'endoscopia. Un'endoscopia gastrointestinale superiore è una procedura in cui il medico inserisce un lungo tubo flessibile (endoscopio) attraverso la bocca e giù nell'esofago per visualizzare direttamente il rivestimento dell'esofago. Durante lo stesso esame endoscopico, possono essere visualizzati anche lo stomaco e il duodeno. Attraverso l'endoscopio è possibile ottenere più piccoli campioni (biopsie) del tessuto epiteliale di rivestimento.
Come accennato in precedenza, il processo di sostituzione di un tipo di rivestimento tissutale con un altro è chiamato metaplasia. Nello stomaco e nell'intestino, la metaplasia è una risposta comune a determinati tipi di lesioni. Come ha affermato Henry Appelman, un patologo:"Quando l'intestino è sotto stress, vuole essere qualcos'altro". Altri esempi di metaplasia in cui un rivestimento ne sostituisce un altro sono:(1) nello stomaco dove l'infiammazione cronica (gastrite) può provocare un rivestimento di tipo intestinale che sostituisce parti del normale rivestimento dello stomaco; e (2) nel duodeno (appena oltre lo stomaco nell'intestino) dove si verificano ulcere peptiche e il rivestimento intestinale che circonda l'ulcera si trasforma in rivestimento di tipo gastrico.
Riteniamo che il processo di metaplasia sia una risposta protettiva o adattativa alla lesione del rivestimento. Tuttavia, lo svantaggio della metaplasia è che nell'esofago di Barrett comporta un piccolo ma netto aumento del rischio di diventare canceroso. Non tutte le metaplasie hanno un aumentato rischio di cancro. Ad esempio, delle due metaplasie di cui al paragrafo precedente, la metaplasia intestinale nello stomaco può portare al cancro, ma non la metaplasia intestinale nel duodeno.
Il processo di sviluppo del Barrett inizia alla giunzione dello stomaco e dei rivestimenti esofagei. L'esofago è normalmente rivestito da un epitelio squamoso o da uno strato di rivestimento. Questo epitelio squamoso ha un aspetto bianco perla, mentre il rivestimento dello stomaco e dell'intestino ha un colore più rosa salmone perché è un epitelio colonnare piuttosto che un epitelio squamoso. L'epitelio squamoso è costituito da cellule squamose piatte, simili alle cellule della pelle. Lo stomaco o il rivestimento gastrico è costituito da cellule colonnari più alte come si vede al microscopio. La giunzione dell'epitelio squamoso dell'esofago e dell'epitelio colonnare gastrico si verifica alla giunzione dell'esofago e dello stomaco dove, come ricordi, si trova lo sfintere esofageo inferiore. Il bordo comune (interfaccia) di questi due rivestimenti è spesso indicato come la linea Z, perché se esaminato durante un'endoscopia, ha un aspetto a zig zag.
Con la lesione progressiva dell'esofago, si verifica metaplasia e il tessuto metaplastico si sposta lungo l'esofago per una distanza che varia da persona a persona, di solito da circa 0,5 a 2,5 pollici (da circa 1 a 6 centimetri). Non è noto il tipo di cellula che dà origine al tessuto metaplastico.
L'esofago di Barrett è spesso classificato in Barrett a segmento corto o lungo, in base alla lunghezza dell'esofago colpito. Il segmento corto di Barrett si riferisce generalmente a un coinvolgimento di 3 centimetri o meno, mentre il segmento lungo significa un coinvolgimento di oltre 3 centimetri dell'esofago. È interessante notare che, una volta diagnosticato l'esofago di Barrett in un paziente, il rivestimento metaplastico non sembra progredire ulteriormente nell'esofago se il paziente viene trattato per GERD. Pertanto, nel tempo, la durata del coinvolgimento con Barrett rimane generalmente la stessa.
Se le biopsie vengono prelevate da pazienti con GERD che hanno una linea Z che appare normale (nessuna evidenza visibile dell'esofago di Barrett), fino al 30% mostrerà lo stesso tipo di metaplasia intestinale con cellule caliciformi di quelle che si vedono nell'esofago di Barrett. Tuttavia, non eseguiamo regolarmente la biopsia delle linee Z che appaiono normali per cercare questo cambiamento, né eseguiamo la sorveglianza quando lo troviamo lì. Il motivo è che la metaplasia intestinale limitata della regione della giunzione gastroesofagea nella GERD sembra verificarsi con una frequenza simile nelle donne e negli afroamericani come negli uomini bianchi, tuttavia il rischio di esofago di Barrett conclamato è molto inferiore rispetto agli uomini bianchi.
Pertanto, la presenza di metaplasia su una biopsia di routine di una normale linea Z che appare nella GERD non dovrebbe portare ad alcun cambiamento nella gestione. Inoltre, il ritrovamento di cellule caliciformi in questo contesto non dovrebbe essere etichettato, come alcuni hanno suggerito, come il segmento ultracorto di Barrett. Il motivo principale per non etichettarlo come di Barrett è che il termine di Barrett implica un aumento del rischio di cancro e non ci sono prove che questo risultato sia associato a un aumento del rischio di cancro.
Il tipo di cancro che si verifica con l'esofago di Barrett è l'adenocarcinoma. Il cancro derivante dal rivestimento squamoso dell'esofago è chiamato cancro squamoso o carcinoma. Tra i caucasici, il tasso (frequenza nel tempo) di cancro squamoso è in diminuzione rispetto all'adenocarcinoma associato a Barrett. Altri gruppi razziali (ad esempio, gli afroamericani), tuttavia, non hanno registrato lo stesso tasso di declino del cancro squamoso rispetto all'adenocarcinoma.
Il fumo e l'eccessiva ingestione di alcol sono fattori di rischio definiti per i tumori squamosi. Sono anche fattori di rischio per l'adenocarcinoma visto nell'esofago di Barrett. In questa situazione, tuttavia, non è chiaro se il fumo e l'alcol aumentino il rischio di adenocarcinoma rendendo la GERD più grave o se il fumo e l'alcol abbiano un effetto cancerogeno più diretto, come accade nel cancro squamoso. I tumori a cellule squamose sono diventati sempre meno comuni, mentre le diagnosi di adenocarcinoma sono aumentate. L'incidenza dell'adenocarcinoma nei maschi bianchi è aumentata più rapidamente che in altri gruppi etnici.
Per tutto il resto di questa sezione, il termine cancro esofageo si riferirà all'adenocarcinoma derivante dall'esofago di Barrett.
Il cancro della giunzione gastroesofagea è anche chiamato cancro del cardias perché la regione in cui l'esofago incontra lo stomaco è chiamata cardias. Questo cancro, come l'adenocarcinoma associato a Barrett, si trova prevalentemente nei maschi bianchi, sembra aumentare di frequenza alla stessa velocità del cancro esofageo ed è associato a GERD cronico. Pertanto, è stato ipotizzato che il cancro del cardias inizi da segmenti corti (ad esempio, 1-2 cm) di Barrett. Al momento della diagnosi di cancro, tuttavia, il tumore potrebbe essersi diffuso oltre il segmento corto di Barrett e potrebbe sembrare nel cardias. Questa speculazione sull'origine del cancro del cardias, tuttavia, resta da dimostrare.
Un aumento della frequenza dell'adenocarcinoma esofageo è stato osservato per almeno 20 anni, principalmente nei maschi bianchi. Un indizio sul motivo di questa tendenza potrebbe essere correlato a una diminuzione della frequenza di H. pylori infezione dello stomaco. In altre parole, le persone con cancro di Barrett, incluso il cancro del cardias, sembrano avere tassi più bassi di H. pylori infezione rispetto ad altri della stessa età e sesso nella stessa popolazione.
H. pylori è un tipo di batterio che è una delle principali cause di ulcere. È un'infezione molto comune in tutto il mondo e non causa sintomi nella stragrande maggioranza delle persone colpite. Tuttavia, alcune persone con H. pylori sviluppare ulcera peptica dello stomaco e del duodeno. Queste ulcere vengono trattate eliminando i batteri, che a loro volta prevengono la ricaduta delle ulcere.
Se H. pylori se non trattata, provoca una progressiva infiammazione dello stomaco (gastrite) che è associata a una riduzione della secrezione acida e possibilmente a un minore reflusso di acido nell'esofago. In molte aree del mondo, questa infezione sta diminuendo di frequenza, presumibilmente a causa di migliori misure di salute pubblica. Pertanto, è possibile che l'effetto protettivo (come la diminuzione della produzione di acido) dell'H cronico. pylori l'infezione è diminuita. In altre parole, con meno H. pylori gastrite, lo stomaco produce più acido e c'è più acido da refluire nell'esofago. Allo stesso tempo, siamo più predisposti al reflusso nei nostri anni da senior. Sebbene questo non sia un problema risolto, la frequenza decrescente di H. pylori l'infezione può essere una delle ragioni della crescente frequenza dell'adenocarcinoma associato a Barrett.
La displasia è un cambiamento nelle cellule che rivestono l'esofago in cui le cellule mostrano effettivamente cambiamenti anormali nella loro struttura e aspetto. Quando questi cambiamenti diventano abbastanza gravi (passando da displasia di basso grado a di alto grado) le cellule iniziano ad apparire maligne (come le cellule tumorali). Tuttavia, a differenza del cancro, queste cellule rimangono al loro posto e non invadono i tessuti al di fuori del rivestimento. La displasia si verifica come una serie di cambiamenti cellulari mentre l'esofago di Barrett progredisce verso il cancro associato a Barrett. I pazienti con Barrett vengono monitorati con endoscopia e biopsie (sorveglianza) per rilevare questi cambiamenti cellulari (displasia) o, nel peggiore dei casi, un cancro precoce in modo che possano essere trattati. Attualmente, non c'è modo di prevedere quali pazienti con esofago di Barrett svilupperanno displasia.
La displasia è stata anche identificata adiacente a tumori del tratto gastrointestinale diversi dall'adenocarcinoma esofageo. Ad esempio, la displasia si trova nella metà dei casi di cancro allo stomaco e nel cancro del colon, in cui la displasia è visibile come i cosiddetti polipi adenomatosi. Inoltre, la displasia è lo stesso cambiamento cellulare di preallarme che i patologi cercano nei PAP test della cervice che predicono il cancro cervicale.
La displasia è considerata premaligna. Ciò significa che se la displasia è stata dimostrata in diverse occasioni, si ritiene che il paziente svilupperà il cancro se vive abbastanza a lungo. La displasia è classificata come di alto grado o di basso grado. Quando viene diagnosticata la displasia di alto grado, il cancro può essere già presente e, in caso contrario, il rischio di sviluppare il cancro prima è maggiore rispetto ai gradi inferiori di displasia.
Nelle biopsie di follow-up di pazienti con displasia, la condizione potrebbe non essere rilevata di nuovo in alcuni pazienti, mentre in altri si riscontrano bassi gradi di displasia. Questa assenza o diminuzione della displasia può essere dovuta a fattori come variazioni del campionamento, rimozione di piccoli focolai (gruppi di cellule) di displasia con la biopsia iniziale o effettiva inversione biologica. I motivi esatti sono sconosciuti.
Utilizzando tecniche molecolari, alcuni cambiamenti indicati come biomarcatori possono essere rilevati nei campioni bioptici prima che si sviluppi la displasia. Questi cambiamenti sono simili a quelli che si osservano in altri tumori. I biomarcatori includono i cambiamenti nel contenuto di DNA delle cellule, nei geni e nei cromosomi e nei fattori di crescita. È possibile dimostrare che alcuni di questi biomarcatori compaiono prima e durante l'insorgenza della displasia. L'obiettivo finale è trovare un marker magico che possa dirci quali pazienti tra quelli senza displasia o displasia di basso grado hanno maggiori probabilità di sviluppare displasia o cancro di alto grado. Tali pazienti possono quindi essere seguiti da una sorveglianza più ravvicinata di altri.
Attualmente, tutti i pazienti con esofago di Barrett, dal punto di vista della sorveglianza, sono trattati allo stesso modo. La disponibilità di biomarcatori separerebbe (stratificherebbe) i pazienti di Barrett in base al loro rischio di cancro. Tale stratificazione consentirebbe ai medici di eseguire endoscopie e biopsie di sorveglianza con maggiore frequenza nella minoranza di pazienti a maggior rischio di cancro e meno frequentemente in quelli a cui si prevede un minor rischio di cancro.
Un altro uso di biomarcatori comprovati sarebbe quello di aiutare a confermare l'interpretazione del patologo della displasia sulle biopsie.
Quando i pazienti con esofago di Barrett vengono valutati come gruppo, il rischio di cancro è inferiore a uno su 300 pazienti all'anno. Ciò significa che se esaminassimo 300 pazienti all'anno, si scoprirebbe che un paziente ha il cancro ogni anno. Quello che dobbiamo davvero sapere è il rischio di cancro se non viene rilevata displasia dopo uno o due anni di sorveglianza. La nostra convinzione è che questo rischio sarebbe molto inferiore alle cifre precedentemente citate di un paziente su 300 all'anno.
I pazienti con displasia di alto grado possono spesso essere affetti da cancro. Pertanto, il primo ordine di gestione quando si riscontra una displasia di alto grado è escludere la presenza di un adenocarcinoma.
La displasia di basso grado è molto meno minacciosa della displasia di alto grado, ma non sappiamo quanto meno. In effetti, non abbiamo dati precisi per indicare quale sia il rischio di cancro nei pazienti con displasia di Barrett e di basso grado.
La diagnosi di displasia dovrebbe essere il più precisa possibile perché questa diagnosi può richiedere un cambiamento nel trattamento o nell'intensità del follow-up dei pazienti con esofago di Barrett. Richiede una grande esperienza per poter fare una diagnosi precisa della presenza e del grado di displasia. Pertanto, è pratica comune e utile chiedere a un secondo patologo (o anche a un terzo, se necessario) di rivedere le biopsie. L'idea è di vedere se c'è un accordo tra i patologi e/o di avere un parere più esperto sulla presenza e il grado di displasia.
Se una persona ha un segmento più lungo di Barrett, si potrebbe supporre che il rischio di cancro sia maggiore rispetto a un segmento di Barrett più corto. I dati, tuttavia, sono controversi al riguardo. Per questo motivo, la pratica attuale consiste nell'effettuare la sorveglianza endoscopica della biopsia con frequenza simile in pazienti con esofago di Barrett a segmento corto e lungo.
L'esofago di Barrett non ha sintomi unici. I pazienti con Barrett hanno i sintomi di GERD (ad esempio, bruciore di stomaco, rigurgito, nausea, ecc.). La tendenza generale è che i pazienti di Barrett abbiano una GERD più grave. Tuttavia, non tutti i Barrett hanno sintomi marcati di GERD e alcuni pazienti vengono rilevati accidentalmente con sintomi minimi o assenti di GERD.
Il bruciore di stomaco è una sensazione di bruciore dietro lo sterno, di solito nella metà inferiore, ma può estendersi fino alla gola. A volte, è accompagnato da bruciore o dolore alla bocca dello stomaco appena sotto dove finisce lo sterno. Il secondo sintomo più comune è il rigurgito (backup) del liquido dal sapore amaro. I sintomi di GERD spesso peggiorano dopo i pasti e quando si è sdraiati.
Il fluido rigurgitato e rigurgitato occasionalmente può entrare nei polmoni o nella casella vocale (laringe), provocando quelli che vengono chiamati sintomi (manifestazioni) extraesofagei (al di fuori dell'esofago). Questi sintomi includono:
Per ragioni non completamente comprese, alcuni pazienti con GERD hanno un bruciore di stomaco minimo ma manifestano altri sintomi di GERD, ad esempio sintomi extraesofagei.
GERD può provocare stenosi e ulcerazioni dell'esofago. Una stenosi o un restringimento è dovuto a cicatrici (fibrosi) dell'esofago che possono causare difficoltà di deglutizione (disfagia). La disfagia è percepita come un'adesione (arresto) di cibo solido nel torace (nell'esofago) e liquidi quando il restringimento è grave. Le stenosi possono essere trattate allungandole con dilatatori durante l'endoscopia. Se non trattate, le stenosi possono favorire una maggiore fuoriuscita di cibo e/o liquidi gastrici nei polmoni. Non comunemente, può verificarsi un'emorragia gastrointestinale (GI) massiccia causata dall'infiammazione dell'esofago. Tale sanguinamento provoca vomito di sangue o il passaggio di feci nere o marroni. Più comunemente, tuttavia, un esofago infiammato può causare un'emorragia lenta che viene rilevata quando viene rilevata anemia (un basso numero di globuli rossi) e/o si esegue il test del sangue nelle feci.
I trattamenti medici per i sintomi dell'esofago di Barrett sono gli stessi di quelli per GERD.
La soppressione dell'acido è la spina dorsale del trattamento per GERD. Per i sintomi da reflusso lievi, vengono comunemente usati farmaci da banco, che vanno dagli antiacidi a basse dosi di farmaci chiamati antagonisti del recettore H-2 o bloccanti H2. Esempi di anti-H2 da banco sono la cimetidina (Tagamet) e la famotidina (Pepcid, Zantac 360). Per sintomi più persistenti, possono essere utilizzate dosi più elevate (prescrivibili) dei farmaci antagonisti del recettore H-2, ad esempio:
Tuttavia, per i sintomi persistenti che richiedono una terapia di mantenimento (in corso) o per GERD complicata con stenosi o sanguinamento, vengono utilizzati gli inibitori della pompa protonica (PPI). Esempi di PPI sono:
Alcuni pazienti devono assumere solo una pillola al giorno, mentre altri necessitano di due compresse (una doppia dose) per controllare i sintomi. La doppia dose può essere assunta come una pillola due volte al giorno o 2 compresse una volta al giorno.
I PPI sono potenti inibitori della secrezione acida dallo stomaco. Sono efficaci nell'alleviare il bruciore di stomaco e la guarigione dell'infiammazione esofagea (esofagite) e delle ulcere esofagee indotte dal reflusso acido. I PPI sono ben tollerati con pochi effetti collaterali. Dopo l'interruzione di questi farmaci, i sintomi del reflusso acido di solito si ripresentano, a volte con maggiore intensità. Questo aumento dei sintomi si verifica, in parte, a causa di un rimbalzo della secrezione di acido (ipersecrezione acida), che è una risposta provocata dal recupero dall'inibizione della secrezione di acido da parte del PPI.
La sicurezza a lungo termine dei PPI è una considerazione importante. Although certain stomach tumors (carcinoids) were reported in experiments with older female rats, similar tumors have not been observed in people after more than 15 years of PPI use. In some people on long-term PPI therapy, small benign polyps (fundic gland polyps) may develop in the upper half of the stomach. However, these polyps do not require follow-up or biopsy because they remain benign (do not become malignant) and cause no problems. Long-term use also is associated with a slightly increased risk of hip fractures in people older than 50 years, and poor absorption of vitamin B12.
The main point to remember about PPIs is that patients should never abruptly stop them. When PPIs are discontinued, the dose should be gradually decreased (tapered). Tapering the dose minimizes the rebound hypersecretion that can occur when PPIs are stopped. If a patient is hospitalized and cannot eat (or take pills), intravenous acid-suppressing drugs at higher doses should be given. Gradual lowering (tapering) of the dose of PPIs should be done when these drugs are to be discontinued after fundoplication (anti-reflux surgery) operations for GERD.
In addition to drug therapy, certain lifestyle maneuvers are very important. Questi includono:
A number of drugs, including tricyclic antidepressants and calcium channel blockers, may promote gastroesophageal reflux. Therefore, if an alternative medication can be substituted for these drugs, this may help in the management of reflux. Patients with GERD should consult their physicians regarding medications that can promote reflux, and if alternatives are available.
Adjunctive (supplementary) drug therapy has been used in the past for patients whose symptoms are not easily controlled with double daily dose of a PPI. The supplementary drugs commonly used are called prokinetics. These drugs work by accelerating gastric emptying so that there is less food and fluid in the stomach for reflux. Cisapride (Propulsid) was the most commonly used drug in this class, but it was taken off the market because of adverse cardiac effects. Metoclopramide (Reglan) is another prokinetic agent, but it is approved only for short term use and can cause drowsiness, restlessness and more important neurological complications. Although other prokinetic drugs are available, none have had the kind of scrutiny in GERD as did cisapride. One drug that has similar actions as cisapride is domperidone (Motilium). It is available in many countries, but has not been approved by the Food and Drug Administration (FDA) in the U.S.
GERD, with or without the presence of Barrett's esophagus, sometimes is treated by anti-reflux surgery. This operation, called fundoplication, is done to stop the reflux of acid. Fundoplication is not done for Barrett's esophagus itself. The operation involves wrapping the upper stomach (the fundus) around the lower end of the esophagus. The purpose of the wrap is to tighten the lower esophageal sphincter (LES) in order to prevent the reflux of stomach contents into the esophagus. There is no evidence that anti-reflux surgery, or for that matter, acid suppression therapy with drugs, decreases the risk of esophageal cancer among patients with Barrett's. This doesn't mean that the possibility is not affected, but it would take long-term studies to prove that either medical or surgical treatment decreases the risk of cancer, and such studies are not likely to be done.
Candidates for the fundoplication operation are patients with GERD who:
Today, this surgery is usually done laparoscopically without the need for a large incision. Therefore, patients have a much shorter recovery time and can be discharged home within a few days. In some patients, for technical reasons, laparoscopic surgery cannot be done, and the conventional open operation is necessary.
A number of new endoscopic approaches are being evaluated to replace surgery (fundoplication) for the treatment of GERD. The idea is to endoscopically tighten up the junction between the stomach and esophagus to prevent reflux. The tightening is done during upper GI endoscopy by, for example, internally sewing (suturing) or clipping the region of the lower esophageal sphincter. As more data has become available showing that these techniques are as effective as fundoplication, they are increasingly being used as an option for managing these patients.
Unfortunately, most cancers of the esophagus are detected too late to be treated effectively. By the time cancer-related symptoms of chest pain, weight loss, and progressive difficulty in swallowing (dysphagia) lead to the diagnosis, the cancer has already spread beyond the esophagus to other organs. Indeed, there is evidence that survival is markedly improved in cancers detected during the course of surveillance for dysplasia or cancer in Barrett's esophagus as compared with survival in cancers detected after cancer symptoms prompted medical attention. Therefore, physicians want to make the diagnosis of Barrett's in GERD patients and then begin surveillance for cancer in such patients.
The problem is that only a small percentage of all patients with adenocarcinomas of the esophagus or cardia have had an endoscopy to show that they have Barrett's esophagus. The challenge is to identify those GERD patients who have Barrett's by screening patients with chronic GERD. Yet, sufficient research has not been done to establish guidelines for selecting which patients with GERD should be screened by endoscopy.
For now, until more data becomes available, it seems reasonable that if a patient with GERD cannot be taken off acid suppressing drugs after two to three years (because of persistent symptoms), an endoscopy should be done to see if Barrett's esophagus is present. One endoscopy per lifetime in patients with GERD may be sufficient to screen for Barrett's.
When a patient is referred for endoscopy in which screening for Barrett's esophagus is to be done, it is important that any inflammation or ulcerations first be healed with the help of acid-suppressing drugs given for at least six weeks. Most commonly this is a double daily dose of a PPI. There are two reasons to eliminate the inflammation first before diagnosing Barrett's. One is that Barrett's can be hidden beneath the inflamed, ulcerated lining. The second is that the changes that occur with inflammation of the esophageal lining may mimic dysplasia and, therefore, may lead to a falsely positive diagnosis of dysplasia.
In the initial diagnosis of Barrett's esophagus, the endoscopist (the doctor performing endoscopy) needs to provide the pathologist with three landmarks so that a precise diagnosis of Barrett's can be made.
The reason that such precise descriptions need to be made is because a false positive diagnosis of Barrett's may have serious implications. Thus, the diagnosis of Barrett's esophagus can lead to higher cost of obtaining life, health, and disability insurance. On the other hand, it's important to know when Barrett's is, in fact, present so that the patient can be enrolled in a proper surveillance program.
If the diagnosis of Barrett's esophagus is uncertain or equivocal, it is worthwhile obtaining a second opinion with specialists in a center that has extensive experience with Barrett's. There are at least three reasons for obtaining additional consultation:
In established Barrett's esophagus, endoscopic surveillance is done at periodic intervals to look for dysplasia. At the time of endoscopy, many biopsies are taken of the Barrett's mucosa. The recommended approach is to do four mucosal biopsies (one in each quadrant of the circumference of the esophagus) at the junction of the stomach and esophagus, and four more biopsies (again, one in each quadrant) should be repeated every two centimeters (about 3/4 inch) proximally until the length of the Barrett's has been completely biopsied. If available, a large forceps (the so-called jumbo forceps) is desirable to procure biopsy specimens.
The current trend is to increase the surveillance intervals in patients who do not have dysplasia. For example, the approach may be to do the surveillance biopsies initially and then a year later. If no dysplasia is found, the surveillance can be done every three years. Other doctors would do it every two years. The bottom line for endoscopists doing surveillance, however, is:"Do it right so we can do it less often." There is some evidence showing that patients with cancers found during the course of surveillance have a better survival rate than those who come to the doctor because of cancer symptoms without any previous surveillance. The ultimate proof that surveillance works, however, will be obtained only when surveillance is applied to a large population at risk and not just to those who seek medical attention. The same issues pertain to other cancer screening tests (such as, mammography and prostate cancer screening).
The problem is that onlya small percentage of patients who undergo surgery for esophageal adenocarcinoma had been diagnosed with Barrett's esophagus preoperatively. Thus, only the 5% with known Barrett's were eligible for surveillance before their surgery. The challenge is not to do more surveillance, but to conduct more screening to identify those who have Barrett's esophagus in the population with chronic GERD.
There is great interest in developing techniques that would use targeted, rather than random biopsies in identifying areas of dysplasia or early cancer. Dysplasia often is endoscopically invisible, which means that it can't be seen just by looking at the esophageal lining through the endoscope. So, different optical enhancing techniques are being evaluated. The idea is to highlight the areas of dysplasia so that targeted biopsies can be obtained. These optical methods include the use of dye sprays (chromoendoscopy), spectrophotometry to measure light wave intensity, and a technique called optical coherence tomography. These procedures, however, remain experimental at present.
Low grade dysplasia is managed by continuing endoscopic biopsy surveillance. For these patients, however, the follow-up interval is shortened from every two to three years (which is done for Barrett's with no dysplasia) to every six months for an indefinite period of time.
Esophagectomy is not considered for low grade dysplasia unless the patient develops high grade dysplasia or cancer during the surveillance.
The most common standard by which treatments for cancer or related disorders, such as dysplasia, are measured is by the five-year outcome. Esophagectomy (surgical removal of the esophagus) improves the five-year survival rate.
The finding of high grade dysplasia in Barrett's may mean that cancer already is present. For this reason, when high grade dysplasia is found, the next step is to repeat the endoscopy and take more biopsies. For this purpose, the recommendation is to take four biopsies (one from each quadrant) every one centimeter rather than every two centimeters. If the biopsy findings again reveal just high grade dysplasia, there are a number of management options, including esophagectomy, continued biopsy surveillance, and experimental approaches.
Endoscopic ultrasound (EUS) is invaluable in the staging of early cancers to determine the depth of their penetration into surrounding tissue. It also can be used to determine if dysplastic tissue has become a cancer. One sign of this would be if the EUS shows there is invasion of the surrounding tissue. This technique uses endoscopes as dedicated ultrasound devices. In other words, these endoscopes are used only for doing endoscopic ultrasound. In other words, these endoscopes are used only for doing endoscopic ultrasound. These instruments can see through the wall of the esophagus using sound waves with much greater accuracy than, for example, a computerized tomographic (CT) scan. Endoscopic ultrasound is available in most centers that specialize in Barrett's esophagus and/or esophageal cancer.
The gold standard for the management of high grade dysplasia is esophagectomy. Esophagectomy involves total removal of the esophagus except for a very short cuff of esophagus at its upper end. The esophagus is replaced with a segment of colon, or stomach is brought up under the breastbone and attached to the remaining cuff of the esophagus. Patients with Barrett's awaiting an esophagectomy should seek an experienced surgeon with a good reputation. This is a major operation which should only be done by a surgeon experienced in this type of procedure. They should interview the surgeon about his/her results. There is no validated or magic annual number of operations that provides enough surgical experience, but some surgeons believe it should be at least 20 per year. What is also important is not just the experience with the actual surgery, but also the experience of the team involved in the pre and post operative care.
The operative death rate (mortality) associated with esophagectomy for high grade dysplasia and early cancer is very low. However, in the postoperative period, a host of complications (operative morbidity) may occur, most of which are transient (self-limited). These complications may include delayed gastric emptying of food, temporary hoarseness, leaks where the reconstruction is performed, and strictures of the esophagus (narrowed areas caused by scarring).
Follow-up biopsy surveillance, and esophagectomy ONLY if cancer is found
Some patients with high grade dysplasia opt to have a close follow-up rather than to proceed directly to major surgery. In these individuals, endoscopic biopsy surveillance is done initially every three months for at least a year and then less often (for example, every four to six months). The understanding is that surgery (esophagectomy) will be done if carcinoma were found during the course of the follow-up. This has not been a universally popular approach except at a few centers. It requires a commitment on the part of the endoscopist to do meticulous surveillance biopsies frequently. It also requires that the patient be reconciled with the frequent follow-up procedures and with the attendant uncertainty for what the future holds.
Several experimental options are available. Patients considering these experimental treatments should seek out a research team that is doing studies with these techniques. For example, with these treatments, some patients need to be retreated, but long-term studies are needed to define how often retreatment is needed. Nevertheless, because they avoid the need for esophagectomy, these techniques may eventually prove to be ideal for patients who are medically not fit for surgery.
Ablation therapy involves the removal of the target tissue (for example, Barrett's mucosa, high grade dysplasia, or cancer) by procedures (such as, laser or electrocoagulation) that literally destroy the tissue. The results of ablation therapy in Barrett's with dysplasia (as well as without dysplasia, which is discussed in the next section) have produced two conclusions. One is that ablation succeeds in more than half the cases. The second is that the recurrence rates at different centers differ widely.
Photodynamic therapy is a powerful method of ablation therapy. This technique involves the intravenous administration of a photosensitizing agent (for example, sodium porfimer) that is taken up by the dysplastic Barrett's cells. Approximately 48 hours later, a laser is used to burn the photosensitized Barrett's cells which are sensitive to the laser because of the photosensitizing agent. Normal tissue is not burned because it has not taken up the photosensitizing agent and is not sensitive to the laser. The dysplasia is eliminated in a majority of patients. However, some Barrett's esophagus remains untreated and need biopsy follow-up or additional ablation. Long-term studies will be necessary to demonstrate whether this technique prevents esophageal adenocarcinoma on a long term basis (for example, five years and longer after treatment).
One disadvantage of photosensitizing therapy is that skin takes up some of the photosensitizing agent, and this makes the skin sensitive to normal sunlight. The sensitivity may persist for six weeks or more and can result in sunburn even with minimal exposure to direct sunlight. Patients, therefore, must remain out of the sunlight for this period. Other photosensitizing agents being tested have much less skin sensitivity, but studies are needed to determine if they are effective in eliminating the dysplasia. Esophageal narrowings (strictures) are a common complication of PDT but can be managed by endoscopically stretching (dilating) them.
Other experimental methods of ablation are less powerful than PDT and have, therefore, been applied more often to low grade dysplasia and shorter segments of Barrett's with dysplasia (as well as to Barrett's without dysplasia, which is discussed in the next section). These methods of ablation include argon (flame) plasma coagulation (APC) and multipolar electrocoagulation (MPEC). They work by burning off the dysplasia and the Barrett's lining cells using devices that are introduced through the endoscope.
Another experimental method to treat dysplasia, especially high grade dysplasia, is the removal of dysplastic or cancerous areas of the mucosa by cutting (resecting) them out. The resection is done using snares at endoscopy, in a manner similar to the way polyps of the colon are removed at colonoscopy. Again, 5-year follow-up data is necessary to determine if EMR is effective.
The newer drugs used to treat arthritis, the COX-2 inhibitors, have been studied in Barrett's-associated dysplasia. The purpose of these studies is to see if these drugs can downgrade the severity of dysplasia or prevent dysplasia. This approach, which is called chemoprevention, is based upon the observation that adenomatous polyps of the colon in patients with familial polyposis (hereditary multiple colonic polyps) decrease (regress) after treatment with these drugs or even with the older nonsteroidal antii-nflammatory drugs (NSAIDs).
The theoretical reason to try COX-2 inhibitors in Barrett's dysplasia is that the enzyme cyclooxygenase (COX), which these drugs inhibit, ispresent in large amounts in Barrett's dysplasia, as it is in adenomatouspolyps of the colon.
It should be stressed that long-term therapy with these drugs in Barrett's esophagus should remain in the experimental arena because of the complications or side effects associated with these drugs (for example, cardiac, kidney and gastrointestinal problems).
In an ideal world, all Barrett's esophagus, with or without dysplasia, would be ablated for life. Thereby, both Barrett's and its attendant risk of cancer would be eliminated. Experimental ablation (as described above for dysplasia) is being evaluated in Barrett's without dysplasia. However, long-term studies are needed to prove the durability of the ablation (for example, with antireflux surgery or acid-suppressing drugs).
Barrett's mucosa without dysplasia can be destroyed by using argon plasma coagulation and multipolar electrocoagulation techniques. (As already mentioned, the more powerful PDT has been used most commonly for high grade dysplasia and cancer.) To prevent recurrence of Barrett's after ablation, however, requires the elimination of reflux for life, either with high dose acid suppressing drugs or anti-reflux surgery (fundoplication).
After an ablation procedure, the normal squamous lining in the esophagus grows back. Sometimes, however, after ablation therapy, the residual Barrett's mucosa remains under the new lining. The outcome and importance of this subterranean Barrett's is not known. It should be stressed that ablation therapy is experimental and should be restricted to formal studies.
Most of the future developments in the field of Barrett's esophagus will depend on the results of research studies. The goals of such studies would be to:
 FODMAP basso a lungo termine | Un dietista spiega
FODMAP basso a lungo termine | Un dietista spiega
 Rischio ridotto di ostruzione intestinale con un intervento chirurgico meno invasivo:studio
Rischio ridotto di ostruzione intestinale con un intervento chirurgico meno invasivo:studio
 Indigestione (dispepsia, mal di stomaco sconvolto)
Indigestione (dispepsia, mal di stomaco sconvolto)
 La vibrazione di tutto il corpo aiuta a ridurre l'infiammazione,
La vibrazione di tutto il corpo aiuta a ridurre l'infiammazione,
 Trattamento per gas imbarazzante
Trattamento per gas imbarazzante
 Naomi di Milk for the Morning Cake
Naomi di Milk for the Morning Cake
 COVID-19 o meno, dovresti fare la colonscopia
Ai San Antonio Gastroenterology Associates &Endoscopy Centers, lo screening delle colonscopie è sicuro, conveniente e, soprattutto, potenzialmente salvavita. Sebbene larresto del COVID-19 che ha me
COVID-19 o meno, dovresti fare la colonscopia
Ai San Antonio Gastroenterology Associates &Endoscopy Centers, lo screening delle colonscopie è sicuro, conveniente e, soprattutto, potenzialmente salvavita. Sebbene larresto del COVID-19 che ha me
 sorbitolo orale
Presentazione di miti e fatti sulla costipazione Immagini di presentazione di emorroidi Costipazione:cibi da mangiare, cibi da evitare Cosè il sorbitolo orale? A cosa serve il sorbitolo orale? Quali
sorbitolo orale
Presentazione di miti e fatti sulla costipazione Immagini di presentazione di emorroidi Costipazione:cibi da mangiare, cibi da evitare Cosè il sorbitolo orale? A cosa serve il sorbitolo orale? Quali
 Naviga durante le festività natalizie:3 consigli per evitare problemi di stomaco comuni
Riesci a credere che sia di nuovo quel periodo dellanno? La fine di novembre dà il via a un periodo festivo ricco di opportunità per feste che celebrano gli amici, la famiglia e sì, il cibo. Anche c
Naviga durante le festività natalizie:3 consigli per evitare problemi di stomaco comuni
Riesci a credere che sia di nuovo quel periodo dellanno? La fine di novembre dà il via a un periodo festivo ricco di opportunità per feste che celebrano gli amici, la famiglia e sì, il cibo. Anche c